贝参茱萸方抑制H22肝癌模型小鼠肿瘤生长的作用及其分子机制
陈燕妮 王兰兰 查青 史海龙 冯雪松 晁旭
中医药在治疗肿瘤方面有着上千年的经验积累,中医学者在肿瘤免疫和重塑肿瘤微环境以及诱导细胞凋亡和自噬[1]等多个方面研究中药单味药、复方药对肿瘤的治疗作用。实验组前期研究表明,贝参茱萸方含药血清对HepG2细胞的生长具有抑制作用,其抑制作用与含药血清的浓度具有相关性,贝参茱萸方含药血清能够诱导HepG2细胞发生凋亡,将细胞周期阻滞于G1期[2]。本实验通过贝参茱萸方对H22肝癌荷瘤小鼠肿瘤的抑制作用和机制进行研究,进一步评价中医药治疗肿瘤的效果。
1 材料与方法
1.1 实验动物
SPF级40只雄性昆明小鼠,周龄为6~8周,购自北京维通利华实验动物技术有限公司,实验动物编号:SCXK(京)2016-001。
1.2 药物与试剂
贝参茱萸方处方:土贝母20 g、西洋参15 g、绞股蓝10 g、山茱萸10 g、生甘草5 g。购自陕西中医药大学校医院。将60 g中药材先加1000 mL的超纯水浸泡2小时,然后加热煎煮1小时倒出药液,再次加入1000 mL的超纯水煎煮1小时,分离药渣,保留所煎出的药液。将第1次和第2次药液混匀,继续熬制药物将药物调制为1 g·mL-1、0.5 g·mL-1、0.25 g·mL-1三个不同浓度于-4℃冰箱储存;H22细胞(编号:ZQ0109)购自上海茂科生物科技有限公司。
1.3 瘤细胞悬液的制备
将冻存H22细胞复苏,传代2次后,用PBS溶液将细胞调制成1×107个/mL的细胞混悬液。然后将0.1 mL瘤细胞混悬液接种在2只昆明小鼠的腹腔内,7天后,小鼠腹腔内长满瘤性腹水。用1 mL无菌针管抽取小鼠的腹水,1000 rpm 离心5分钟,然后用生理盐水调制成1×107个/mL瘤细胞混悬液,备用。
1.4 实验动物分组及给药
40只昆明小鼠适应性饲养一周,于造模前12小时禁食不禁水,造模当天用随机分组法将40只小鼠分为5组,分别为空白组、模型组、贝参茱萸方高浓度组、贝参茱萸方中浓度组、贝参茱萸方低浓度组,每组8只,分组完成后给除空白组外的所有小鼠的右前肢皮下接种制备好的细胞混悬液0.1 mL,接种好后每组小鼠尾巴用记号笔标号,在空白组小鼠右前肢皮下注射0.1 mL生理盐水,用记号笔尾巴标号。造模后第二天用不同浓度药物进行小鼠灌胃,贝参茱萸方高浓度组灌胃药液浓度为1 g·mL-1、贝参茱萸方中浓度组药液灌胃浓度为0.5 g·mL-1、贝参茱萸方低浓度组药液灌胃浓度为0.25 g·mL-1,灌胃周期为30天。空白组与模型组用生理盐水灌胃治疗,所有小鼠的灌胃剂量为0.4 mL/只,每日一次。
1.5 动物一般情况观察
观察小鼠的饮食、睡眠、活动、皮毛颜色等,测量小鼠的体重、饮食、肿瘤大小变化,观察小鼠的死亡只数并记录死亡时间。待小鼠成瘤后每隔3日对小鼠体重、饮食量进行测量并用游标卡尺测量小鼠肿瘤的长短直径分别记为a、b,用以下公式计算肿瘤体积:肿瘤体积=a×b2/2;
1.6 标本采集
末次灌胃2小时后用颈椎脱臼法快速处死各组小鼠,用玻璃分针小心剥离小鼠瘤组织,将每只小鼠的瘤组织用生理盐水冲洗两遍,1/2瘤装入冻存管放-80℃冰箱储存,其余1/2瘤组织用4%的多聚甲醛固定。
1.7 检测指标
HE染色法分析肿瘤组织病理情况;免疫组化法分析Ki67在各组H22肝癌荷瘤小鼠内的阳性细胞率将包埋切片的片子按照二步法免疫组化试剂盒(DAKO,K5007)说明进行检测。每个组至少选取3张不同的片子进行拍照,应用Image-Pro Plus 6.0软件分析得出总细胞数量和阳性细胞数量得出阳性细胞率(%)=(阳性细胞数/总细胞数×100);Western blot法检测肿瘤组织中caspase-3、caspase-9的蛋白表达情况:液氮研磨肝癌组织,提取蛋白,蛋白定量后上样转膜,一抗孵育过夜,洗净一抗(Servicebio,GB11026),加入二抗(Servicebio,GB23303),2小时后暗室曝光并扫描胶片分析灰度值。
1.8 统计学处理

2 结果
2.1 一般状态
各组小鼠在30天的治疗过程中,模型组及贝参茱萸方高浓度组各有1只小鼠在未长出肿瘤前死亡,死亡原因可能为灌胃操作不当。成瘤后小鼠死亡情况:模型组小鼠死亡两只、贝参茱萸方中浓度组死亡2只、贝参茱萸方低浓度组死亡1只、空白组和贝参茱萸方中浓度组无小鼠死亡。带瘤小鼠随瘤体逐渐长大出现了行动受限、后期出现跛行、皮毛颜色暗淡无光泽、脱毛、消瘦、精神状态差,肿瘤处出现破溃;用药组小鼠也出现了行动受限、但精神状态比模型组佳,其中贝参茱萸方中浓度组的小鼠行动与精神状态最好,皮毛颜色光亮,用药组小鼠肿瘤均未破溃。
2.2 各组小鼠体重变化
各组小鼠的体重均呈增长趋势;空白组小鼠的体重变化幅度小,模型组和贝参茱萸方高浓度组的小鼠体重增长幅度最大。结果见图1。

图1 贝参茱萸方抑制H22肝癌荷瘤小鼠肿瘤实验 各组小鼠平均体重变化图
2.3 各组小鼠肿瘤体积变化
于造模后第8天开始对肿瘤大小进行测量:(1)空白组小鼠未成瘤,未纳入统计;(2)各组肿瘤体积大体呈增长趋势;(3)在8~20天时,模型组与给药组肿瘤体积大小区别不大;(4)第28天 时:贝参茱萸方中浓度(0.5g·ml-1)肿瘤体积最小,模型组肿瘤体积最大;与模型组相比,贝参茱萸高、中浓度组小鼠肿瘤体积在第28天时明显减小,且结果具有统计学意义(P<0.05)。结果见图2。
2.4 肿瘤组织HE染色结果
(1)空白组小鼠皮下无肿瘤细胞,模型组小鼠肿瘤组织中癌细胞排列紧密,未见细胞的大片坏死区域和细胞凋亡;(2)与模型组比较,给药组的肿瘤细胞密度均有减小,且各组细胞形态有不同程度的坏死和凋亡区域,其中贝参茱萸方低浓度组的细胞形态改变最为明显,贝参茱萸方中浓度组的细胞密度最小。结果见图3。
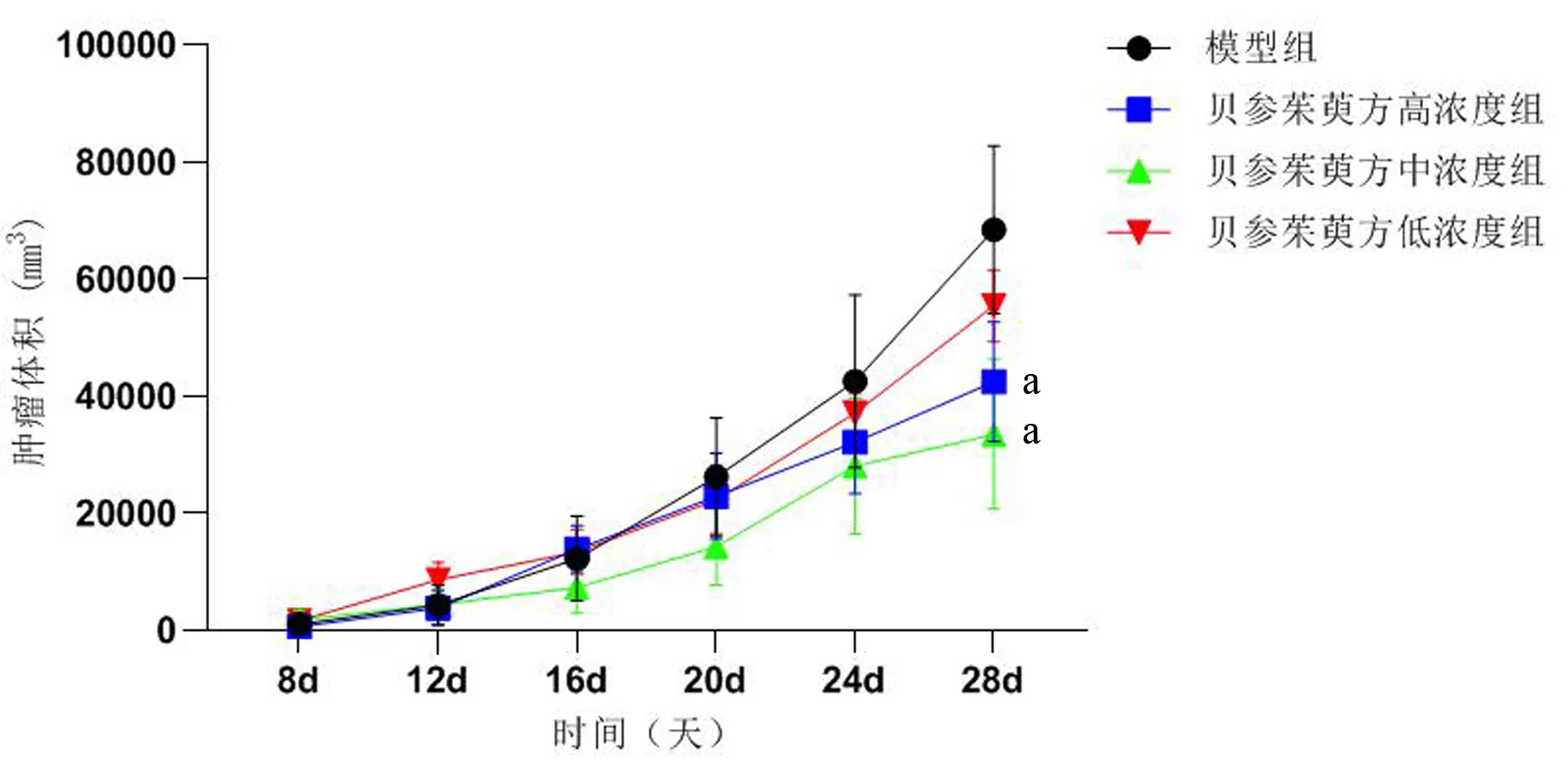
注:与模型组相比,aP<0.05。

注:A:空白组;B:模型组;C:贝参茱萸方高浓度组;D:贝参茱萸方中浓度组;E:贝参茱萸方低浓度组。
2.5 各组肿瘤组织中Ki67免疫组化结果
与空白组比较,模型组小鼠体内Ki67的阳性表达明显(P<0.05)。与模型组相比,贝参茱萸方高浓度组和中浓度组降低(P<0.05),结果见图4、表1。

注:A:空白组;B:模型组;C:贝参茱萸方高浓度组;D:贝参茱萸方中浓度组;E:贝参茱萸方低浓度组。

表1 贝参茱萸方对H22荷瘤小鼠皮下瘤组织中 Ki67表达的阳性率比较
2.6 各组小鼠肿瘤组织中caspase-3和caspase-9的表达
与空白组比,caspase-3、caspase-9在模型组中的表达降低(P<0.05)。与模型组相比,促凋亡因子caspase-3在贝参茱萸方高浓度组、中浓度组的表达升高(P<0.05),贝参茱萸方高浓度组可以促进促凋亡因子caspase-9蛋白水平的表达(P<0.05)。结果见图5、表2。

注:A:空白组;B:模型组;C:贝参茱萸方高浓度组;D:贝参茱萸方中浓度组;E:贝参茱萸方低浓度组。

表2 贝参茱萸方对各组小鼠肿瘤组织中 caspase-3和caspase-9的表达比较
3 讨论
贝参茱萸方中土贝母为君药、西洋参和山茱萸为臣药、绞股蓝为佐药、使药生甘草,全方具有滋阴补肾和益气健脾功效,通过疏肝理气、活血化瘀共凑遏制癌毒的作用[3]。该方中土贝母的皂苷类物质是其对抗肿瘤最有效的成份,有研究者[4]用土贝母皂苷作用于转染过绿色荧光蛋白(GFP)基因的人乳腺癌细胞MDA-MB-231和MCF-7作用24小时后,细胞MDA-MB-231和MCF-7明显凋亡,在48小时后MDA-MB-231和MCF-7的IC50为(17.03±3.22)、(27.96±0.34) μg·mL-1;土贝母皂苷Ⅰ、Ⅲ能够抑制肿瘤细胞K562的生长并将细胞周期阻滞的S期以前[5]。土贝母皂苷联合化疗药对宫颈癌Hela细胞株诱导24小时后,细胞周期阻滞于G2/M期,土贝母皂苷对细胞Hela的抑制率与药物浓度和诱导时间呈正相关[6]。西洋参中抗肿瘤的有效成分主要为人参皂苷,西洋参可以抑制肿瘤细胞的生长、对肿瘤细胞具有诱导凋亡、抑制分化等作用[7]。有研究表明山茱萸对肝癌大鼠肿瘤的抑制机制是通过上调肿瘤组织中B7-H6的表达[8]。山茱萸通过线粒体介导的凋亡通路对由TNF-α和D-氨基半乳糖所致的肝癌细胞具有抑制作用[9]。中药绞股蓝的抗癌机制主要从增强T、B细胞的增殖提高免疫、抑制相关酶的代谢活性以及干扰细胞周期方面起到对抗肿瘤的功效[10];甘草中的甘草酸和甘草次酸是肿瘤治疗中起主要作用的成分[11],可以在诱导肿瘤细胞凋亡、调节免疫等方面发挥抗肿瘤作用。
Caspase家族是一种直接诱导细胞凋亡解体的蛋白酶系统[12],内源性凋亡途径主要在由线粒体介导的细胞色素C(Cytochrome C)中,当细胞色素C当被释放出来后立即与胞质中的caspase-9相联合,并形成凋亡体,进而启动caspase-3发生作用,致使细胞出现凋亡改变[13]。caspase-3、caspase-9的异常表达与胃癌、乳腺导管癌等肿瘤的恶化与转移密切相关[14-15]。近年来很多研究表明caspase-3、caspase-9在促进肿瘤细胞凋亡的过程中发挥重要的作用。周进等研究显示[16],在诱导肾癌模型小鼠的凋亡过程中,白花蛇舌草能够明显促进相关蛋白caspase-3、caspase-9的表达,提高抑瘤率。聂艳萍等[17]在研究吉西他滨诱导HepG2细胞凋亡的机制中发现,在用吉西他滨作用于HepG2细胞24小时后细胞表面的caspase-3、caspase-9的表达均增强。贝参茱萸方对肿瘤的抑制可能与其增强了肿瘤组织中caspase-3、caspase-9蛋白水平的表达水平相关。
实验发现贝参茱萸方可以明显改善小鼠的状态,经药物治疗后的小鼠平均每日饮食量比模型组高,皮毛颜色有光泽,脱毛现象少,小鼠活动随着肿瘤的增大有所受限,但未出现跛行,肿瘤小鼠均出现消瘦,但药物组小鼠消瘦较模型组不显,用药组小鼠未出现肿瘤破溃,小鼠带瘤生存状态较好,其中贝参茱萸方中浓度组对于改善小鼠状态以及增加小鼠饮食量的效果最为显著。在今后临床治疗肝癌时贝参茱萸方可以配合西医放化疗增强治疗功效,改善患者带瘤生存质量。
——登高远眺,遍插茱萸

