基于T2WI影像组学及联合诊断模型鉴别腮腺多形性腺瘤与腺淋巴瘤
吴艳,谢元亮,张树桐,王翅鹏,马锋,王翔
腮腺肿瘤大多数为良性,最常见为上皮来源的多形性腺瘤和腺淋巴瘤,两者占80%~90%[1]。虽同为良性肿瘤,但腺淋巴瘤术后局部复发率及恶变风险(低于1%)均明显低于多形性腺瘤,部分术前确诊的腺淋巴瘤患者可不必进行手术治疗[2-3]。多形性腺瘤手术时仅保留面神经,需切除肿瘤和累及的腮腺腺体,而腺淋巴瘤极少恶变仅需行肿瘤切除。上述两种腮腺肿瘤的手术方式及转归不同,术前准确诊断具有重要意义。因恶性肿瘤穿刺可能导致种植转移,且细针获取的组织较少或病灶囊变而导致诊断不明或误诊,临床上一般不建议进行细针穿刺活检[4-5]。两类肿瘤的常规影像学特征有一定重叠。纹理分析可提供肉眼无法观察到的客观信息,目前在肿瘤类型的鉴别、分期和预后方面已有较多研究[6-7]。T2WI作为临床常用的MRI序列,能提供高信噪比的腮腺图像。本次回顾性研究采用影像组学方法,建立基于常规MR T2WI的纹理特征及临床资料的联合诊断模型来鉴别腮腺多形性腺瘤与腺淋巴瘤,旨在提供一种可量化的鉴别诊断新思路。
材料与方法
1.临床资料
回顾性分析2015年1月-2019年11月本院确诊为腮腺多形性腺瘤或腺淋巴瘤的99例患者(共124个病灶)的临床及影像资料。其中,男71例,女28例;多形性腺瘤45例(47个病灶),病灶最大径为1.28~6.19 cm,平均(2.81±1.23) cm;腺淋巴瘤54例(77个病灶),病灶最大径0.81~4.97 cm,平均(2.37±1.01) cm。
病例纳入标准:①经手术病理证实;②腮腺MR检查前未接受穿刺、放化疗等治疗;③在同一台MR成像仪上进行MRI扫描,且采用相同的成像参数。排除标准:因图像伪影明显、噪声较大等原因使得图像质量不符合后处理要求者。
2.MRI检查方法
使用Philips Achieva TX 3.0T磁共振扫描仪和16通道相控阵线圈。扫描序列和参数如下。冠状面T2WI:TR 3000 ms,TE 100 ms,层厚3.0 mm,层距3.0 mm,视野24 cm×24 cm;横轴面T1WI:TR 600 ms,TE 20 ms;横轴面STIR序列T2WI:TR 5000 ms,TE 50 ms,层厚3.0 mm,层距1.5 mm,视野32 cm×32 cm。
3.影像组学分析
病灶ROI的分割及特征提取:由2位具有10年以上工作经验的放射科医师共同阅片并达成一致意见。在冠状面T2WI上确定肿瘤最大层面,沿病灶边缘勾画ROI。由于腮腺肿瘤的囊变和坏死发生率较高,本研究中勾画ROI时并未避开囊变、坏死区,以反映病灶的整体特征;病灶为多发者,在每个病灶内勾画ROI。第1位医师勾画ROI并进行特征提取,1周后再进行第2次,用于评估同一测量者的可重复性;第2位医师仅进行一次ROI的勾画及特征提取,用于评价2位医师之间的测量一致性。使用荷兰MaZda B11 4.7软件(www.Eletel.p.Lodz.PI/mAzda),自每个ROI内提取310个影像组学特征。所有经标准化处理后的图像,其灰阶范围为(μ-3δ,μ+3δ),其中μ和δ分别为平均灰度值和标准差。
纹理特征的筛选和影像组学标签的建立:采用R语言软件3.6.1版(http://www.R-project.org),按分层随机抽样方法,将纳入研究的患者按7:3的比例分为训练集(70例)和验证集(29例)。影像组学特征值中的缺失值和异常值采用邻近值代替。采用R语言软件中scale函数进行数据标准化,采用最小冗余最大相关(mimimum-redundancy maximum-relevancy,mRMR)算法对训练集中基于冠状面T2WI提取的310个影像组学特征进行降维,最终保留20个特征;随后,采用最小收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归分析进一步进行筛选,最后将剩余的影像组学特征与对应的加权系数乘积的线性组合依次形成训练集中每个患者的影像组学标签(Radscore)。采用Wilcoxon检验分别计算训练集和验证集中两类肿瘤的Radsore是否有统计学差异。如有差异,根据Radsore数值计算出鉴别两类肿瘤的阈值,按Radsore小于阈值及大于阈值,分为多形性腺瘤组及腺淋巴瘤组。
4.病灶的测量和分区
于横轴面STIR T2WI序列上选取病灶最大层面测量其直径。以下颌后静脉与胸锁乳突肌内侧连线将腮腺分为深叶和浅叶;在冠状面图像上,以耳垂为界,将腮腺分为上极和下极。
5.统计学分析方法
对两组患者基本临床资料的比较,采用Kolmogorov-Smirnov检验分析计量资料是否符合正态分布,正态分布的变量以均数±标准差表示,非正态分布者以中位数(上、下四分位数)表示。采用Levene检验检测方差齐性,若满足正态分布且方差齐,组间比较采用独立样本t检验,不满足则采用Mann-WhitneyU秩和检验。对计数资料采用频数表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异具有统计学意义。
对测量者前后2次及2位测量者之间提取的组学特征的一致性评价采用组内及组间相关系数(intra- and inter-class correlation,ICC),ICC>0.80认为一致性较好。采用多变量logistics回归分析构建联合影像组学标签和临床资料预测模型,筛选独立预测因子。
采用受试者工作特征曲线(ROC)和曲线下面积(area under the curve,AUC)来评价影像组学标签及联合诊断模型的诊断效能。采用Hosmer-Lemeshow拟合优度检验(good of fit test)分析模型的拟合度。
结 果
1.基本临床资料
训练集和验证集中患者基本临床资料的比较见表1。两个被试集之间患者的年龄和性别构成、肿瘤的发生部位、单发或多发和病理类型的差异均无统计学意义(P>0.05)。
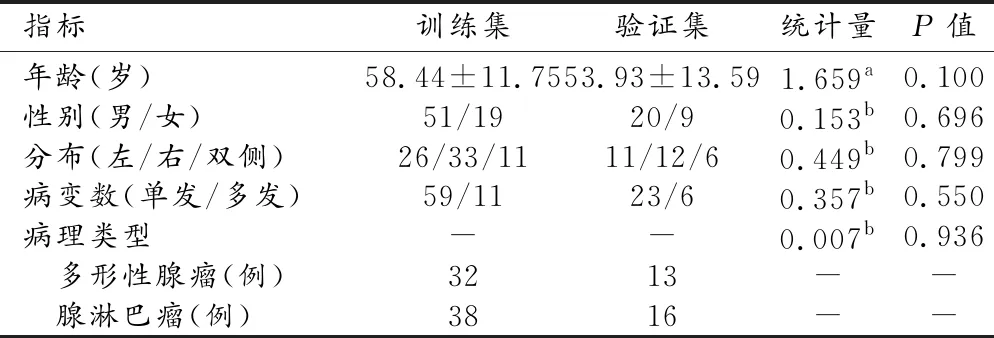
表1 训练集与验证集患者一般资料比较结果 (例)
在训练集和验证集中,腮腺多形性腺瘤组与腺淋巴瘤组之间各项临床资料的比较见表2。在两个被试集中,两组肿瘤患者的年龄和性别及肿瘤的发生部位、单发或多发和病灶位置(上极/下极)的差异具有统计学意义(P<0.05)。

表2 训练集和验证集中腮腺多形性腺瘤与腺淋巴瘤两组患者临床资料比较结果 (例)
2.测量一致性
同一测量者先后2次提取的影像组学特征的ICC范围为0.736~0.893,两位测量者之间的ICC范围为0.724~0.905,一致性均较好。
3.影像组学标签的建立
基于T2WI提取的组学特征经mRMR 算法及LASSO回归分析最终筛选出8个影像组学特征(图1),建立的影像组学标签数值:
Radscore=0.251×Vertl_GLevNonU+0.134×Skewness+0.227×S(5,5)Correlat+0.408×X45dgr_LngREmph-0.131×Teta4+0.187×WavEnHH_s.3+0.183×S(5,-5)Correlat-0.027×Teta1+0.201
训练集中,多形性腺瘤组的影像组学标签数均值为-0.23559,腺淋巴瘤组为0.56874,差异有统计学意义(P<0.01);验证集中,多形性腺瘤组的影像组学标签数均值为-0.30249,腺淋巴瘤组为0.47096,差异有统计学意义(P<0.01)。
4.联合模型构建、诊断效能评价及拟合度评价
将年龄、性别、肿瘤发生的部位、单发或多发以及病灶位置(上极+下极)等临床资料,与影像组学标签联合构建的多变量logistics回归模型的特征见表3。
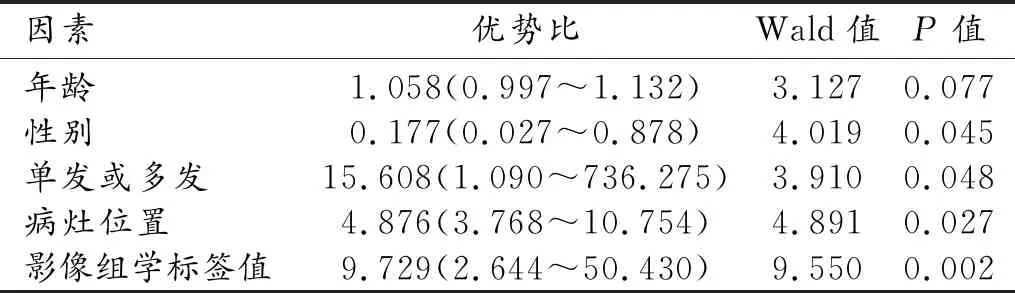
表3 联合模型鉴别腮腺多形性腺瘤与腺淋巴瘤
联合模型和影像组学标签鉴别腮腺多形性腺瘤与腺淋巴瘤的诊断效能指标见表4。两者均具有较高的诊断效能,联合模型的AUC高于影像组学标签(图2),差异具有统计学意义(P=0.000)。

表4 训练集和验证集中影像组学标签和联合模型鉴别多形性腺瘤与腺淋巴瘤的诊断效能指标
Hosmer-Lemesow拟合优度检验结果显示,训练集和验证集中模型预测值和实际值的差异均无统计学意义(训练集:χ2=9.424,P=0.308;验证集:χ2=7.565,P=0.477)。训练集和验证集中联合模型区分两种腮腺肿瘤的校准曲线显示训练集(左)与测试集(右)中拟合曲线在对角线(预测与实际发生完全重合)周围小幅摆动(图3),表示预测值接近实际值,拟合效果较好。
讨 论
多形性腺瘤和腺淋巴瘤作为腮腺最常见的良性肿瘤,国内外已开展了较多相关研究,影像学研究多集中于病灶的形态、密度或信号特点、强化方式及功能成像等[8-10],不同的强化方式及ADC值的差异可较好反映两者不同的血供及病灶内水分子扩散特征。但上述方法可能会增加成本和检查时间,且增强扫描时其强化方式易受到评价者主观因素的影响。在实际工作中有部分病灶缺乏常规影像检查中常见的特异性征象而导致误诊。纹理分析利用高通量的数据,能提供肉眼无法观察到的一阶、二阶和高阶纹理特征,近年来已逐步应用于腮腺肿瘤的鉴别诊断等方面[11],有研究者通过一阶的直方图分析(如ADC直方图、T2WI直方图)来分析多形性腺瘤和腺淋巴瘤的差异[12]。除影像学特征外,这两类肿瘤在临床表现方面也具有一定的差异,但既往较少有研究者综合影像及临床资料并以量化方式来构建鉴别诊断模型。本研究中利用无需增强的MRI序列,通过纹理分析结合临床相关资料来构建诊断模型,旨在为临床提供一种扫描相对简便、综合影像和临床特点的可量化分析的诊断新思路。
既往已有较多研究者发现通过T2WI上的信号特点可鉴别常见的腮腺肿瘤[13-15],多形性腺瘤的T2弛豫时间明显高于腺淋巴瘤。从病理学特点来看,光镜下显示多形性腺瘤以结构的多形性为特征,其内由上皮细胞、变异肌上皮成分、黏液和软骨组织等混合构成,而腺淋巴瘤主要由腺上皮及淋巴样间质构成,上皮下间质内充满淋巴细胞,这种组织病理学特点的差异可能是导致两者的T2弛豫时间不同的原因。本研究通过提取、比较T2WI上肿瘤的纹理信息来反映两者间的差异。
本研究中,所提取的影像组学特征经筛选后保留的主要包括直方图参数、灰度级不均匀性参数、共生矩阵和自回归模型等。
比较多形性腺瘤与腺淋巴瘤的纹理参数后发现,腺淋巴瘤的偏度(skewness)为正值,说明腺淋巴瘤信号强度均值的左侧的离散度较右侧弱,即低灰度值出现的频率更高,即腺淋巴瘤在T2WI上的信号较低;反之,多形性腺瘤的偏度为负值,说明高灰度值出现的频率更高,即多形性腺瘤在T2WI上的信号较高(图4、5)。本研究结果与既往研究中显示的腺淋巴瘤在T2WI上多表现为不均匀等信号、而多形性腺瘤多表现为高信号的特点基本相符[9-12]。多形性腺瘤的间质内黏液样和软骨样组织丰富,故T2WI上显示为较高信号。腺淋巴瘤的(grey level non-uniformity,GLNU)大于多形性腺瘤,该值越大,说明灰度级的差异较大,即病灶内的信号差异大。分析原因,推测是因为腺淋巴瘤由上皮样和淋巴样组织构成,上皮组织分泌液淤积使得局部在T2WI上信号增高而分隔囊腔的纤维间质在T2WI上信号较低。腺淋巴瘤的长游程增强(long run emphasis,LngREmph)值大于多形性腺瘤,该值越小,代表局部的纹理越细,除去腺淋巴瘤中的液性成分,其实质部分仅为上皮样和淋巴样组织,组织成分较多形性腺瘤要简单,故纹理较细,而多形性腺瘤的成分复杂,纹理相对较粗。影像组学标签值在两组间的差异具有统计学意义,并且其鉴别2类肿瘤的AUC在训练集和验证集中分别为0.83和0.82,提示基于常规MR T2WI的纹理特征在鉴别腮腺多形性腺瘤与腺淋巴瘤已具有较高的诊断价值。
本研究中性别的OR值小于1(男性设置为0女性设置为1),表明男性相对好发,但OR值较接近1,表明性别对病灶的鉴别诊断的价值较小,这与既往部分研究结果有一定差异,一方面可能与样本量相对较小有关;此外,有研究指出近年来腺淋巴瘤女性发病率明显升高[14],可能也是本研究结果中性别的鉴别诊断价值相对较小的原因之一。多发、影像组学标签数值越大、位于腮腺下极(上极设置为0,下极为1)倾向于腺淋巴瘤的诊断;且单发或多发、影像组学标签数值及位置的OR绝对值较大,提示这3个指标对两类肿瘤的鉴别诊断价值较大。本研究中构建的联合模型中年龄这一因素的鉴别诊断价值有限,与既往部分研究中显示的腺淋巴瘤与多形性腺瘤在发病年龄上具有差异的结果不完全一致[16],笔者分析可能是由于两者同属良性肿瘤,病程较长,部分病灶较小者不易发觉导致就诊时年龄较大有关。本研究通过肉眼无法观察到的大量纹理信息及临床资料以量化方式建立模型,使鉴别诊断更加客观,联合模型在训练集和验证集的AUC分别为0.90和0.96,进一步提高了诊断效能,有助于指导临床制定更加准确的治疗方案。
本研究的局限性:第一、本研究为单中心回顾性分析,样本量较少,并缺乏外部数据的验证,有待进一步进行多中心、大样本的研究;第二、本研究采用文献报道中最常用的选取肿瘤最大截面的方法来提取纹理参数,不能反映肿瘤的全貌,可能会丧失部分具有特征性的纹理数据;第三、对纹理特征的提取仅基于MR平扫T2WI序列,序列较单一,无MR增强或其它功能成像序列的相关内容,有待今后进一步研究。综上所述,基于常规MR T2WI的影像组学标签结合临床资料建立的联合模型在鉴别腮腺多形性腺瘤与腺淋巴瘤中具有较高的诊断效能。

