IMR结合O-MAR技术抑制脑动脉瘤术后金属伪影的应用研究
付永春,周一楠,江滨,陈绪珠
1. 首都医科大学附属北京天坛医院 放射科,北京 100070;2. 飞利浦(中国)投资有限公司,北京 100026;3. 首都医科大学附属北京天坛医院,北京市神经外科研究所 神经流行病学室,北京 100070
引言
颅内动脉瘤破裂是蛛网膜下腔出血的常见的原因之一,血管内介入弹簧圈栓塞术具有并发症少、创伤小、治愈率高的特点,已经成为治疗颅内动脉瘤的一种非常安全、有效的方法[1]。颅内动脉瘤腔内栓塞治疗术具有微创、对患者神经功能损伤小等优点,死亡率及致残率均小于外科夹闭,近年来被广泛应用,但相对外科夹闭仍具有较高的复发率,需长期随访[2]。术后在颅脑内病变部位置入的弹簧圈在复查时常常产生很大的金属伪影,影响临床医生对手术的评估及术后进一步治疗方案的制定。而金属伪影主要是由于金属与人体组织密度相差过大导致的,其中主要包括射束硬化金属伪影、光子饥饿伪影和散射伪影[3-5]。在常规CT检查图像中,因光子的饥饿效应以及线束硬化的影响,会使得弹簧圈周围出现诸多的条带状伪影,影响CT图像质量,从而影响对动脉瘤体周围结构的评价,以及对术后疗效的评估[6]。随着设备的更新,各种去金属伪影技术也使这一问题得到了一定程度的解决[7]。
传统方式通过升高管电压来降低金属伪影对于图像的影响,但效果并不令人满意,同时又增加了受检者的辐射剂量。近年来,随着扫描技术以及后处理技术的发展,从插值算法到能量减影成像,虽然取得了一定程度的进步,但仍然存在一定的局限性[8]。IMR技术是新一代的迭代重建算法,具有降低图像噪声和提高图像对比信噪比(Contrast Signal to Noise Ratio,CNR)及图像质量的优点[1,9-10]。Philips去金属伪影迭代算法(O-MAR)是一项基于线性内插法的可去除金属伪影的重建方法[11]。依托强大的微平板探测器,O-MAR技术在CT的原始投影数据空间运用迭代算法对符合金属伪影覆盖下数据物理模型进行精确计算,从而获得大幅减低金属伪影的图像质量,是迭代技术的创新和延伸。打破了传统CT受金属伪影影响无法扫描的禁忌。在实际临床应用中,该功能在应用于较大和复杂的金属内植入物(例如:人工股骨头),也几乎没有空间分辨率层面的损失或者增加新的伪影。
O-MAR技术具有能谱去金属伪影的作用,但不能减低辐射剂量。iDose4是混合迭代技术具有手动降低辐射剂量并提高图像质量的功能。鉴于此,本研究从临床实际应用方面,探究显微CT的IMR平台结合O-MAR技术在抑制金属伪影技术方面,在脑部动脉瘤手术后检查的效用,并进一步探讨哪种重建方法能对患者术后病变周围正常组织恢复情况观察及应用价值的评估效果更好。
1 材料和方法
1.1 患者资料
回顾性分析在2018年12月至2019年12月在我院神经外科接受脑部动脉瘤夹闭手术或者栓塞手术并在Philips Brilliance 256 iCT上进行头颅平扫复查的60例患者,所有患者均通过了本院的医学伦理委员会的批准。患者的扫描数据均被纳入本次研究。其中男36例,女24例,年龄25~86岁,平均(56.15±18.26)岁。其中包括动脉瘤夹闭术后患者21例;动脉瘤栓塞术后患者39例。扫描检查结束后分别对60例患者的原始扫描数据保存,并进行IMR+O-MAR薄层重建及iDose4薄层重建。将iDose4迭代薄层重建图像设置为A组,IMR+O-MAR薄层算法重建图像设置为B组。纳入标准:在我院接受颅内动脉瘤栓塞手术或动脉瘤夹闭手术术后的患者。排除标准:有严重的运动伪影和其他金属伪影;影像诊断有脑出血、脑梗死、脑萎缩和明显颅内占位的或其它原因引起的脑组织结构严重变形等影响测量的病例。
1.2 扫描方法
所有患者均用Philips公司的Philips Brilliance 256 iCT螺旋CT扫描仪,扫描条件:管电压120 V,管电流310 mAs,扫描层厚5 mm,矩阵512×512。扫描野(Field of View,FOV):根据患者的头型不同进行分别具体选择。扫描后获取颅底至颅顶层面常规iDose4(Level 3)迭代重建原始图像。扫描结束后对60例患者的原始扫描数据分别进行IMR+O-MAR和iDdose4两种重建算法进行重建,其重建层厚和层间距均设置为1 mm。IMR+O-MAR重建Level为1,iDose4重建为3。将iDdose4(Level 3)迭代薄层重建图像设置为A组,IMR+O-MAR迭代薄层算法重建图像设置为B组。
1.3 图像评价
1.3.1 图像客观评价
所有薄层图像均传输至Philips IntelliSpace Portal星云后处理工作站,每例患者均选取平均数据中最重的伪影层面进行评价,为了一致性,所有检查患者的窗宽均设定为100 HU;窗位均设定为35 HU,以金属植入物为中心分别选取3个半径大约为80 mm的感兴趣区(Region of Interest,ROI),分别测量出每个ROI的CT值和SD值。同时选取其它不含伪影层面的相同组织结构,测其CT值和SD值作为对比参考。测量时同一患者所选层面的测量位置,选取面积大约90 mm2左右,测量范围应当保持一致性。感兴趣区的勾画应尽量避开伪影干扰区域和颅骨。分别测量出图像标准差的平均值(Standard Deviation,SD),并将其作为图像噪声值。将在横断位图像上伪影引起的黑影的最大长度距离作为伪影的最大直径。分别计算出伪影指数(Artifact Index,AI)和对比噪声比(Contrast to Noise Ratio,CNR)。
1.3.2 图像主观评价
观察时由2名高年资的神经影像诊断医师分别对2组薄层横断面图像进行独立盲评,在阅片者评分不一致时进行协商和统一,将得出最终评分结果并进行统计分析。按照图像质量受金属伪影的影响程度采用4分法[12]:1分代表伪影很重,图像无法观察;2分为图像伪影较重,图像尚能观察;3分为存在少量伪影,图像质量较好;4分为基本无伪影,图像质量好。
1.4 统计学分析
采用SPSS 17.0软件对数据进行分析。把客观测量数据和主观评分数据分别取均值纳入统计软件包进行分析。2组患者的图像噪声(SD值)、伪影直径最大值、AI和CNR,采用配对t检验;2组主观评分采用Mann-WhitneyU检验比较分析。P<0.05为差异具有统计学意义。采用Kappa分析检验比较2组主观评分之间的一致性评价:其中Kappa<0.40为一致性较差;0.40≤Kappa<0.75为一致性较好;Kappa≥0.75为一致性很好。
2 结果
2.1 图像的主观评价
两名诊断医师对IDose4组薄层重建图像的主观评分为(1.06±0.31);IMR+O-MAR组薄层重建图像的主观评分为(3.85±0.53),显示IMR+O-MAR组重建薄层图像在视觉上更平滑,伪影更微小,金属植入物对邻近正常组织结构的分辨率更高,两组图像间的差异具有统计学意义(P<0.001)。两名诊断医师的主观评价方面:一致性良好(Kappa=0.81,P<0.05)。
2.2 图像的客观评价
两组的客观评价结果,见表1。由表1可知iDose4组和IMR+O-MAR组薄层图像的平均噪声用(SD值)表示;分别为(7.6±3.8)、(24.85±11.38)HU;金属置入物的伪影最大直径分别为(123.21±32.36)、(7.51±7.12)mm;AI分别为(53.18±15.59)、(23.01±8.48);CNR 分别是(23.01±8.48)、(12.51±3.23)。差异具有统计学意义(P<0.05)。由客观评价结果可知,IMR+O-MAR技术组对提高图像质量,抑制金属伪影方面效果非常显著。如图1~2所示,iDose4薄层重建的图像和IMR+O-MAR薄层重建图像在抑制金属伪影技术方面,IMR+O-MAR能明显减低金属伪影对脑动脉瘤邻近的解剖结构和周围正常组织的影响,对于整体图像质量有明显改善。

图1 大脑中动脉动脉瘤术后两组图像对比
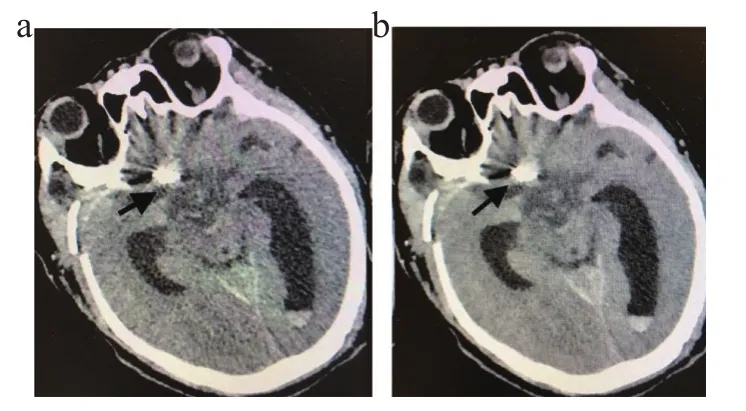
图2 大脑前动脉瘤夹闭术后两组图像对比
3 讨论
随着医疗技术的发展,医疗水平的提高,越来越多的带有金属植入物的患者需要进行CT检查。但是由于金属植入物导致的伪影,会严重影响图像质量,严重干扰医生进行快速、正确的诊断。
颅内动脉瘤是由先天畸形及后天病理改变导致的血管壁病变,起病突然且易破裂出血,破裂风险随时间延长而增加,动脉瘤一旦发生破裂造成蛛网膜下腔出血将会严重违纪患者生命临床目前主要采取开颅夹闭术及血管内介入动脉瘤栓塞术进行治疗[13]。颅内动脉瘤术后的影像学检查具有重要意义,可用于观察动脉瘤的残余、复发以及周边血管有无狭窄和痉挛等[13]。
对于脑动脉瘤术后复查的患者,弹簧圈和动脉瘤夹产生的金属伪影会使术区周围的组织结构细节显示不清,而且范围较大的伪影往往会产生假象,对术后精确评价及随访复查带来极大的挑战[12]。
IMR平台是目前最先进的全模型迭代技术,能明显降低图像噪声,显著提升图像的空间、密度及软组织分辨率;并明显优于FBP和混合迭代重建(iDose4)技术[14-16]。使以往CT在诊断及评估低对比病灶应用上的局限性有所突破,为影像医生提供更多的病灶信息和诊断信心。
本文所探讨的IMR结合O-MAR技术是以线性内插为基础,综合了各种技术的抑制金属伪影的迭代重建算法。其基本原理如下:首先应用标准加权的滤波反投影法进行阈值分割,建立一种只有金属的图像,再根据只有金属的图像投影确定因穿过金属而被损坏的投影,最后舍弃沿金属轨迹的投影,用未穿过金属的相邻投影的内插数据替换,从而达到减少金属伪影的效果[16-18]。

表1 两组患者的图像客观评分比较
因颅内结构组织对比分辨率低,例如灰质和白质之间的密度差异只有5~10 HU,传统上需要采用5~10 mm层厚图像进行病变的显示与评估,但是由于层厚图像容易受部分容积效应的影响,对于小的病变的评估一直是CT在颅脑病变应用方面的瓶颈。Suzuki等[19]研究表明IMR技术在1 mm薄层图像优势更明显。Nakaura等[20]对比了不同重建算法在1 mm与5 mm层厚对头CT图像质量的影响,研究者以丘脑和内囊的CT值、图像噪声、图像对比度、CNR和总体图像质量作为主客观评价指标。研究结果显示,在1 mm图像上,IMR的噪声远远低于FBP和HIR图像,并且丘脑和内囊间的主观对比度及CNR均优于其他两组,增强了对颅内小病灶的显示。
Wellenberg等[21]观察了IMR在抑制体内金属置入物伪影方面的作用,结果显示在联合应用O-MAR技术条件下,IMR平台对于整体图像质量的改善最明显;并且IMR技术具有提高CT值的准确性、降低噪声及提高CNR和SNR的作用,其对严重金属伪影的抑制最为有效。
在对CT扫描检查产生的金属伪影图像质量分析发现:IMR结合O-MAR技术对于脑内动脉瘤夹闭和栓塞术后置入的金属具有明显抑制优势。两组薄层迭代重建图像相比,iDose4重建组的薄层图像,其置入物周围的放射状金属伪影严重,置入物区域及周围组织结构影像有缺失,从而影响临床医生对该部位组织结构及病变的进一步观察和诊断。而使用IMR结合O-MAR技术薄层迭代重建图像,在置入的金属异物周围放射状伪影的范围明显变小,伪影显著变淡,其周边组织结构均匀区的SD值明显减低,且金属置入物周围组织结构能较清晰显示。两组数据存在显著差异,并具有统计学上的意义。
研究显示iDose4是混合迭代技术具有手动降低辐射剂量,提高图像质量的功能[9];同样IMR+O-MAR技术重建组图像在同等扫描条件下其噪声更低,图像显示更加平滑。在主观评价上,IMR结合O-MAR技术薄层迭代重建图像:主观评分增高显著且优势明显;在视觉上伪影显示更加微小,金属植入物对周围正常组织结构的影响更低,分辨度更加清晰,对邻近正常脑组织结构和与置入的金属异物衔接处同样显示良好。其所测的周围组织的CT值更接近于实际的CT值,能够更为真实地显示组织结构状态,对于患者术后可能发生的置入物周围组织的出血、炎症、水肿和坏死等情况,可以早期、及时的预判和发现,能为临床医师提供更多有价值的诊疗信息。
本研究的局限性:① 样本量偏少,有待进一步扩大样本;② 不同金属置入物的材料所产生的不同影响;③ 对金属置入物部位的脑组织和结构的显示进行更加精细的评价。
综上所述,IMR平台结合O-MAR技术在保持原有扫描方法的基础上能有效抑制脑内动脉瘤夹闭术和动脉瘤栓塞术后的金属伪影,能较清晰的显示颅内金属异物的形态及病变周围组织结构。同时有效抑制了因手术所附加的金属所产生的伪影,把病变以外周围正常脑组织的影响降到最低。这充分显示出了IMR+O-MAR技术的结合,在不增加辐射剂量的情况下能更大限度的使图像具备更好地金属伪影抑制能力,帮助医师做出更快且更准确地诊断结论,同时还具有操作简洁和安全的临床应用潜力,有助于进一步提高临床医生的诊断信心。

