CT-MR图像融合在脑胶质瘤术后放疗中的应用
柏正璐,李军,田书畅
1. 江苏省苏北人民医院 放疗中心,江苏 扬州 225000;2. 南京医科大学附属南京医院 医疗设备处,江苏 南京 210006
引言
脑胶质瘤是颅内常见的恶性肿瘤,我国脑胶质瘤的发生率占颅内肿瘤的 35%~60%[1-2]。目前,脑胶质瘤的治疗以外科手术为基础,但由于脑功能的特殊性和脑胶质瘤的浸润性生长的特点,临床上很难彻底切除肿瘤,需辅以术后放疗[3]。精确的靶区勾画是提高治疗效果的关键,CT定位图像是用于放射治疗勾画靶区的主要图像,但由于水肿带的存在,且脑胶质瘤术后易导致正常解剖结构改变,即使采用增强CT仍有部分病灶显像不清晰,辨识度不高,使脑胶质瘤术后放疗靶区的勾画存在误差[4]。MR图像对软组织特别是对肿瘤与组织水肿边界比较敏感[5],能清楚的显示肿瘤病变和周围结构的关系,在颅内肿瘤靶区勾画方面有明显的优势,但MR图像不能单独用于治疗计划系统。因此CT和MR图像的融合应用可以提供互补信息,更加精确地确定肿瘤浸润的范围,精确勾画靶区,从而提高肿瘤局部剂量,减少正常组织受量[6]。
前期报道关于CT-MR图像融合对颅内胶质瘤术后放疗的影响主要集中在靶区勾画方面,而有关融合前后放疗剂量学参数变化方面研究较少。本研究着重颅内胶质瘤术后放疗病例,将CT和MR图像融合后在三维治疗计划系统(Treatment Plan System,TPS)中进行靶区勾画,比较CT-MR融合后的靶区和CT图像上靶区的差异,以及剂量学的改变。
1 材料和方法
1.1 病例入组
选取我院2019年1月至2020年3月诊治的高级别脑胶质瘤术后放疗患者10例,Ⅲ级4例,Ⅳ6例,年龄33~72岁(中位年龄45岁),男性6例,女性4例。
1.2 影像获取
1.2.1 定位CT图像扫描
所有患者均为放疗仰卧位平躺于固定底板,头枕B/C枕,头颈肩热塑膜低温固定,在面膜上勾画好定位线,贴好金属标记点。使用GE大孔径CT进行增强CT扫描,层厚2.5 mm,扫描范围为全脑,扫描条件:120 kV,180 mAs。扫描后图像经网络传至Varian Eclipse治疗计划系统。
1.2.2 脑部增强MR图像获取
患者于放疗定位前1周内至我院放射科扫描脑部增强核磁(GE 1.5 T),层厚:2.5 mm,FOV 240 mm×240 mm,扫描包括T2-FLAIR和T1WI序列。根据医师要求选取合适序列的断层图像经由PACS系统经网络传至Eclipse治疗计划工作站。
1.3 图像融合和靶区勾画
使用Eclipse TPS工作站的图像融合功能,选取合适的感兴趣病灶区域进行融合。由于头部图像的信息量相对较少,且形变也小,一般系统自动融合后能达到较理想的融合效果,最后再根据医生的临床要求手动微调,CT-MR融合示例见图1。融合完成后,由3名有工作经验5年以上的肿瘤科医生对10例患者分别在CT和CT-MR融合图像上勾画大体肿瘤区(Gross Tumor Volume,GTV),范围为术后残留肿瘤或术腔,临床肿瘤区(Clinical Target Volume,CTV)范围为GTV外扩2.5~3 cm,分别记为CTVCT和CTVCT-MR,同时分别勾画危及器官OARs(包括左右晶状体、脑干、海马),标方法记同类比。
1.4 靶体积测量和剂量计算
利用Eclipse治疗计划系统分别读取CT组和CT-MR组临床靶区和危及器官的体积,观察勾画差异,并比较三位不同医师间靶区勾画的差异性。并以CT-MR融合图像勾画完成的靶区和危及器官作为物理师设计放疗计划的目标,全部模拟剂量CTV为50 Gy,2 Gy/次,共25次,采用5野调强计划满足处方要求。TPS中不改变射野强度分布的条件下重新计算得到CTVCT、CTVCT-MR、脑干CT、脑干CT-MR和海马CT、海马CT-MR的剂量学参数[2]。其中危及器官要求脑干 Dmax<54 Gy,海马 Dmax<24 Gy,晶体 Dmax<8 Gy。
图1 1例脑胶质瘤术后患者图像融合示例
1.5 统计学方法
采用SPSS 20.0软件对数据结果进行统计学分析处理,不同医师在CT组和CT-MR融合图像中勾画靶区的差异结果用变异系数CV%=(s/)×100%来评价。
2 结果
2.1 CT图像和CT-MR融合图像为基础的靶区和危及器官勾画结果
2.1.1 影像融合对靶区勾画体积的影响
3名医师对10例患者分别在CT图像和CT-MR融合图像上勾画靶区体积的情况详见图2。图中横坐标值代表CT组靶区体积,纵坐标值代表CT-MR组靶区体积,虚线表示CT图像中勾画靶区的体积和CT-MR融合图像中勾画靶区的体积相等。图例代表不同医师勾画的数据,若散点位于虚线下方,则说明影像融合后靶区体积小于相对应的CT靶区。由图2可见,CT-MR影像融合后靶区体积减少占比较高,为80%,说明CT-MR影像融合后勾画靶区的体积结果较CT图像勾画的靶区结果存在差异。这10名脑胶质瘤术后患者的CTVCT体积平均值为(264.99±66.78)cm3,CTVCT-MR体积平均值为(248.59±57.06)cm3,平均CTVCT体积值大于平均CTVCT-MR体积值(t=4.403,P=0.002),结果有统计学差异。

图2 三位医师分别在CT和CT-MR图像上勾画的靶区体积
2.1.2 影像融合对危及器官勾画体积的影响
由表1可见,左右晶状体及脑干在融合前后勾画的体积无明显变化,差异无统计学意义(P>0.05)。器官勾画海马在CT-MR融合后体积小于CT,差异有统计学意义(P=0.000)。
表1 CT组和MR-CT融合图像中OARs体积比较(±s,cm3)
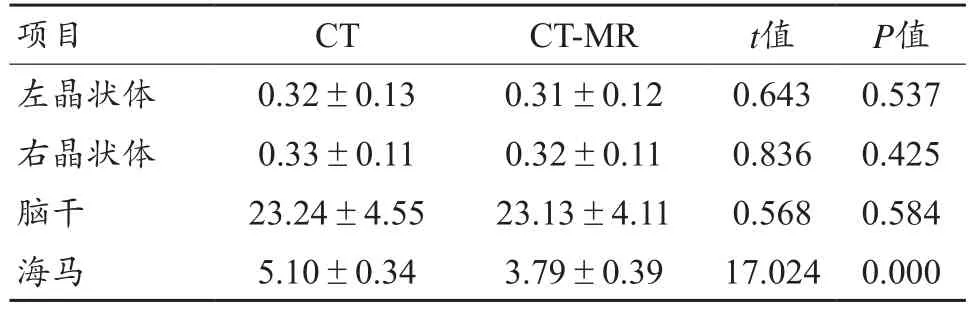
表1 CT组和MR-CT融合图像中OARs体积比较(±s,cm3)
项目 CT CT-MR t值 P值左晶状体 0.32±0.13 0.31±0.12 0.643 0.537右晶状体 0.33±0.11 0.32±0.11 0.836 0.425脑干 23.24±4.55 23.13±4.11 0.568 0.584海马 5.10±0.34 3.79±0.39 17.024 0.000
2.2 CT图像和CT-MR融合图像为基础的靶区勾画体积的组间差异
3名医师的靶区勾画存在组间差异,CT组3位医师勾画靶区体积的平均变异系数CV值为(5.20±2.56)%,CT-MR组3名医师勾画靶区体积的平均变异系数CV值为(1.7±1.09)%,前者大于后者,差异有统计学意义(t=3.987,P=0.003)。MR-CT融合影像为基础勾画靶区不同医师间的一致性好、组间差异小。
2.3 CT图像和CT-MR融合图像为基础的靶区勾画致剂量学差异
以CT-MR融合图像勾画完成的靶区和危及器官为目标设计治疗计划,其剂量学参数存在差异。CTV的VCT-MR100%和VCT100%分别为(95.34±1.28)%和(92.68±3.31)%,海马DmaxMR-CT和DmaxCT分别为(22.34±3.43)Gy和(24.56±3.71)Gy,脑干DmaxMR-CT和DmaxCT分别为(46.92±4.62)Gy和(51.24±5.31)Gy。我们发现以CT-MR融合结果为目标的计划设计可使实际靶区获得较好的剂量分布,且实际脑干和海马的最大单点剂量也可降低。
3 讨论
放射治疗逐步进入精确精准时代,肿瘤靶区的准确勾画是保证放射治疗效果的首要因素,多影像技术融合的发展弥补了CT影像中软组织显像有限,和MR影像中解剖结构不够准确的缺点。不同图像之间的空间配准,可以将图像的解剖与功能有效的结合起来,为医生勾画肿瘤靶区提供更多的影像信息。
本研究分析脑胶质瘤术后患者的靶区和危及器官的勾画,发现多数基于CT-MR融合图像上的靶区体积小于基于CT图像上勾画的体积,差异具有统计学意义。结果表明CT图像易高估肿瘤本身的病变范围,可能原因是因病灶边界在CT图像显示不清,且存在易干扰的水肿带,部分医师怕遗漏瘤体,故靶区勾画偏大[6-7]。若单纯以CT图像为指导勾画的靶区和危及器官来设计放疗计划,会扩大肿瘤部位的照射范围,使正常脑组织受量过多,真实靶区的剂量适形度大大下降,增加放射性脑损伤的概率[8]。且会高估危及器官的受量,不利于肿瘤临床剂量的提升。
另外,不同医师对肿瘤的认识以及对解剖知识的熟悉程度不同会导致靶区勾画的范围大小存在差异本研。研究结果发现在CT-MR融合图像的指导下所勾画的肿瘤靶区体积的变异系数小于在CT图像指导下,说明相较单纯的CT图像,融合后图像提供的信息量可减少不同医生勾画靶区的差异性。
尽管CT-MR图像融合对脑胶质瘤术后靶区的勾画有显著的优势,但图像融合效果的好坏会直接导致肿瘤靶区勾画的准确性。常用的Eclipse治疗计划系统的融合功能主要分为外部标记法和基于图像内部特征融合两种,外部标记法对CT和MR两种扫描体位和外部标记点放置的精确性有很高的要求,且标点法未考虑患者相对面膜的不自主运动,因此一般不适用于临床应用[9]。临床常用的融合功能为基于图像内部解剖结构的融合方法,其融合精度至关重要。总结影响图像融合精度的几个主要因素:① 患者在定位CT和MR扫描时,体位很难保证高度一致,且MR扫描时间长,患者若发生移动易产生伪影,因此应在扫描前选择一个舒适的体位;② 对患者进行CT和MR扫描时,尽量选择相同的层厚,调整MR扫描范围磁场的均匀性[10-12];③ 融合前手动调节CT和MR图像的窗宽窗位,提高组织细节的显示,使两组待融合图像的灰度值相近可进一步提高融合精度[13];④ 有文献指出Eclipse计划系统的融合算法中采用的最大互信息算法利用信息论中的互信息作为两幅配准图像之间的相似性测度[14],图像的边缘对融合结果存在一定的影响,融合时感兴趣范围尽量包含体表轮廓[15]。
综上,将靶区勾画和用于治疗计划设计最佳来源的CT图像和软组织显像清晰的MR图像相融合,最终得到的CTVCT-MR可满足脑胶质瘤术后调强放疗计划对精确靶区的要求,并利于肿瘤临床剂量的提升。

