血管介入手术机器人系统综述
赵含霖,谢晓亮,奉振球,刘市祺,周小虎,侯增广,3
1. 中国科学院自动化研究所 复杂系统管理与控制国家重点实验室,北京 100190;2. 中国科学院大学 人工智能学院,北京 100049;3. 中国科学院 脑科学与智能技术卓越创新中心,北京 100190
引言
目前中国心血管病患病率处于持续上升阶段,2016年心血管病死亡率高居第一,高于肿瘤和其他疾病。目前微创血管介入手术已经成为治疗疾病的流行方法。据国家卫健委冠心病介入治疗注册数据显示,2017年大陆地区冠心病介入治疗总例数为753142例,经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)病例增长率为13%[1]。在传统的血管介入手术中,医生通过血管造影技术观察导管等介入器材在体内所处位置,操纵导管、导丝等介入器材达到病变位置完成球囊扩张、支架安放等工作。介入医生暴露在辐射中导致皮肤癌、白血病、甲状腺癌、白内障发病率上升[2-4],医生为了减少辐射而穿戴的铅衣也会带来操作的不便和关节损伤[5]。
近年来血管介入手术机器人取得了较大的进展,并进行了临床上的应用。介入医生在操作舱里操作导管、导丝等器材介入,摆脱了铅衣带来的负担,减少了辐射吸收,实验证明机器人辅助的PCI手术能够减少97%的辐射[6]。介入医生通过机器人辅助能够对导管实现毫米级的控制,能够减少导管与血管壁之间的碰撞,减少了并发症的发生[7-9]。本文将对国内外在血管介入手术机器人的研究成果进行介绍,并对近年来血管介入手术机器人的关键技术进行分析。
1 国内外研究现状
2006年以色列Haifa医院开发了远程导航系统[10],Corindus公司以其为原型发展了CorPath 200血管介入机器人,CorPath 200系统在2012年成为第一个获得了美国食品和药物管理局(Food and Drug Administration,FDA)认证的用于冠状动脉介入的机器人系统[11]。至今为止,血管介入手术机器人已经成为手术机器人的研究热点,国内外科研机构都在积极研发自己的机器人辅助系统,本节将介绍国内外的研究进展。
1.1 国外研究进展
Amigo是美国公司Catheter Robotics设计的用于血管介入电生理治疗的远程导管系统。Amigo系统由一个安装在电生理台上的送管装置和一个有线控制器组成[12]。Amigo不需要单独的工作站,可以与现有的透视技术结合确定导管位置并通过控制器操作导管。Amigo是一个开放式平台,能够兼容现有的商用导管,降低了使用成本。导管被放置在扩展底座内,介入医生可以通过控制器在30 m外进行控制。控制器可以实现导管插入、回撤和旋转以及导管顶端偏转。通过控制器的前进、后退按钮可以控制滑轨的前进和后退,从而实现导管的插入与回撤,导管运动速度为每秒13 mm,最小控制精度为1.6 mm。介入医生旋转控制器的最前端旋钮实现转台的旋转,带动导管进行360°旋转。旋转控制器中间的旋钮可以实现导管的远端弯曲(图1)。

图1 Amigo系统
Sensei X机器人系统是美国Hansen公司设计的用于进行导管射频消融手术的机器人[13]。该系统由三部分组成:医生工作站,远程导管机械手(Remote Catheter Manipulator,RCM)和Artisan主动导管。工作站显示屏显示电生理数据和3D绘图系统,X光影像也叠加了Artisan主动导管图像。工作站配有一个三维的操作杆,医生通过操作杆将控制命令传递给RCM,RCM控制导管内牵引钢丝的拉伸,从而使Artisan实现不同弯曲状态。Artisan是一次性无菌引导导管,由内部导管和外部导管组成。外部导管通过两个分开180°的牵引钢丝控制,为内导管提供支撑。Artisan通过传感器对导管尖端的力进行测量,并在主屏幕上提供力的视觉反馈,提高了手术安全性(图2)。
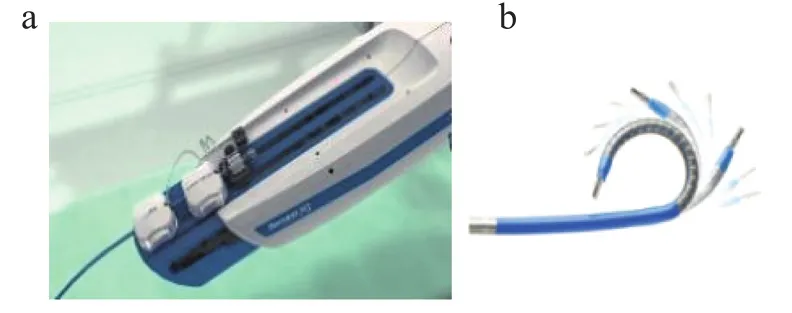
图2 部分Sensei X机器人系统
CorPath GRX是美国Corindus公司第二代产品,用于精确的血管介入,于2016年通过FDA认证。CorPath GRX主要由送管机械臂和铅屏蔽机器人控制工作站组成[14]。送管机械臂包括机械臂,机器人驱动装置,一次性无菌设备盒。机械臂支撑容纳无菌设备盒的机器人驱动器。送管机械臂通过电缆连接到控制工作站,该工作站距离患者有一定距离。介入医生在控制工作站执行PCI流程。控制工作站包含一个控制计算系统,监视器,网络设备和一个带有三个操纵杆的机器人控制台。监视器显示实时血液动力学变量和透视成像,为操作员提供了PCI程序的增强可视化效果。一个操纵杆用于气球/支架操纵,一个操纵杆用于导丝操纵,而第三个操纵杆用于引导导管操纵。导线操纵杆允许导线的线性和旋转运动。气球/支架操纵杆可精确控制其相应设备的线性运动。引导导管操纵杆可精确控制线性运动,并允许引导导管的旋转运动。这些设备是独立控制的(允许一次使用一个操纵杆单独进行操作),也可以一次激活多个操纵杆同时进行控制。为了更精确地定位和离散操作,可以通过用户界面上的触摸屏按钮以1 mm的增量推进气球/支架,导丝和引导导管(图3)。

图3 CorPath GRX
Magellan手术机器人系统是Hansen公司基于Sensei平台进行重大改进的可远程引导的导管系统,其关键部件是6自由度的引导导管和9.5-F鞘导管,前者可以实现多方向180°弯曲,后者提供多方向90°弯曲[15]。医生在远程工作站控通过控制正交拉线来实现导管成形与操作,实现导管顶端完整的旋转能力和独立的尖端扭矩控制(图4)。

图4 Magellan系统整体图
2017年意大利博洛尼亚大学Cercenelli等[16]针对现有系统费用高,手术准备时间长开发了一套紧凑轻巧,安装快捷的远程导航系统,能够兼容现有的商用导管,用于血管介入电生理治疗。医生可以通过模拟手柄来模仿手术时的动作,通过推动手柄实现导管的轴向运动,旋转手柄实现导管旋转,通过手柄上的按钮实现控制导管顶端。系统还提供了力反馈,使用传感器测量导管的近端力,当阻力超过阈值时引起手柄震动。
1.2 国内研究进展
国外研究大多以公司为研究单位,并且以商业化为研究目的投入了大量的资金和人力。而我国在血管介入机器人研究领域处于初级阶段,但随着近年来科研投入的增加,也取得了一定的成果。
2016年中国科学院自动化所设计了一种新型介入手术机器人系统,并提出了运动缩放的控制方法[17]。机器人的递送装置采用仿生设计,利用主动轮和从动轮来模仿医生拇指和食指对导管的操作,实现导管的轴向和旋转运动。该系统提出了运动缩放控制策略以适应不同介入阶段所需要的操作精度。在主动脉阶段放大主端操作,缩短手术时间,减少X射线的影响。在狭窄病变阶段缩小主端操作,提高控制精度,减少对血管的损伤。该介入机器人系统已经在上海市胸科医院进行了10余例活体动物实验(图5)。

图5 中科院自动化所血管介入手术机器人
2018年上海交通大学Wang等[18]开发了开放式的血管介入系统,实现与已有的导丝、导管、球囊等设备的结合。机械手夹持采用V形抓手设计,避免了摩擦轮结构对介入设施的磨损。采用4只机械手进行单轴输送,可独立完成夹持、递送和旋转运动,也可以多只机械手协作完成设备介入过程,提高操作安全性。系统可以进行拆卸,组装,缩短了设备准备时间。
2019年北京理工大学Guo等[19]设计的血管介入机器人由控制器、送管机构、主触觉界面组成,见图6。主触觉界面测量由医生操作的输入导管的轴向和径向运动,根据导管顶端的力传感器测量的压力向医生提供触觉反馈。该系统采用磁流变液来产生反馈力,当操作者在磁场作用下通过触觉界面插入导管时,磁流变液颗粒的链状结构会发生畸变,产生阻力。送管机构复制主触觉界面检测的导管运动,通过两个夹手交互操作实现对导管的递送。建立了导管介入模型,当导管顶端与血管壁的接触力超过阈值时认为发生“真碰撞”,否则为“假碰撞”,从而在主触觉界面产生不同的反馈力。实验证明,结合力反馈能够有效减少导管与血管壁的接触力,提高手术安全性。
此外,北京航空航天大学[20],哈尔滨工业大学[21]等高校也对开发了自己的血管介入机器人系统,在推送机构、图像导航系统,力反馈等关键技术做出了相应研究。

图6 北京理工大学血管介入机器人系统
2 关键技术
血管介入机器人已经取得了一定的成果,但仍存在一定的局限性。导管设备、图像导航系统、力反馈系统、技能评测是血管介入机器人的关键技术,需要进一步研究这些关键技术提高机器人的精准度和安全性。
2.1 导管设备
传统导管顶端是预弯的,有着不同的角度和形状。在手术过程中,医生根据不同的血管结构与手术步骤更换不同的导管,这会使手术过程变得复杂。通过设计主动驱动导管,医生能够控制改变导管顶端的形状,选择运动的方向,能够有效地缩短手术时间,提高安全性。按照主动导管的驱动模式可以分为导管顶端产生驱动力和力传递到导管顶端两种模式。第一种模式包括磁力驱动、记忆金属等类型,第二种模式包括绳索驱动和液压驱动等类型[22]。
Sikorski等[23]在导管顶端结合永磁体,通过移动电磁铁阵列提供外部产生的变化磁场使导管顶端按照目标方向进行偏转。Sheng等[24]设计的导管尖端由多个弯曲模块组成,每个模块有一组形状记忆合金丝驱动,通过电流加热使得记忆合金弯曲。Woo等[25]设计了一个可转向导管。导管有刚性部分和软性部分。两根导线穿过导管连接到软性远端,另一端穿过硬刚部分连接到转轴上,通过旋转转轴使导线牵引导管实现弯曲。
由于简单的工作原理和安全性,绳索驱动的导管是目前应用最为广泛的主动导管。磁驱动导管配合相应的导航系统也得到了较大的发展。记忆金属和液压驱动由于温度变化和液压流体存在泄露的可能限制在临床上的应用。未来主动导管技术在操作精度、安全性、小型化等方面需要进一步的提高。
2.2 图像导航系统
医生通过血管成像来判断手术器材的位置,执行血管介入动作。因此血管成像的精度对手术安全十分重要。常见的血管成像技术有数字减影血管造影(Digital Subtraction Angiography,DSA)、计算机断层扫描血管造影(Computed Tomography Angiography,CTA)、磁共振血管造影(Magnetic Resonance Angiography,MAR)和超声波影像。
目前DSA在血管介入手术中应用最广泛。造影剂通过心导管快速注入心腔或血管,使心脏和血管腔在 X 线照射下显影。但DSA只能呈现平面图像,丢失了深度信息。CTA能够重建血管3D图像,通过术前构建血管模型,并与手术过程的实时2D图像配准,精确跟踪手术器材在血管中的位置[26]。MAR软组织对比度高,没有辐射危害,可获取2D、3D图像。但由于心跳、呼吸运动的存在,影响成像的清晰度。超声影像对组织有着良好的显像,可以判断脏器的位置、大小、形态,确定病灶的范围和物理性质,通过超声影像实现对导管的定位[27-28]。
在手术过程中,医生需要从图像中定位导管、导丝、支架等手术器材。但由于器材与血管结构的相似性,干扰信号,造成医生判别困难。利用算法实现对导管导丝的分割定位,为医生减轻负担。Sam等[29]基于B样条曲线,提出了能量最小化的导丝跟踪算法,但是该算法需要强制曲线的光滑性。Demircital等[30]采用了基于模型的方法实现对支架的跟踪,该方法依赖于基于Hessian的滤波进行预处理,并将支架的金属框架的几何模型拟合到透视图像中。他们的方法需要支架的预定义模型,并被限制为特定的支柱形状。近年来随着深度学习技术发展,应用卷积神经网络可以更精准的实现器材的分割和跟踪。2017年Ambrosini等[31]提出了一种基于U-net网络模型的全自动分割方法,以当前帧结合前三帧图像作为网络输入,然后使用提取的分支的骨架化和链接来提取导管中心线,单帧检测时间为125 ms,有望实现实时检测。2018年 Breininger等[32]以U-net为基础,结合残差连接,批量归一化,实现了对支架在X射线图像的精确分割,提高手术的精度和安全性。
2.3 力反馈系统
一些研究探索了力反馈在血管介入过程的必要性[33]。触觉丧失会使操作者手眼协调困难[34],医生仅依靠成像难以评价施加在血管壁上力的大小,造成血管壁破裂。在微创手术机器人中结合力反馈技术的目标是实现手术过程的“透明化”,让手术医生感觉不到是在远程操作,而是直接接触病人[35]。
实现力反馈的面临两个挑战。首先是接触力的测量。导管与血管壁的接触力可以通过在导管顶端集成压力传感器进行测量。压力传感器通常分为压电式、压阻式和光纤传感器。压电与压阻式传感器有着较好的线性特性,但压电式只能测量静态力,压阻式可同时测量静态与动态力但容易受到电磁干扰[33]。光纤传感器有着良好的动态性能与抗干扰能力,体积较小,近年来越来越多的应用到手术机器人的力传感中[36-39]。由于在导管顶端结合力传感器导致直径变大,增加了插入的困难,还可以利用位于患者外部的传感器测量导管的近端力来估计导管与血管壁的接触力[16,19,25]。
另一个挑战是触觉交互设备如何将力反馈到外科医生。2009年Omega触觉设备已经被用来将导管插入力传递到外科医生的手中,通过控制电机的电流来产生力矩[40]。Jaehong Woo等人设计了一个三自由度平移运动机构与四自由度旋转运动相结合的主控机构,并通过电机来产生阻力和力矩[25]。电机驱动容易出现不稳定、间隙、力不足和抖动等情况。因此2018年Guo等人设计了基于磁流变(Magnetorheological,MR)液的主触觉界面[19,41-42],当导管穿过磁流体时,会破坏粒子的链式结构,从而产生阻力,通过调节磁场强度改变阻力大小。该交互界面能够快速改变阻力大小,并且保持医生原有的介入方式。
2.4 技能评测
临床实验证明,手术效果十分依赖介入医生的操作技巧和经验[43],因此在训练和临床实践中对介入医生的手术技能评价十分重要。传统的手术评价使用专业的分级标准和检查表(Global Rating Scales, GRS),但评分过程费时费力又包含评分者的主观因素,因此需要一种更加客观并且方便的评价方法。
一些研究利用操作者与工具的相互作用,工具与器官组织的相互作用的定量信息提出客观的手术技能评估框架。2015年Rafii-Tari等人记录不同的水平医生操作下的导管与血管的接触力和导管的运动数据,采用隐马尔可夫模型(Hidden Markov Model,HMM)分别建立接触力技能模型和导管运动技能模型对医生等级进行评估[44]。此外Rafii-Tari等人又在上述方法的基础上,通过导管近端力传感器和导管顶端的电磁位置传感器,将医生施加的工具力与导管尖端运动联系起来,提取与工具力、导管运动性能指标和血管接触力有关的性能指标。结果显示,不同经验分组的力与运动模式有着显著的差异,支持向量机(Support Vector Mechine,SVM)分类精准度达到90%[45]。但由于导管的尺寸限制了运动传感装置和力传感器的应用,并且多数评估方法时在模拟环境中进行,因此在真实场景的应用受到限制。2019年Zhou等[46]提出了分析介入医生操作时自然动作的方法。使用传感器分别记录操作者的手运动、近端力、肌肉活动和手指运动。并且对不同技能水平组的行为特征进行比较,选择有效的动作特征,用于基于高斯混合模型与基于马氏距离的定量评价,在区别新手与专家的准确率达到了92%,并且量化评价的分数与传统方法得分有很高的相关性。
3 展望
血管介入手术机器人研究正逐渐受到更多的关注并且已经成功应用在临床手术中。面对更为复杂的手术环境,为了提供更安全可靠的手术,血管介入手术机器人在未来面对如下挑战。
3.1 力反馈
导管尖端端位置和接触力的估计方法正在研究和开发,结合传感器对导管与血管壁接触力进行更精准的测量。采用新型压力传感器在操作端为提供精细触觉反馈,有助于医生构建真实触觉反馈。
3.2 实现更复杂的手术操作
目前的血管介入机器人只能操作导丝、球囊、支架,而引导导管的送入需要医生手动完成。当前的血管介入机器人不能完成一些复杂的分叉、慢性完全闭塞、严重钙化病变病例[47]。新一代的血管介入机器人需要解决当前设备的局限性,包括与线上设备的兼容性,以及只能单独操作单个设备,从而实现无需医生更换导管即可完成更加复杂的PCI病例。
3.3 人工智能技术的应用
深度学习在计算机视觉领域得到广泛的应用,能够实现精准的目标检测和分割,这对于确定患者X光片的病变位置十分有效[48]。利用深度学习实现血管、导管分割,术前创建的3D血管图像与实时2D血管图像进行配准,在三维模型中显示导管位置,为医生提供更直接的视觉反馈。强化学习,示教学习可以更好利用专家已有的知识,从专家演示中学习执行策略,实现自主化的手术机器人系统。
3.4 远程手术
2019年,印度通过CorPath GRX系统在相隔20英里距离下成功实施了5例PCI手术[49],这证明了远程手术的可能性。随着5G技术的发展,从端与控制端之间信息传递速度提升,提高了远程手术的可靠性。偏远地区往往缺少经验丰富的介入医生而不能执行介入手术,而机器人系统能够使医生使用远程干预为多个地区的病人执行手术,降低了偏远地区的医疗成本,缓解医疗资源分配不平衡的问题。

