FGF21对鱼藤酮导致神经细胞损伤的作用及其机制
陈映洁,高向东,陈 松
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京211198)
帕金森病(Parkinson’s disease,PD)是最常见的神经退行性疾病之一,临床主要表现为运动迟缓、静止性震颤、肌强直和姿势反射障碍等症状[1]。PD主要病理特征包括黑质致密部多巴胺能神经元死亡和减少[1-2]以及异常聚集α-突触核蛋白(αsynuclein,α-syn)形成的路易小体等[3]。随着人口老龄化和全球人均预期寿命的延长,PD 患病人数逐年上升。PD 具体发病机制目前尚无定论,其复杂性伴随着临床挑战,因此,PD的发病机制和治疗方案受到研究者们的广泛关注。
研究表明,神经退行性疾病与糖尿病之间存在关联[4-5],从糖脂代谢调节分子中寻求神经退行性疾病的防治药物可能是有效研究策略。成纤维细 胞 生 长 因 子21(fibroblast growth factor 21,FGF21)是成纤维细胞生长因子家族的一员,其作为代谢调控的研究热点之一,在糖尿病相关疾病治疗中具有一定的潜力。有文献报道,情绪稳定剂锂和丙戊酸可能通过FGF21 发挥协同神经保护作用,FGF21可能成为治疗中枢神经系统疾病的先导分子[6]。已有研究表明FGF21 可以保护动物大脑 抵 抗D- 半 乳 糖[7]和Aβ25-35[8]的 影 响,提 示FGF21[8-9]可能在神经退行性疾病中发挥一定的潜在作用。然而,FGF21 在PD 中具体作用及机制尚有待进一步深入研究。
本研究采用鱼藤酮建立PD 样损伤神经细胞模型,考察在该模型下FGF21 对神经细胞的细胞活性和细胞凋亡、酪氨酸羟化酶(tyrosine hydroxylase,TH)和α-syn 变化、以及胞内活性氧(reactive oxygen species,ROS)水平的影响,在细胞水平上探讨FGF21 对鱼藤酮导致PD 样神经细胞损伤的保护作用及机制。
1 材 料
1.1 试 剂
FGF21(纯度:95.66%,实验室制备);鱼藤酮(纯度:98.12%,美国MCE 公司);ROS 检测试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒、BCA 蛋白浓度检测试剂盒(中国碧云天生物技术研究所);胰蛋白酶、MTT(中国Biosharp 公司);DMEM高糖培养基、胎牛血清(美国Gibco 公司);蛋白酶抑制剂、Marker(美国Thermo 公司);PVDF 膜(美国Millipore 公司);β-actin 抗体(中国Abclonal 公司);TH 抗体,α-syn 抗体,羊抗兔IgG,羊抗鼠IgG(美国Cell Signaling Technology 公司);其他试剂均为国产分析纯。
1.2 仪 器
高速冷冻离心机、全波长酶标仪(美国Thermo公司);电泳仪、转膜仪(美国Bio-Rad 公司);多功能凝胶成像系统(中国Tanon 公司);流式细胞仪(美国BD公司)。
1.3 细 胞
SH-SY5Y 细胞株购自美国菌种保藏中心(ATCC)。
2 方 法
2.1 细胞培养
SH-SY5Y 细胞培养在含有10% 胎牛血清的DMEM 高糖培养基中,放置于37 ℃含有5% CO2的细胞培养箱中3~4 d,待生长到约80% 时进行传代。
2.2 鱼藤酮致SH-SY5Y细胞损伤模型建立[10]
收集密度为每毫升5×104个的SH-SY5Y 细胞悬液,以每孔100 μL 铺在96 孔细胞板内,铺板时注意充分混匀。10 h 后以梯度浓度0.8,0.4,0.2,0.1,0.05 ,0.025 μmol/L 的鱼藤酮孵育SH-SY5Y细胞24 h,MTT 法检测细胞活性:每孔加入MTT 10 μL,37 ℃放置4 h,吸去培养基,各孔加入DMSO 150 μL 并放于摇床震摇10 min 使结晶物充分溶解,设置酶标仪参数为570 nm 为检测波长,630 nm为参比波长,检测各孔内吸收度。
2.3 FGF21 对鱼藤酮致SH-SY5Y 细胞损伤的干预作用
状态良好的SH-SY5Y 细胞铺于96 孔板,在细胞培养箱中培养10 h 后,选取0.1 μmol/L 鱼藤酮作为造模浓度,同时选用浓度为5,1,0.2,0.04,0.008 μmol/L的FGF21干预细胞24 h后,MTT法检测各组细胞活性。
2.4 FGF21及鱼藤酮对SH-SY5Y细胞凋亡的影响
收集状态良好的SH-SY5Y 细胞,以每毫升5×104个细胞的密度,每孔1 mL 铺于6 孔板,选取0.1 μmol/L 鱼藤酮作为造模浓度,5 μmol/L FGF21作为给药浓度,实验分为空白组、模型组和给药组,共孵育24 h 后,采用Annexin V-FITC/PI 双染法结合流式检测SH-SY5Y 细胞凋亡情况。实验步骤:收集每组细胞培养液于EP管内,用预冷的PBS洗涤细胞3次,用胰酶消化并于显微镜下观察细胞形态,当大部分细胞间隙变大立即用收集的细胞培养液轻轻吹打对应的各组细胞收集到EP 管中,1 000 r/min 离心5 min,弃除上清液,PBS 重悬细胞计数。每个EP 管中加入Annexin V-FITC 结合液195 μL 与细胞充分混匀,并加入Annexin V-FITC染色液5 μL 和PI 染色液10 μL,上下颠倒轻轻混匀。室温避光孵育20 min,上机前重悬细胞,检测各组荧光值,各组细胞避光放于冰上并于1 h 内完成检测。
2.5 FGF21 及鱼藤酮对SH-SY5Y 细胞TH 和αsyn表达量的影响
细胞铺板及给药干预实验步骤见“2.4”项。共孵育24 h 后,提取细胞总蛋白,Western blot 检测各实验组TH 和α-syn 蛋白水平变化。实验步骤:使用预冷的PBS 洗涤细胞2 次,加入RIPA 裂解液(按1∶200 加入蛋白酶抑制剂),细胞板置于冰上,细胞刮刀轻轻刮取细胞收集于EP 管中,涡旋仪每隔3 min 充分振荡裂解30 min,然后在4 ℃条件下以12 000 r/min离心15 min取上清液即为细胞总蛋白,蛋白制样后进行SDS-PAGE 电泳,湿转恒流转膜40 min,转膜后的PVDF 膜以5% 脱脂奶粉封闭2 h,TBST 洗涤3 次,每次10 min,孵育一抗放置于摇床上4 ℃过夜,TBST 洗涤后放置于摇床上常温孵育二抗2 h,洗涤、化学发光显色成像,检测目的蛋白变化。
2.6 FGF21 及鱼藤酮对SH-SY5Y 细胞内ROS 生成水平的影响
细胞铺板及给药干预实验步骤见“2.4”项。共孵育24 h 后,采用DCFH-DA 探针结合流式检测SH-SY5Y 细胞内ROS 水平。实验步骤:以无血清DMEM 高糖培养基稀释DCFH-DA 溶液使其终浓度为10 μmol/L 并避光保存;轻轻吸去6 孔板内培养基,用胰酶消化并于显微镜下观察细胞形态,当大部分细胞间隙变大立即用DMEM 高糖培养基将细胞轻轻吹打并收集在EP 管内,1 500 r/min 离心5 min,弃培养基,每管加入已稀释的DCFH-DA 溶液1 mL,重悬细胞,37 ℃避光孵育20 min,1 500 r/min离心5 min收集细胞,用无血清DMEM 高糖培养基洗涤3 次,流式细胞仪检测各组细胞荧光强度。
2.7 统计分析
实验结果采用GraphPad 分析软件进行统计分析,以xˉ± s表示,One-way ANOVA 检验进行组间比较,P <0.05时表明差异有统计学意义。
3 结 果
3.1 鱼藤酮致SH-SY5Y细胞损伤模型建立
以不同浓度鱼藤酮损伤SH-SY5Y 细胞后,MTT法检测细胞活性。结果如图1所示,鱼藤酮对SH-SY5Y 细胞活性损伤呈现一定的浓度依赖性。当0.1 μmol/L 鱼藤酮作用于SH-SY5Y 细胞24 h时,与对照组比,细胞损伤率约为30%,选取该浓度为鱼藤酮的造模浓度。
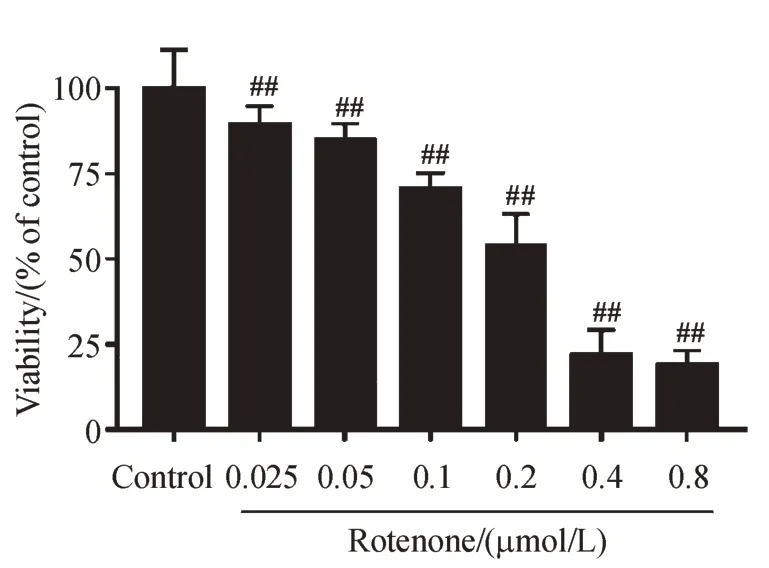
Figure 1 Effects of different concentrations of rotenone on SH-SY5Y cell viability (xˉ± s, n = 6)## P<0.01 vs control group
3.2 FGF21 对鱼藤酮致SH-SY5Y 细胞损伤的干预作用
根据“3.1”项实验结果,选用0.1 μmol/L 鱼藤酮损伤SH-SY5Y 细胞,分别与梯度浓度FGF21 孵育24 h 后,MTT 检测细胞活性。结果如图2 所示,鱼藤酮模型组与对照组相比细胞活性下降;给药FGF21 后,与模型组相比,给药组细胞活性增加,且呈现一定的剂量依赖性。
3.3 FGF21及鱼藤酮对SH-SY5Y细胞凋亡的影响
采用鱼藤酮对神经细胞损伤并进行FGF21 干预,Annexin V-FITC/PI 双染法检测神经细胞凋亡情况。流式检测结果如图3 所示,与对照组比较,模型组细胞凋亡比例显著升高,FGF21 给药组其细胞凋亡比例显著少于模型组,说明FGF21 对鱼藤酮导致的神经细胞异常凋亡具有一定干预作用,并对神经细胞发挥保护作用。
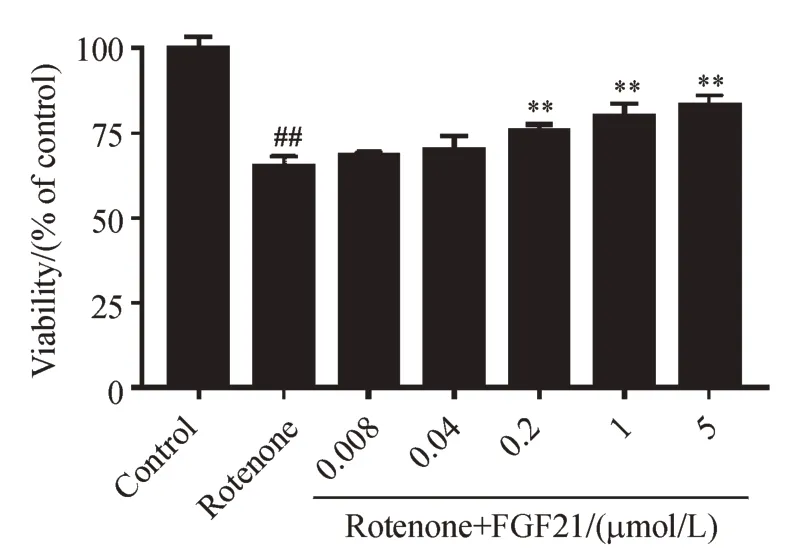
Figure 2 Protective effects of FGF21 against rotenone-induced toxicity on SH-SY5Y cells (xˉ± s, n = 6)##P<0.01 vs control group;** P<0.01 vs rotenone group
3.4 FGF21 及鱼藤酮对SH-SY5Y 细胞TH 和αsyn表达量的影响
用0.1 μmol/L 鱼藤酮对SH-SY5Y 细胞损伤造模,采用5 μmol/L FGF21 进行干预,Western blot 检测各实验组细胞TH和α-syn的表达量。结果如图4所示,与对照组相比,鱼藤酮损伤后细胞TH水平下降,α-syn水平升高;而FGF21能一定程度上缓解模型组中TH 和α-syn 的表达量的异常。说明FGF21能缓解鱼藤酮导致的神经细胞PD样病理改变。
3.5 FGF21 及鱼藤酮对SH-SY5Y 细胞内ROS 生成水平的影响
采用鱼藤酮对神经细胞损伤并进行FGF21 干预,DCFH-DA 探针法检测细胞内ROS 水平。结果如图5 所示,与对照组相比,鱼藤酮损伤后细胞内ROS 显著增加,而FGF21 给药组与模型组相比ROS 显著降低,说明FGF21 可缓解鱼藤酮引起的神经细胞内ROS 水平异常,对细胞发挥了一定的抵抗氧化损伤的作用。

Figure 3 Effects of FGF21 and rotenone on the apoptotic levels of SH-SY5Y cells (xˉ± s, n = 3)A:Analysis of apoptotic levels in SH-SY5Y cells by flow cytometry;B:Quantification of apoptotic levels## P<0.01 vs control group;**P<0.01 vs rotenone group
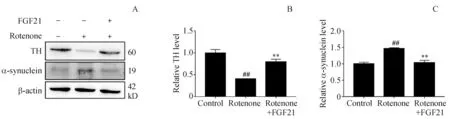
Figure 4 Effects of FGF21 and rotenone on the protein levels of TH and α-syn in SH-SY5Y cells (xˉ± s, n = 3)A:Detection of protein levels of TH and α-syn by Western blot;B:Quantitative analysis of protein levels of TH;C:Quantitative analysis of protein levels of α-syn## P<0.01 vs control group;** P<0.01 vs rotenone group
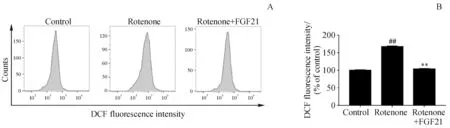
Figure 5 Effects of FGF21 and rotenone on the ROS levels in SH-SY5Y cells (xˉ± s, n = 3)A:Analysis of ROS levels in SH-SY5Y cells by flow cytometry;B:Quantification of ROS levels##P<0.01 vs control group;**P<0.01 vs rotenone group
4 讨 论
PD 是世界第二大神经退行性疾病,仅次于阿尔茨海默病,其发病机制复杂,目前尚无定论,缺乏有效的治愈手段,使得大量研究寻求新的治疗思路与治疗靶标。研究表明FGF21 能以简单扩散的方式通过血脑屏障[11],并且FGF21 相关的受体系统在中枢神经系统中有表达[12],这为FGF21 在神经系统疾病中发挥作用提供了前提。近年来,FGF21 在中枢神经系统中发挥的生物学作用引起了研究者极大的关注[13-14]。体外研究发现FGF21能够增加线粒体呼吸链活性从而发挥对多巴胺能神经元的保护作用[15]。然而,FGF21 在PD 中具体作用及分子机制尚有待进一步研究。本研究采用鱼藤酮建立神经细胞PD 样损伤模型,探索FGF21对神经细胞活性的影响,结果表明FGF21 能够降低鱼藤酮所导致的神经细胞损伤,减少神经细胞凋亡。说明FGF21 对PD 样细胞模型发挥了一定的保护作用。
PD发病机制复杂,其中氧化应激在PD发生机制中备受关注。越来越多的研究表明氧化应激异常和线粒体功能障碍会引起中枢神经系统紊乱以及多巴胺能神经元退化和死亡[16-19]。PD 相关基因如SNCA/α-syn,Parkin,LRRK2 等的突变与帕金森病风险增加有关,且这些基因的突变在一定条件下会对线粒体产生重要影响,而线粒体功能的受损则会导致氧化应激异常[20]。导致PD 发生的几种神经毒素如1-甲基-4-苯基-1,2,3,6 四氢吡啶,6-羟基多巴胺,百草枯和鱼藤酮等对线粒体复合体Ⅰ发挥抑制作用,抑制ATP 产生,阻断细胞内ATP参与的过程,产生大量自由基,从而导致氧化应激异常[21]。鱼藤酮可能导致氧化应激异常以及SHSY5Y 神经细胞TH 和α-syn 相关PD 样病变[22-23]。大量研究表明,氧化应激调控策略在缓解神经退行性疾病及保护神经细胞中可能具备一定的潜力[8,24-26]。本研究发现FGF21可改善鱼藤酮导致的神经细胞内ROS 水平异常,对PD 相关的神经细胞损伤能发挥一定的保护作用,同时FGF21 可缓解鱼藤酮引起的TH 和α-syn 异常;说明在PD 相关的神经细胞损伤中,FGF21 可能通过调节ROS 相关途径从而改善神经细胞PD 样病变,揭示了FGF21通过调控氧化应激进而发挥神经细胞保护作用。本研究为FGF21 防治PD 的作用及机制研究提供了实验基础,为PD 药物研发新思路提供了实验依据。FGF21 作为潜在药物分子,其成药性还有待进一步研究;FGF21 在PD 等神经退行性疾病中发挥作用的具体分子机制也还需深入探究。

