艾司西酞普兰体外对大鼠海马神经干细胞存活和增殖的影响
王大力,曹金明,张君,孙耐,王文婷,顾平
1华北理工大学附属医院,河北唐山063000;2河北医科大学第一医院
抑郁症是一种常见的精神疾病,全球有超过3亿人罹患抑郁症,是世界范围内的首要致残原因。药物治疗是重型抑郁的主要治疗措施,但临床治愈率仅有30%~40%[1]。目前研究表明,抑郁症患者常伴随神经退行性变和神经发生减少[2]。神经干细胞(NSCs)能进行自我更新,并具有向神经元、星形胶质细胞和少突胶质细胞分化的潜能。当中枢神经系统受到各种生理、病理刺激时,NSCs将被激活,这对脑损伤和治疗神经退行性疾病具有重要意义[3]。研究表明,压力、糖皮质激素及抑郁症时会影响脑内NSCs的增殖、分化,并对其造成损伤,进一步影响抑郁症的治疗及预后[4]。艾司西酞普兰(ESC)是一种新型高选择性的5-羟色胺(5-HT)再摄取抑制剂(SSRIs),通过抑制中枢神经系统5-HT的再摄取产生抗抑郁作用,但对去甲肾上腺素、多巴胺及细胞色素P450酶抑制作用小,所以安全性较其他SSRIs好,药物相互作用少[5]。目前发现氟西汀、氟伏沙明及西酞普兰等对NSCs具有促进存活及增殖的作用,但ESC对NSCs存活和增殖是否有影响少见报道。本研究观察了ESC对新生大鼠海马NSCs存活和增殖的影响,为临床治疗抑郁症提供新的思路。
1 材料与方法
1.1 实验动物、仪器及试剂 出生24 h内新生SD大鼠4只,购自河北医科大学动物中心,合格证号SCXK(冀2018-004)。7500荧光定量PCR仪(美国ABI公司);二氧化碳培养箱(美国Napco公司);倒置显微镜(日本Olympus公司);正置荧光显微镜(日本Nikon公司);ESC原研药(丹麦灵北制药有限公司);DMEM/F12(1∶1)培养液(美国Gibco公司);碱性成纤维细胞生长因子(美国PeproTech公司);B27 Supplement(美国Gibco公司);鸡抗巢蛋白(Nestin)抗体(美国Abcam公司);RNA提取试剂盒(美国Promega公司);逆转录试剂盒(美国Promega公司);MTS试剂盒(美国Promega公司);山羊封闭血清(北京中杉金桥公司);多聚赖氨酸(北京索莱宝公司)。
1.2 NSCs的体外分离、培养及鉴定 在无菌条件下,取上述4只SD大鼠两侧海马,置于预冷的DMEM/F12培养液中;解剖显微下剥离血管和脑膜,将分离出的海马组织放入另一个预冷的DMEM/F12培养液中,缓慢轻柔吹打15~20次后成单细胞悬液;置于离心机中,1 000 r/min离心5min,弃上清,加入无血清的NSCs培养基(DMEM/F12+2%B27+20 ng/mL bFGF)重悬;细胞计数,以5×104/mL接种于25 cm2的培养瓶中,再置于37 ℃、5% CO2的培养箱中培养,原代分离出的NSCs呈单细胞悬浮于培养基中。培养3 d需半量补液,发现3~5个细胞聚集呈球形或不规则形状。培养7~10 d,神经球由15~20个细胞聚集。培养5~7 d后第1次传代,收集神经球后胰酶消化成单细胞,计数后传代,传代比例约1∶2。选取第3代的NSCs用于实验,其神经球呈规则圆形,体积明显增大,折光性强,内部结构清晰。用干细胞标志物巢蛋白Nestin对第3代细胞进行染色,结果显示神经球内大多数细胞呈Nestin染色阳性。
1.3 细胞分组及处理 实验分为对照组和艾司西酞普兰干预组(ESC组)。对照组:NSCs仍在无血清的NSCs培养基继续培养;ESC组:NSCs中加入不同浓度ESC干预,培养液分别为DMEM/F12+2%B27+不同浓度(5、10、20、40 μmol/L)ESC。
1.4 大鼠海马NSCs存活率测算及ESC最佳浓度筛选 采用MTS法。将消化后NSCs细胞悬液接种至96孔培养板,接种细胞个数为104个/孔,每孔100 μL培养液。分为对照组和5、10、20、40 μmol/L ESC组进行接种,每组5个复孔。培养5 d后,在每孔中加20 μL CellTiter 96®AQueous One SolutionReagent,避光,5% CO2、37 ℃温箱中培养2 h后应用酶标仪在490 nm波长处检测每孔的光密度值(OD值),根据OD值计算出存活率。MTS检测重复3次,取每组平均值进行统计学分析。对照组及5、10、20、40 μmol/L ESC组细胞存活率分别为(100.00+0.00)%、(107.56±0.38)%、(108.36±0.23)%、(166.69±0.30)%、(166.48±0.42)%,20、40 μmol/L ESC组细胞存活率较对照组增加(P均<0.05),但20、40 μmol/L ESC组组间比较差异无统计学意义,提示20 μmol/L ESC最有益于NSCs的存活。
1.5 大鼠海马NSCs细胞存活情况观察 将对照组和20 μmol/L ESC组的NSCs消化成单细胞悬液,调整为105/mL接种至12孔板中,加入0.4%的台盼蓝混匀后进行染色。在染色3 min内计数活细胞及死细胞数目,镜下观察见活细胞不染色,死细胞染成淡蓝色,随机观察3个视野,计算活细胞率。用活细胞率来表示细胞活力,连续计数5 d,观察细胞存活情况。
1.6 大鼠海马NSCs细胞活力检测 通过记录每天对照组和20 μmol/L ESC组细胞数目来评价细胞活力。将两组生长良好接近汇合的细胞,消化吹打成单细胞悬液并调至为1×105/mL接种于12孔板,每组共接种15孔,每24 h计数1次细胞,每组每次分别计数3个孔,计算平均值,连续计数5 d,绘制两组NSCs的生长曲线。
1.7 大鼠海马NSCs Nestin阳性细胞球检测 将对照组、20 μmol/L ESC组的NSCs培养5 d后,以1×105个/孔分别接种到提前包被多聚赖氨酸的24孔板里培养,6~8 h NSCs贴壁,进行免疫荧光染色,实验重复3次。将各组细胞,用0.01 mol/L PBS缓冲液洗5 min,洗3次;再加入4%多聚甲醛室温固定15 min;0.01 mol/L PBS缓冲液洗3次,5 min/次;然后山羊血清37 ℃孵育40 min;加入Nestin一抗(1∶100),4 ℃过夜;0.01 mol/L PBS缓冲液洗3次,5 min/次,加入荧光二抗山羊抗鸡FITC(1∶100),37 ℃避光孵育30 min;0.01 mol/L PBS缓冲液洗3次,5 min/次;Hoechst染核3~5 min;再用0.01 mol/L PBS缓冲液洗3次,5 min/次,封片。荧光显微镜观察。每个孔随机观察5个非重叠视野。用平均每个视野的Nestin阳性细胞球比较两组增殖情况。
1.8 大鼠海马NSCs Nestin mRNA表达检测 采用RT-PCR技术。各取对照组、20 μmol/L ESC组5×106个细胞,提取总RNA,严格按试剂盒说明操作;反转录成cDNA,反应体系为20 μL,包含4 μL 5×miScritHiSpec溶液、2 μL 10×miScritNucleics混合液、2 μL miScript反转录混合液、2 μL无RNA酶水和10 μL模板RNA。以β-actin为内参,利用ABI 7500 PCR仪进行RT-PCR扩增反应。每组3个复孔,实验重复3次。反应条件:95 ℃变性15 min,94 ℃变性15 s、58 ℃退火30 s、70 ℃延伸30 s,重复32次循环。β-actin上游引物序列:5′-CCGCGAGTACAACCTTCTTG-3′,下游引物序列:5′-TGACCCATACCCACCATCAC-3′;Nestin上游引物序列:5′-GGGGGTAGGAGATGCCTTTG-3′,下游引物序列:5′-CCTTTAGAGCACCCACCTCC-3′。实验结果采用2-ΔΔCt法进行相对定量分析。
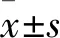
2 结果
2.1 ESC对大鼠海马NSCs存活情况的影响 台盼蓝染色计数对照组及20 μmol/L ESC组的活/死细胞数目,可见两组细胞存活率均在99%以上,对照组1~5 d的存活率分别为(99.23±0.44)%、(99.17±0.45)%、(99.24±0.07)%、(99.11±0.57)%、(99.24±0.19)%,ESC组分别为(99.30±0.05)%、(99.31±0.21)%、(99.26±0.16)%、(99.13±0.08)%、(99.18±0.27)%,两组比较差异无统计学意义。
2.2 ESC对大鼠海马NSCs增殖的影响 对照组1~5 d细胞个数分别为(1.00±0.00)×105、(1.15±0.02)×105、(1.25±0.03)×105、(1.52±0.02)×105、(2.06±0.02)×105个,20 μmol/L ESC组分别为(1.00±0.00)×105、(1.24±0.09)×105、(1.76±0.01)×105、(2.49±0.02)×105、(3.52±0.06)×105个。两组NSCs的生长均呈持续增长趋势,在传代的1~2 d,细胞增殖速度平缓,培养3~5 d时,细胞增殖速度明显加快,且ESC组的细胞数目及斜率高于对照组,说明ESC能促进NSCs的增殖(P<0.05)。
对照组、20 μmol/L ESC组Nestin阳性神经球个数分别为(18.33±1.25)、(35.00±0.82)个,两组比较P<0.05。
2.3 ESC对大鼠海马NSCs Nestin mRNA表达的影响 对照组、20 μmol/L ESC组Nestin mRNA相对表达量分别为1.00±0.03、6.23±0.16,两组比较P<0.05。
3 讨论
抑郁症又称抑郁障碍,以显著而持久的心境低落为主要临床特征,是世界首位的致残疾病,其危害程度远超心脑血管疾病、糖尿病、癌症等疾病。国际抑郁症流行病学大数据调研显示,其终生患病率为8%~12%,而且呈逐年上升趋势。近年来研究发现,抑郁症患者存在脑容量减少、脑室扩大、神经元凋亡及部分脑皮质及边缘系统的神经胶质细胞减少等现象,提示抑郁症存在神经退行性改变[6]。目前认为,发育中及成年哺乳动物中室管膜、海马齿状回颗粒细胞层下区、嗅球及皮质等区域存在具有自我更新和分化潜能的NSCs,且在一定因素的影响下,NSCs可以大量增殖并持续数周[7]。然而,无论是啮齿类动物还是人类,在压力、糖皮质激素及应激的刺激下,脑内NSCs增殖能力下降,严重时将对其造成损伤[4],主要表现为海马等部位萎缩和神经元数量减少,并伴有树突、突触的重塑及胶质细胞的改变等[6]。近年来,科学家们发现抗抑郁药则很有可能通过诱导海马新生神经元的产生,促进成年大脑边缘皮层正常功能的恢复而发挥临床疗效。那么,抑郁药是否直接调控NSCs的增殖及其作用机制均为研究重点[8]。本研究利用体外培养环境单一、条件易控的优势,以新生SD大鼠海马来源的NSCs作为细胞模型;稳定传至第3代,免疫荧光染色显示NSCs神经球Nestin表达强阳性,证明成功完成NSCs的体外原代分离、培养与鉴定,能为后续试验的顺利开展奠定基础。
研究报道,有些SSRI类抗抑郁药物可以逆转抑郁症导致的海马神经增生受损,具有促进NSCs增殖及神经发生的作用。例如,100 pmol/L~1 μmol/L的氟西汀能促进海马NSCs增殖并存在剂量依赖效应[9,10];1 nmol/L氟伏沙明能显著提高体外培养NSCs的存活率[11];帕罗西汀通过ERK1/2信号通路介导不仅提高NSCs增殖能力,还促进NSCs向胶质细胞以外的神经元分化[12];舍曲林虽对NSCs增殖无影响,但能保护NSCs免受脂多糖诱导的细胞损伤,具有促进神经发生和保护NSCs的作用[13];西酞普兰能逆转抑郁症模型中海马神经发生的改变,这种改变与行为改善的时间过程相似,其与褪黑素联合应用降低了海马齿状回血浆皮质酮水平,增加了细胞增殖、存活率和相关新神经元的绝对数量[14]。此外,西酞普兰可通过增加NSCs增殖和存活率从而促进成人骨髓间充质干细胞的神经元分化,增强骨髓间充质干细胞的神经元特性[15]。1.0 μmol/L和0.5 μmol/L西酞普兰干预7 d,能显著促进胚胎大鼠海马神经前体细胞增殖与分化。ESC是一新型的SSRIs,与其他SSRIs不同的是,ESC减少了西酞普兰右旋异构体对左旋异构体与突触前膜结合位点的干扰,进一步增加了5-HT的释放,继而通过5-HT的受体促进海马内神经发生的恢复,从而达到高效抗抑郁焦虑的作用。5-HT被认为是调节成年海马神经发生的物质,外源性5-HT还可挽救成人体内NSCs增殖[16]。研究表明,在重度抑郁老鼠模型中,给予ESC治疗后大鼠海马5-HT表达增加,抑郁样行为显著减少[17]。随着年龄的增长,5-HT能神经传递的减少会增加老年人群患抑郁症等神经精神疾病的风险,然而经ESC治疗的大脑较正常衰老的大脑转录发生、颗粒细胞增殖、血管收缩相关基因及激素反应相关基因增加,促进了神经功能恢复,对神经细胞存活、增殖具有重要作用[18]。脑卒中后抑郁大鼠的海马NSCs增殖减少,给予ESC治疗3周后发现此大鼠海马齿状回NSCs增殖显著提高[19]。ESC对慢性低灌注大鼠的缺血区细胞增殖具有促进作用,增加了突触结合蛋白及突触小泡蛋白含量,并对三维血管分布、细胞形态及血浆血管内皮生长因子具有正性调控作用,可改善神经发生的微环境,对神经系统的完善起重要作用[20]。本研究实验结果显示,20 μmol/L的ESC对NSCs具有较好的促存活作用;生长曲线显示ESC组细胞数目显著高于对照组,增殖速率也明显高于对照组,提示20 μmol/L的ESC有促进NSCs增殖的作用;进一步免疫荧光染色和RT-PCR结果显示,20 μmol/L的ESC促进NSCs表达Nestin,表明一定浓度的ESC具有促进体外培养NSCs存活和增殖的作用。
综上所述,20 μmol/L的ESC可正性调控新生大鼠海马NSCs的存活和增殖。在后续的研究工作中,将深入探讨ESC促进NSCs增殖和存活的分子机制及其能否促进NSCs向神经元方向分化等问题。

