259例类风湿性关节炎患者用药分析
王进军 黄 梦 易 敏 熊春雷 崔鹏来 文 斌
(1. 武汉市中医医院 风湿科, 湖北 武汉 430010; 2. 湖北中医药大学 针灸骨伤学院, 湖北 武汉 430060)
类风湿性关节炎(rheumatoid arthritis,RA)为自身免疫性疾病,我国的发病率为0.32%~0.36%,总患病人数约达500万[1]。目前临床针对RA,尚无根治方法,主要依靠药物控制病情,减轻关节软骨破坏,延缓疾病的发展,提高患者生活质量。非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)、慢作用抗风湿药(disease modifying antirheumatic drug,DMARDs)、糖皮质激素、植物类药等均是临床治疗RA的常用药物。本研究旨在了解门诊及住院RA患者基本信息及临床用药情况,分析处方用药的合理性及存在问题,为RA临床合理用药提供参考。
1 资料与方法
1.1 病例选取
选取2018年9月~2019年4月于我院就诊第一诊断为RA的患者,排除重复就诊病例。
1.2 调查方法
根据医院信息系统记录患者一般资料及药品信息。归纳整理患者性别、年龄、病程、用药情况(服药种类、服药剂量等)及药品信息(药品名、剂型、规格、价格、厂家等)数据。参考《类风湿关节炎诊断及治疗指南》[1-2](以下简称:指南)推荐剂量及药品使用说明书规定的RA患者成人日剂量(不考虑某些药物肝肾损害时需要酌情减量情况),与259名RA患者的日剂量相比较,分析用药情况。
1.3 统计学方法
数据采用SPSS 19.0软件进行分析。计数资料采用频数及百分比(%)描述,计量资料采用均数±标准差描述。
2 结果
2.1 RA患者的性别及年龄分布
259例患者性别分布,其中男性42例,占比16.22%,女性217例,占比83.78%,男女数之比约为1∶5.2。患病确诊年龄分布,以患者确诊RA的时间计算,患病确诊年龄=当前年龄-病程。平均患病年龄为(49.87±11.93)岁,最小患病年龄12岁,最大83岁,主要集中在41~55岁确诊RA,40岁以上确诊的患者占82.24%,各年龄段患者分布仍以女性为主,详见表1。
2.2 RA患者的病程情况
259例RA患者的病程最短为1月,最长可达40年,平均为(10.84±8.28)年,患病时间较长,详见表2。

表1 RA患者的确诊年龄及性别分布情况[n(%)]

表2 RA患者病程情况[n(%)]
2.3 RA患者用药情况
统计治疗RA患者口服用药使用频次(>3次),使用比例、频次排名以及日常服药规律,详见表3。结果表明,慢作用抗风湿药中使用率最高的为来氟米特,占60.23%,其次为甲氨蝶呤,占42.08%;植物制剂中使用率最高的为白芍总苷胶囊,占50.19%;糖皮质激素除醋酸泼尼松龙有超剂量使用外,其余均在指南及药品说明推荐用药剂量范围之内。追寻原始数据,仅2张处方中醋酸泼尼松龙用药超10 mg/d。统计RA患者用药排列规律(见表4),其中最常见的治疗方案为DMARDs(单用)+植物制剂,有98例;其次为DMARDs(单用)+NSAIDs+植物制剂34例。有15例患者的治疗方案为仅用植物制剂或植物制剂合用NSAIDs。有14例患者同时服用激素类药物与NSAIDs。
3 讨论
RA是一种病程长、致残率高的自身免疫性疾病,其发病机制暂不明确。该病主要患病人群集中在30~50岁,女性患病人数约为男性的3~4倍[1,2]。本研究患病年龄集中在40~55岁,男女比例为1∶5.2,稍高于既往报道数据,可能与样本量偏小或地区流行病学相关。目前使用的RA口服药物主要为NSAIDs、DMARDs、激素类药物、植物制剂类等。

表3 治疗RA的药物类别及各类药物使用频次
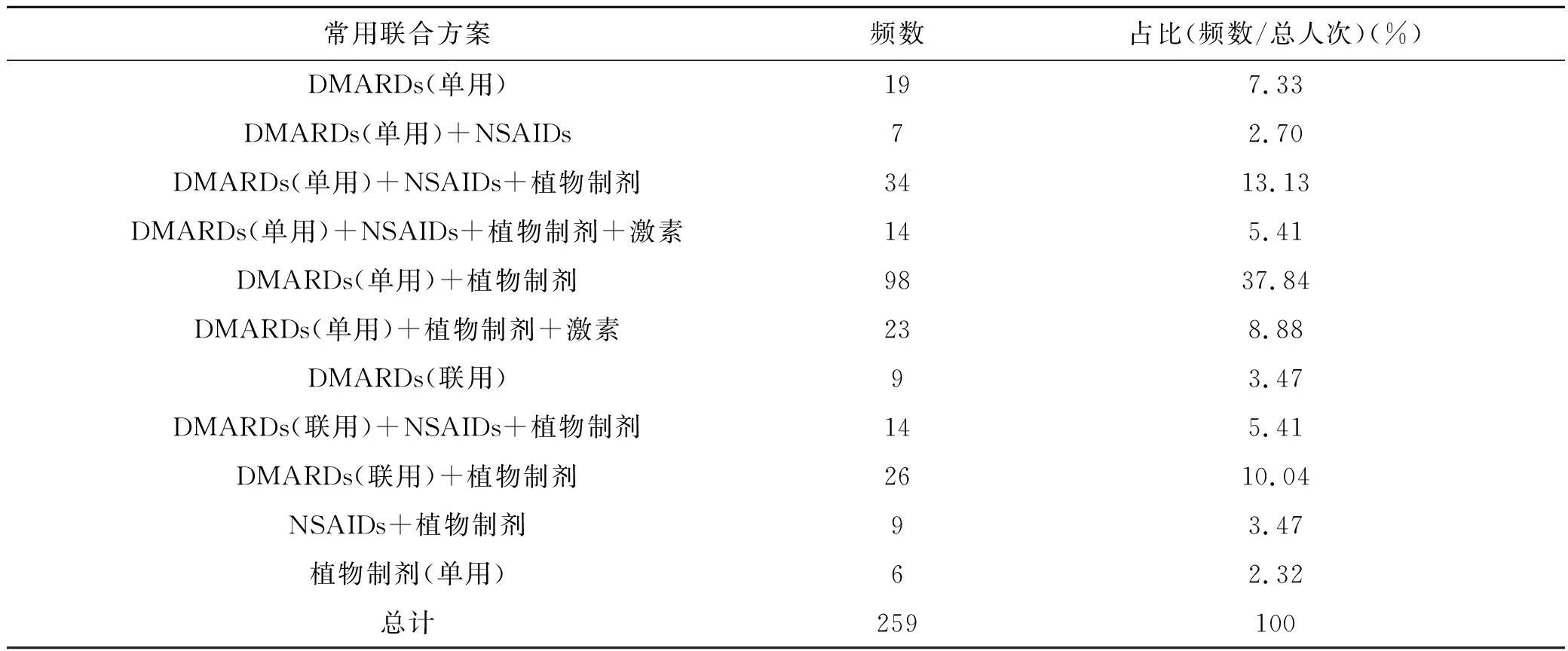
表4 RA常用处方用药方案
RA治疗管理是一个长期过程,因此合理、规范的用药对于RA治疗及减少治疗用药不合理所致的不良反应具有极其重要的作用。
DMARDs是目前治疗RA的主要药物。研究调查显示,本院DMARDs药物使用频率排序依次为,来氟米特、甲氨蝶呤、硫酸羟氯喹、柳氮磺吡啶肠溶片及艾拉莫德。来氟米特使用频次高于甲氨蝶呤,而其他药物使用占比较低的原因可能如下。①近年来间质性肺炎发病率呈明显的上升趋势[3],且本次研究RA患者病程较长,易继发不同类型肺间质病变[4],此时不再适宜使用甲氨蝶呤。②来氟米特与甲氨蝶呤在有效性和安全性上是相似的[5],而且来氟米特可抑制破骨过程,减少骨丢失,降低患者骨质疏松及骨折的风险,而甲氨蝶呤无此作用[6,7],在不考虑经济成本的前提下,临床上可优先考虑选用来氟米特。③柳氮磺吡啶肠溶片适用于病程短,症状轻的RA患者;硫酸羟氯喹对于眼部损伤较大,且常为不可逆性;艾拉莫德价格较昂贵,不利于临床推广。因此在本研究中使用较少。
此外,采用DMARDs联合治疗方案的患者占46%,使用比例较高。有研究[8,9]认为不同DMARDs的作用机制不同,可以通过药物疗效的互补提高治疗效果,缩短疗程。但是,Wang等[10]研究发现来氟米特通过间接激活过氧化物酶体增殖激活受体α(peroxisome proliferation-activated receptorα, PPARα),可显著提高甲氨蝶呤的血药浓度,进而降低胆汁排泄,增加肝脏负担,甚至延迟肝纤维化相关疾病的恢复[11]。这也表明,联合使用可能提高副作用发生的潜在风险。因此,在考虑RA患者治疗时,采用联合用药需谨慎。若RA患者采用DMARDs联合治疗方案,应适当增加患者复诊及随访频率。
NSAIDs可以有效缓解患者关节疼痛的症状,是RA急性发作期的常用治疗药物。本研究中NSAIDs使用率超过30%,主要为传统NSAIDs类药物洛索洛芬,其次为特异性COX-2抑制剂塞来昔布。《消化性溃疡病诊断与治疗规范》[12]认为普通人群优先考虑传统NSAIDs药物,更能体现成本-效益原则。而有研究表明,塞来昔布在缓解RA炎症因子方面疗效更加显著[13]。此外,塞来昔布为特异性COX-2抑制剂,因其只抑制COX-2,对COX-1没有抑制作用,相比传统NSAIDs药物而言,可显著降低胃肠道不良反应[14]。但是也有研究认为COX-2抑制剂对于胃肠道依然存在一定损害作用,并可能会增加心血管风险,并且塞来昔布的相关不良反应与剂量呈正相关[15],使用时应当综合评价患者心血管状况。因此,对于RA患者而言,尽量短期、小剂量或不使用NSAIDs药物,对于关节疼痛患者提倡选用NSAIDs外用制剂以减轻症状。
糖皮质激素常被作为RA患者不耐受NSAIDs的“桥梁”用药,或中重度活动患者。《2018年中国类风湿关节炎指南》[2]建议RA患者使用糖皮质激素应当遵循小剂量(泼尼松≤10 mg/d)、短疗程的原则。本研究中RA患者使用激素者占比低于15%,但有2张处方中醋酸泼尼松龙超剂量用药。长期高剂量使用糖皮质激素,可能会增加患者感染、骨质疏松、恶性肿瘤等风险。此外,本研究有14例患者服用激素的同时,持续或间断性使用NSAIDs,两者合用会增加消化道出血风险,为不合理用药,应当引起临床医师注意。
植物制剂的使用率总占比超过120%,表明有部分患者为两种或两种植物制剂联合使用,其中白芍总苷胶囊使用频率最高。研究表明白芍总苷胶囊不仅具有缓解关节疼痛,还具有一定护肝作用,可减少DMARDs的肝损害[16]。目前治疗RA的植物制剂种类较多,本院常用制剂包括雷公藤制剂、白芍总苷胶囊、正清风痛宁、痹痛定、通络开痹片等,该类药物主要成分均为中药提取物。虽然部分临床试验研究[17-19]认为此类药物与DMARDs合用,可以有效降低炎症因子,改善临床症状,但是目前植物制剂的安全性和有效性还缺乏高质量研究结果支持。本研究15名患者仅使用植物制剂或植物制剂合并NSAIDs控制病情。有研究表明单纯植物制剂联合使用,治疗效果较DMARDs差,而且增加患者经济负担[20]。因此,对于确诊的RA患者在选择治疗方案时,若无明显禁忌症或副作用,DMARDs仍然应该成为首选治疗药物。
本研究中患者常规选用PPIs(雷贝拉唑肠溶片、兰索拉唑肠溶片)为护胃药物,占比约23%。由于RA患者服用NSAIDs药物或者激素类药物,消化道疾病风险增加,因此常常辅助服用PPIs进行护胃治疗。但是,有研究认为NSAIDs不仅导致上消化道(胃、十二指肠)粘膜损伤,还可能会造成大肠、小肠粘膜损伤[21]。而PPIs益胃不益肠,甚至可能加重小肠损伤。建议使用特殊组胺H2受体拮抗药拉呋替丁作为护胃的辅助治疗,该药是目前唯一具有适度抑酸和全消化道黏膜保护作用的药物[22]。
本研究处方中,钙剂使用人群仅占10%,临床应用较低。长病程RA会导致骨质不同程度丢失,同时RA患者经常采用糖皮质激素治疗,也是导致骨质疏松甚至后期致残的重要因素之一。《2010年类风湿关节炎指南》[1]明确表明,在激素使用过程中应当抗骨质疏松治疗。本研究中激素使用率14.29%,远高于钙剂使用率。《中国老年骨质疏松诊疗指南(2018)》[23]也指出糖皮质激素使用(任何剂量下,口服超过3个月) 、高龄、RA都是骨质疏松的危险因素,而对于骨质疏松患者和(或)伴有骨折高风险的人群,建议补充钙剂和(或)维生素D,并且在无禁忌症的情况下应该与活性维生素D、双膦酸类药物等抗骨质疏松药物联合应用。临床医生早期预见骨折风险,积极采取措施,能够有效减少骨折发生,提高患者后期生活质量。
RA病情复杂,其治疗是一个长期过程。本研究通过对本院某一时期RA患者基本信息及处方用药信息的分析,提示RA的治疗需要临床医师在掌握药物的使用及诊疗原则前提下,通过更多高质量研究证据的支持,实现规范化诊疗,提高RA的治疗效果。

