超声波辅助提取宣木瓜多糖工艺优化
陈禹 陶志杰 罗璇
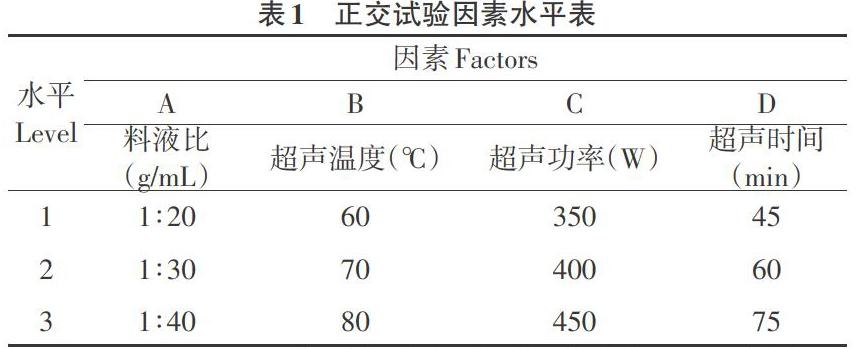

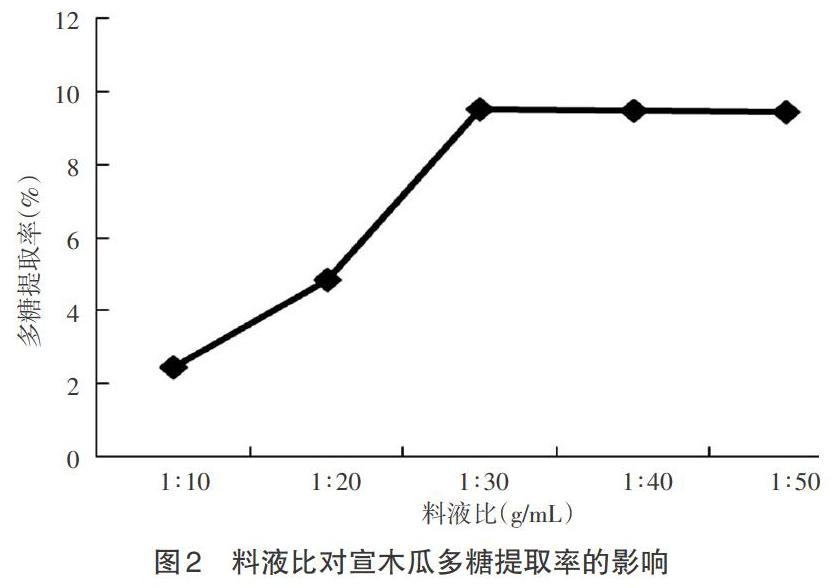
摘 要:以宣木瓜为原料,采用超声波法正交试验设计优化提取其中的多糖,研究不同料液比、超声时间、超声温度和超声功率对宣木瓜多糖提取效果的影响,结果表明;在料液比为1:40(g/mL),超声时间45min,超声温度80℃,超声功率400W时宣木瓜多糖的提取率最高;宣木瓜多糖的最佳提取率为10.61%,优化提取条件可使宣木瓜多糖的提取率提高3.24倍。
关键词:宣木瓜;多糖;超声提取;正交试验
中图分类号 Q8141.1文献标识码 A文章编号 1007-7731(2020)22-0128-04
Abstract:The optimum extracting conditions of polysaccharide from Chaenomeles speciosa with ultrasonic were studied by the orthogonal test design. The effects of different material liquid ratio,ultrasonic time,ultrasonic temperature and ultrasonic power on the extraction of polysaccharide from Chaenomeles speciosa were investigated. When the ratio of liquid was 1:40(g/mL),ultrasonic time was 45min,ultrasonic temperature was 80 ℃ and the ultrasonic power was 400W,the extraction rate of polysaccharide was the highest,the optimum extraction rate of polysaccharide was 10.61%,and the extraction rate of polysaccharide was improved by optimizing the extraction conditions.
Key words:Chaenomeles speciosa;Polysaccharide;Ultrasonic extraction;Orthogonal experiment
宣木瓜(Chaenomeles speciosa S.Nakai),又名皺皮木瓜、铁脚梨,属蔷薇科木瓜属,特产于安徽省宣城市[1]。宣木瓜含有黄酮类、多糖、有机酸类、甾醇类等活性有效成分[2-4],传统医学认为其具有平肝和胃[5]、祛风去湿[6]、活血通络[7]、滋脾益肺等功效;现代研究表明,其具有抗氧化[8]、抗菌消炎、抗肿瘤[9]等作用。宣木瓜是我国首批列入“药食同源”的植物,具有较高的营养保健价值[10]。
多糖不仅为生物提供骨架结构和能量来源,还广泛参与细胞各种生理过程的调节[11]。近年来,对糖及糖复合物的研究已成为热点。利用现代技术提取植物多糖的方法主要包括化学溶剂浸提法,物理超声、微波、超高压辅助提取法、生物酶解法等[12-15]。提取细胞中活性物质,细胞破碎效果是提高提取效率的关键步骤之一,直接影响着多糖的提取率。本试验以宣木瓜为原料,采用超声波细胞破碎技术辅助提取多糖,对超声波影响细胞破碎效果的因素进行研究,分析各因素对提取效果的影响并优化最佳提取条件,旨在为宣木瓜多糖的开发利用奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 试验原料宣木瓜,购买于安徽蚌埠。试验试剂葡萄糖、石油醚、乙醇、苯酚、浓硫酸等试剂均为国产分析纯。试验用水为去离子水。
1.1.2 仪器与设备 B323电子天平,上海海康电子仪器厂;FW-100型高速万能粉碎机,北京市永光明医疗仪器厂;DHG-9240A电热鼓风干燥箱,上海一恒科学仪器有限公司;HH-4型数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;KDC-160HR高速冷冻离心机,科大创新股份有限公司中佳分公司;722S可见分光光度计,上海菁华科技仪器有限公司;SHB-Ⅲ予华牌循环水真空泵,巩义市予华仪器有限责任公司;JK-500DB型数控超声清洗器,合肥金尼克机械制造有限公司。
1.2 试验方法
1.2.1 提取工艺流程 宣木瓜去籽→清洗干净→烘干→粉碎机粉碎→石油醚回流脱脂[16]→称取干粉若干份→超声波提取
1.2.2 提取液的制备 将宣木瓜清洗切片处理后,60℃干燥至恒重,宣木瓜粉碎后过80目筛,石油醚回流脱脂得干粉装瓶密封待用。每份称取1.000g的宣木瓜粉装入100mL锥形瓶中,以不同料液比加入去离子水混匀,将其分别置于超声波清洗器中在不同超声时间,不同超声提取温度和不同超声功率的设置条件下进行提取,然后将提取液进行抽滤,离心(6000rmp,20min),取上清液进行适当稀释,待测。
1.2.3 多糖测定(苯酚-硫酸法[17]) 分别量取0.5mL待测液于试管中,加入1mL现配浓度为6%的苯酚溶液混匀,再迅速加入5.0mL浓硫酸轻轻摇匀,将其放置沸水浴里加热20min后,取出冷却至室温,用可见分光光度计在490nm波长处测定吸光度。
[宣木瓜多糖提取率(%)=C×V×n1000m]×100
式中:C为提取液中宣木瓜多糖的质量浓度(mg/mL);
V为提取液的总体积/mL;n为稀释的倍数;m为称取的宣木瓜干粉的质量/g。
1.2.4 葡萄糖标准曲线的制备 精密称取10mg葡萄糖于105℃温度下干燥至恒重,用蒸馏水将其溶解后再定容至100mL容量瓶中,制成0.1mg/mL葡萄糖标准溶液。各取0、0.2、0.4、0.6、0.8、1.0mL葡萄糖标准溶液加入去离子水定容至2mL,由此可以得到浓度为0、0.01、0.02、0.03、0.04、0.05mg/mL的梯度液,分别从梯度液中各取1mL按照“1.2.3”中的方法进行测定吸光度值,绘制葡萄糖标准曲线,得出回归方程。
[3]龙全江,王晓阁.宣木瓜化学成分、药理作用与采收加工技术研究[J].甘肃中医学院学报,2014,31(01):44-46.
[4]韩立敏.木瓜有效成分的研究[J].安徽农业学,2009,37(23):10969-10970,11002.
[5]陳雪梅.野木瓜多糖对肝损伤大鼠的保护作用[J].中国老年学杂志,2016,36(04):775-777.
[6]薛丹.皱皮木瓜多糖的制备及抗类风湿关节炎药理活性研究[D].北京:第二军医大学,2015.
[7]杨之敏,谢笑龙,钱民章.正安野木瓜多糖抑制血小板聚集[J].中国动脉硬化杂志,2009,17(07):594.
[8]Xianfei Xie,Guolin Zou,Chenghai Li. Purification,characterization and in vitro antioxidant activities of polysaccharide from Chaenomeles speciosa[J]. International Journal of Biological Macromolecules,2016,92:702-707.
[9]Xianfei Xie,Guolin Zou,Chenghai Li.Antitumor and immunomodulatory activities of a water-soluble polysaccharide from Chaenomeles speciosa[J]. Carbohydrate Polymers. 2015,6(46):323-329.
[10]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:57.
[11]黄艺宁.猪肚菇子实体多糖的酶法提取工艺及其生物活性[J].怀化学院学报,2018,37(05):9-13.
[12]田冰梅,谢晓梅,沈盼盼,等.分级醇沉宣木瓜多糖含量、分子量测定和活性初步研究[J].光谱学与光谱分析,2015,35(05):1331-1334.
[13]王文平,郭祀远,李琳,等.野木瓜水溶性多糖的提取、分离及结构分析[J].华南理工大学学报:自然科学版,2008,36(7):128-132.
[14]伍亚华,王永斌,石亚中,等.宣木瓜多糖的超高压提取及体外抗氧化活性研究[J].蚌埠学院学报,2017,6(06):1-5+29.
[15]黄锁义,刘胜利,郭立强,等.正交设计优化木瓜多糖的超声提取工艺[J].安徽农业科学,2012,40(05):2618-2620.
[16]李娜,张卫明,姜洪芳,等.宣木瓜中多糖含量测定[J].中国野生植物资源,2010,29(05):55-57.
[17]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007(04):276-279.
(责编:王慧晴)

