影响检测生活饮用水中菌落总数的相关因素探讨
张 席
上海工微所科技有限公司, 上海 200233
细菌总数是评价水质污染程度的主要卫生指标,长期以来,国内多采用异养菌平板计数法[1,2]来测定水中的活菌数,现今对生活饮用水中的菌落总数检测主要是根据《生活饮用水标准检验方法 微生物指标(GB/T 5750.12—2006)》中的平板计数法[3]来做,但由于饮用水中的贫营养环境有别于传统培养基提供的富营养环境,大多数在显微镜下观察到的细菌不能在传统培养基中生长,致使活菌计数结果偏低。吖啶橙染色直接计数、活菌直接计数等方法可快速提高饮用水中的活菌计数[4],但这些方法要求高,需配备昂贵的仪器设备及专业技术人员。大部分小实验室还是会选择比较简单的平板计数法,所以提高现有平板计数法的活菌检出率是很有必要。
GB/T 5750.12—2006检测水中菌落总数使用营养琼脂(36±1) ℃培养48 h,而《食品安全国家标准 食品微生物学检验 菌落总数测定(GB 4789.2—2016)》中菌落总数检测[5]采用平板计数琼脂,并规定一般食品为(36±1) ℃培养(48±2)h,水产品是在(30±1) ℃培养(72±3) h,这是因水产品在温度较低的水底生长,兼受海洋细菌与陆地细菌的污染,故以30 ℃作为培养温度[6]。
本文将通过培养基的种类、培养温度、实验操作方法等条件和方法的比较,探讨影响水中菌落总数检测结果的影响因素,筛选合适的检测参数,采用营养修复和实样统计分析等手段研究缩短检测时间的可能性,以提高平板计数法的检出率的同时减少检测时间,为GB/T 5750.12—2006中菌落总数检测方法的改进提供数据。
1 材料与方法
1.1 主要仪器
培养箱(型号LRH-250,上海齐欣科学仪器有限公司);灭菌锅(型号LDZX-50FBS,上海申安医疗器械厂);水浴锅(型号DK-S28,上海精宏实验设备有限公司);显微镜(型号BX-53,奥林巴斯) ;温度计(型号0-100℃,上海华辰医用仪表有限公司);气浴恒温振荡器(型号THZ-82A,金坛市万华实验仪器厂);光学放大菌落计数器(型号 YLN-30,北京市亚力恩科学器材公司)。
1.2 供试培养基及样品
葡萄糖(批号20180403,江苏强盛功能化学股份有限公司);营养琼脂(批号20190102,青岛高科技工业园海博生物技术有限公司);平板计数琼脂(批号20191127,青岛高科技工业园海博生物技术有限公司);脑心浸液肉汤(批号20180726,青岛高科技工业园海博生物技术有限公司);硫代硫酸钠(批号20181101,无锡市亚泰联合化工有限公司);样品:生活饮用水(由某食品加工生产企业送检提供或实验室自备)。
1.3 实验方法
1.3.1两种培养基在不同培养条件下对菌落总数检测结果的影响比较
在每125 mL生活饮用水样品中加入0.1 mL的1%硫代硫酸钠灭菌溶液进行除氯,振荡摇匀后立即吸取1 mL分别置于8块无菌平皿中,其中4块倒入营养琼脂培养基,另外4块倒入平板计数琼脂培养基,待凝固后每种培养基的其中2块置于36 ℃培养2 d~10 d,另2块置于30 ℃培养2 d~10 d,分别观察结果。同时平行三次试验,取其平均值来比较分析。
1.3.2添加不同比例的葡萄糖对检测结果的影响比较
在营养琼脂培养基中各加入0.0%、0.1%、0.3%、0.6%和1%的葡萄糖;在平板计数琼脂培养基中加入0.0%、0.2%、0.5%和0.9%的葡萄糖,使两种培养基中葡萄糖含量保持一致,将样品除氯后,吸取1 mL分别置于36块无菌平皿中,分别倒入这两种含有不同比例葡萄糖的培养基,待平板凝固冷却后分别置于36 ℃和30 ℃培养2 d~10 d。
1.3.3涂布平板法与倒平板法对检测结果的影响比较
5个样品除氯、摇匀后,分别吸取0.5 mL置于4块无菌平皿中,其中2块倒入(45±1) ℃平板计数琼脂培养基,另外2块倒入(40±1) ℃平板计数琼脂培养基,同时置于30 ℃培养2 d~10 d。同时,分别吸取0.5 mL置于2块已倾注好平板计数琼脂的无菌平皿中,用涂布法将样品涂布均匀后,置于30 ℃培养2 d~10 d。
涂布的无菌平皿应提前制备,平板计数琼脂倾注到无菌平皿中后做去水汽处理,避免涂布后细菌混在一起无法计数。本实验所用无菌平皿,是当天倾注好后打开平皿盖子,放置在生物安全柜内通风2 h~4 h后,取出备用。
1.3.4营养修复后再培养对检测结果的影响
加强充足的营养环境来复苏或修复[7]细胞,可能会提高生活饮用水中的活菌检出率。批量样品除氯后,按样品: 脑心浸液肉汤(BHI)为1∶1、1∶5、5∶1、1∶10和10∶1的量加入BHI液体培养基中,25 ℃下分别修复培养0 h、2 h、4 h和6 h后,平板计数琼脂30 ℃培养2 d~7 d,计数,分析营养修复对计数的影响。
1.3.5按改进后方法对批量样品检测结果的统计分析
采用改进后的方法,即平板计数琼脂、涂布平板、30 ℃、培养7 d,对自备的实验室自来水管道用水20个、企业送检的水样42个进行检测,记录培养2 d、3 d和7 d时的计数。用SPSS 17.0对计数进行统计分析。
2 结果与讨论
2.1 两种培养基不同培养条件的计数比较
采用营养琼脂和平板计数琼脂在30 ℃、36 ℃下培养2 d~10 d后的计数结果见图1,可看出,GB/T 5750.12—2006中使用营养琼脂(36±1) ℃培养48 h(2 d)的数据明显较低;相同培养温度和培养时间下,平板计数琼脂上生长的菌落总数明显高于营养琼脂培养的实验结果;从第3 d开始,30 ℃条件下的菌落总数明显高于36 ℃培养的结果,说明平板计数琼脂培养基、30 ℃更适合生活饮用水中菌落总数的生长。

图1 两种培养基分别在36 ℃、30 ℃培养2 d~10 d的菌落总数

表1 平板计数琼脂在30 ℃培养2 d~10 d的菌落数日增长率及与10 d计数的比值
表1是平板计数琼脂在30 ℃下培养2 d~10 d的菌落计数的每日增长率及其与10 d计数的比值。结果发现,平板计数琼脂30 ℃培养2 d后,在培养基上形成的肉眼可见的菌落,仅占10 d可见菌落的11.2% 左右,3 d后提高至40.8%,3 d的增长率达到了263.6%,而后开始逐步下降,直到6 d还有19.4%以上的增长率,从7 d开始增长率下降至7.0%以下,说明水中细菌总数在2 d~6 d增长幅度很大。对2 d~9 d与10 d成对实验数据平均数进行t检验[8],2 d~6 d与10 d的实验结果有显著差异,而7 d~9 d与10 d实验结果没有显著差异。说明水中菌落总数在平板计数琼脂中、30 ℃条件下需要培养7 d才能达到生长峰值。
2.2 添加不同比例葡萄糖对计数结果影响的比较
比较平板计数琼脂和营养琼脂两种培养基的配方成分,发现前者比后者多0.1%的葡萄糖。平板计数琼脂更适合水中菌落总数生长是否是因为多了葡萄糖,因此,在两种培养基中添加不同比例的葡萄糖,研究葡萄糖对计数的影响。
图2是两种培养基添加不同比例的葡萄糖后在36 ℃、30 ℃下培养2 d~10 d的计数结果。可以看到,在同一种培养基中,30 ℃培养结果明显高于36 ℃培养结果,与图1显示的结果一致;添加葡萄糖后的营养琼脂,36 ℃下培养的检出数有少量提高,30 ℃下的培养结果反而降低;添加葡萄糖后的平板计数琼脂培养基,两个培养温度下的检出率均没提高,说明原有的0.1%葡萄糖已能满足微生物生长的需要。
2.3 倒平板法与涂布平板法对检测结果的影响比较
表2是涂布平板法与倒平板法对检测水中菌落总数的影响比较。发现两个方法在2 d~6 d菌落总数累积增长率都在700%以上,说明在2 d~6 d菌落总数呈大幅生长趋势,7 d~10 d累积增长率只有18.0% 以下,说明生长开始趋于平稳;倒平板法在30 ℃培养2 d后,在培养基上形成肉眼可见的菌落仅占10 d可见菌落的5.6%~6.4%,3 d后约占10 d平板上菌落总数的23.9%~25.4%;用涂布平板法在30 ℃培养2 d后,在培养基上形成肉眼可见的菌落仅占10 d可见菌落的8.6%左右,3 d后约占10 d平板上菌落总数的30.3%,说明两种方法相差不大,涂布平板法没有显著提高检出率。
倒入(40±1) ℃、(45±1) ℃两种温度的培养基经10 d培养后的计数结果无显著性差异,说明倒入40 ℃~45 ℃的培养基对水中微生物的影响不大。通过2 d~9 d与10 d成对实验数据平均数比较t检验[8],2 d~6 d与10 d检测结果有明显的差异,7 d~9 d与10 d实验结果都没有显著差异。从图3中也可明显看出涂布平板法与倒平板法检测菌落总数结果无差异性。
图4是涂布平板法与倒平板法在30 ℃培养3 d的照片,可看出,涂布平板比倒平板上的生长菌落明显大,计数方便。倒平板法在倾注培养基时要控制好培养基的温度,避免温度太高杀死部分不耐热细菌致使计数偏低,或温度太低无法与样品均匀混合使细菌生长不均等问题[9],涂布平板是提前配制,不存在这些影响因素。因此确定水中菌落总数的检测采用平板计数琼脂、涂布平板、30 ℃培养7 d的方法。



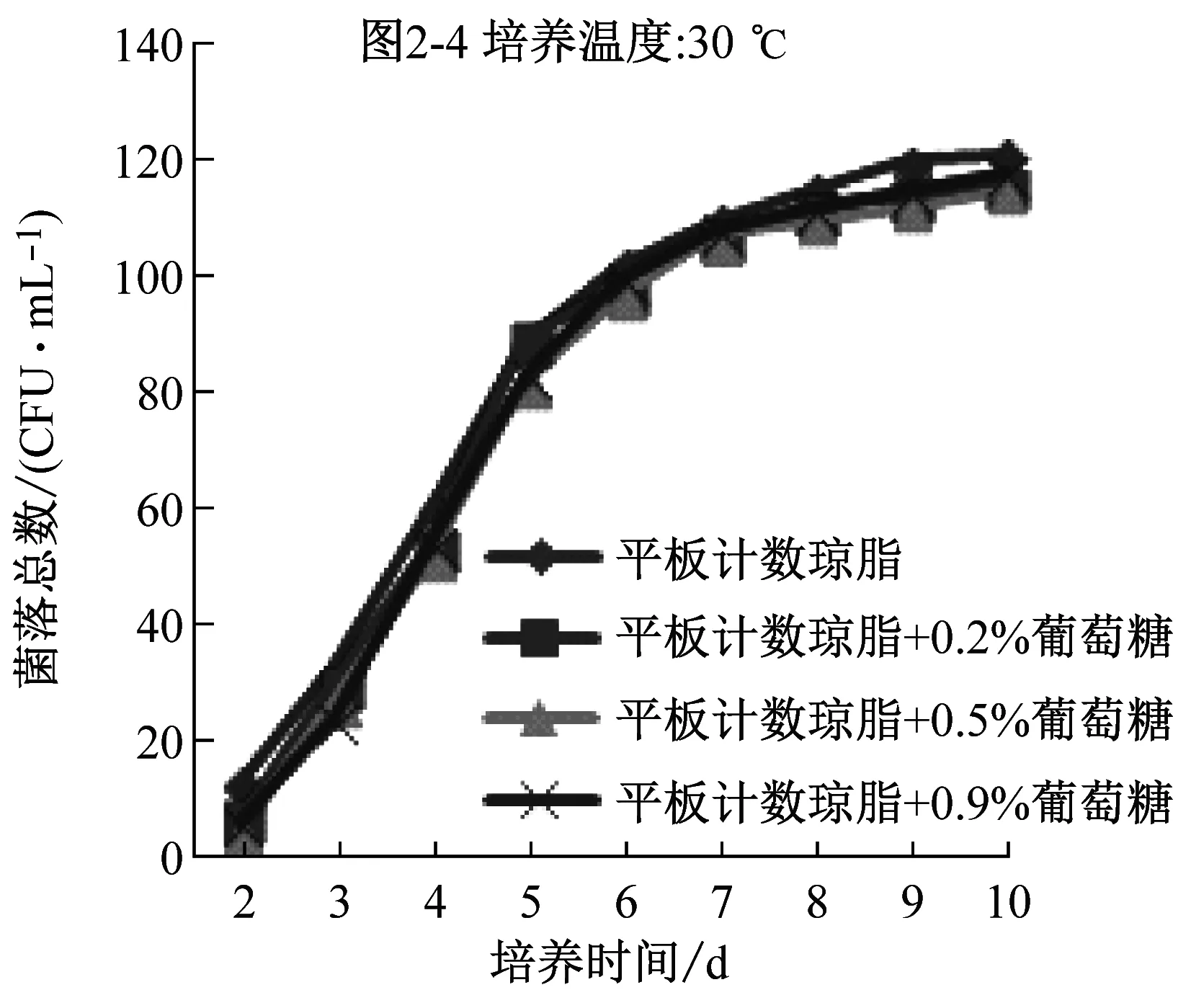
图2 两种培养基添加不同比例葡萄糖后在36 ℃、30 ℃培养2 d~10 d的计数结果

表2 涂布平板法与倒平板法对水中菌落总数检测的影响比较

图3 涂布平板法与倒平板法用平板计数琼脂30 ℃培养2 d~10 d的计数结果

图4 涂布平板法(左)与倒平板法(右)30 ℃培养 3 d的照片
2.4 营养修复后再培养对检测计数的影响
改进后的生活饮用水中菌落总数的检测方法已确定,但该方法需培养7 d,时间较长。一般生活饮用水中的营养贫乏,而还有含氯的抑菌物质存在,对水中的微生物细胞都会有影响,通过镜检观察到有芽孢菌存在,说明有细胞受损等情况,所以水中微生物生长缓慢,需要较长的培养时间。通过加强充足的营养环境来复苏修复受损的细胞,可能可以加快细胞生长,缩短培养时间。
批量样品经营养修复实验后,发现水样中微生物主要有两种类型,A类是营养修复后对其活菌生长速率没影响;B类是自身能正常生长,营养修复后,生长速率加快。
A类样品,除氯后在25 ℃条件中增加不同浓度的营养物质BHI修复0 h~6 h,结果均没有出现增殖现象,在较高营养物质浓度中出现随着修复时间加长而生长下降的趋势,增加营养对细胞修复有限,不能提高活菌生长速率,见图5。
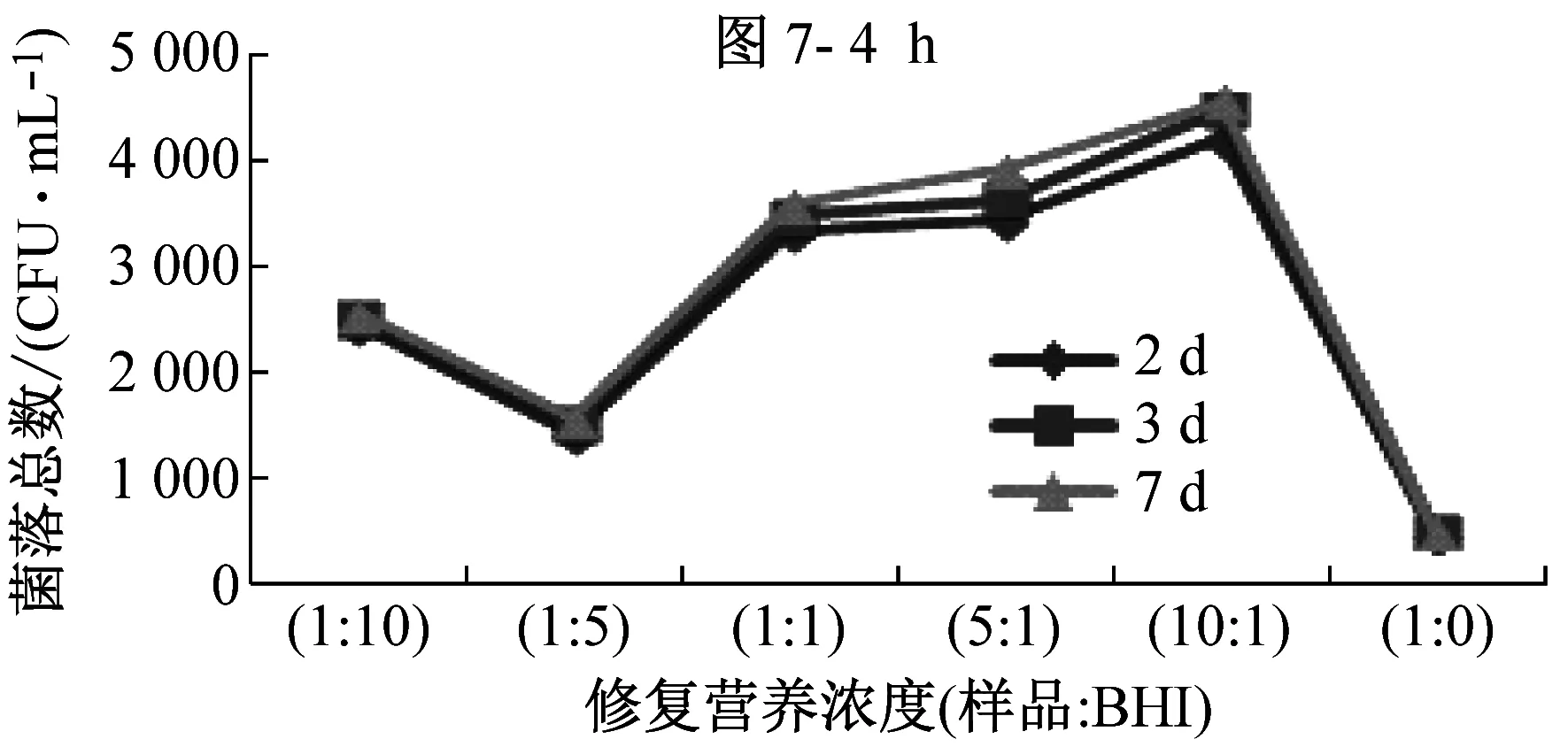
B类样品,除氯后在25 ℃环境条件中修复0 h~6 h,随着修复时间的增加,样品原液(1∶0)和不同修复营养浓度下的样品的菌落总数均出现大幅度增殖,见图6,说明此类细菌易生长,无需修复。如图7所示,B类样品经修复后,在30 ℃下培养2 d、3 d和7 d的检测结果无明显差别,说明B类样品只需培养2 d~3 d就能达到最高峰值。

图5 A类样品经在不同修复营养浓度中25 ℃修复0 h~6 h后检测结果
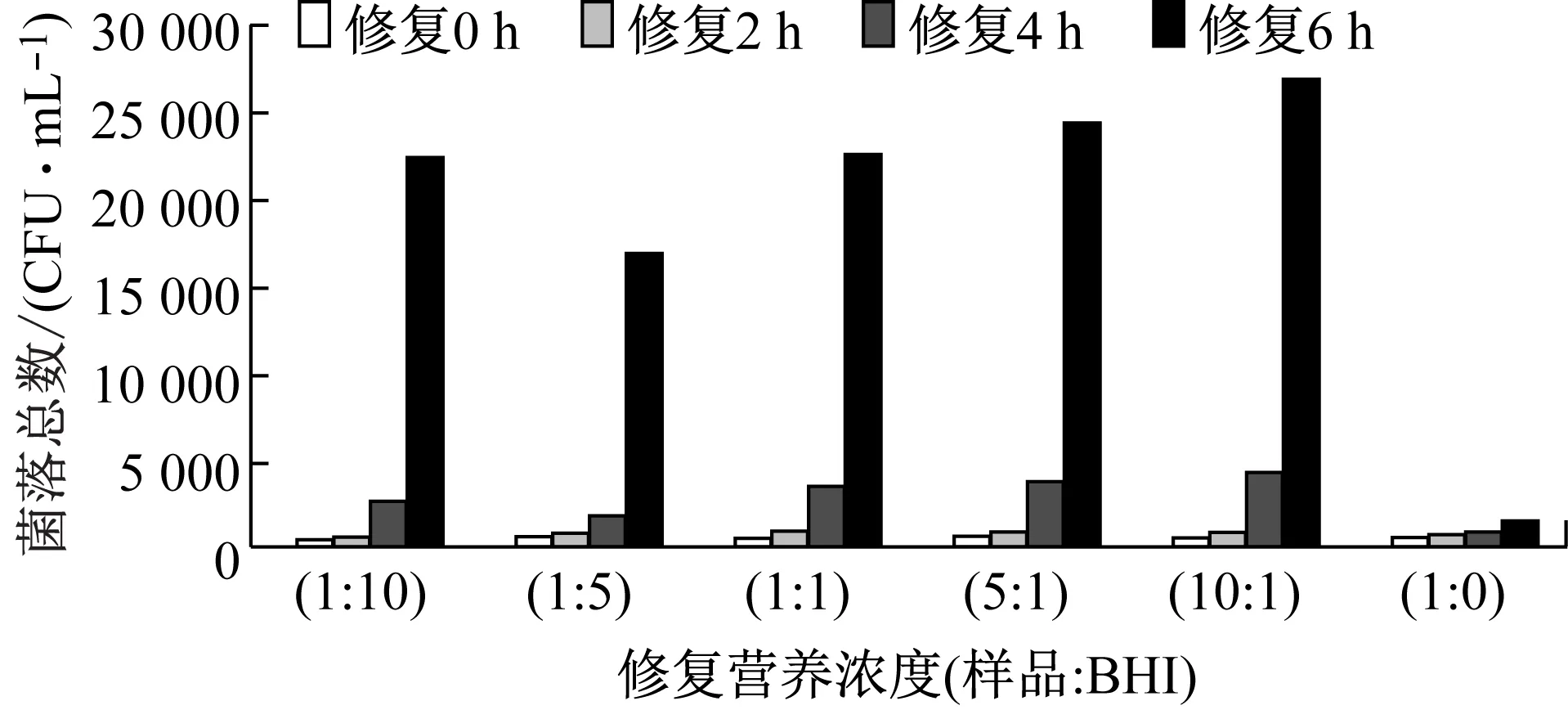
图6 B类样品经在不同修复营养浓度中25 ℃修复0 h~6 h后检测结果

从图8、图9中看出,两类水样中的菌落形态不一样,A类水样菌落形态为灰白色、暗黄色、橘红色为主要菌落,而B类水样生长在平板计数琼脂表面的是比较大且较粘稠的乳白色菌落、表层里的为乳白色细小菌落。
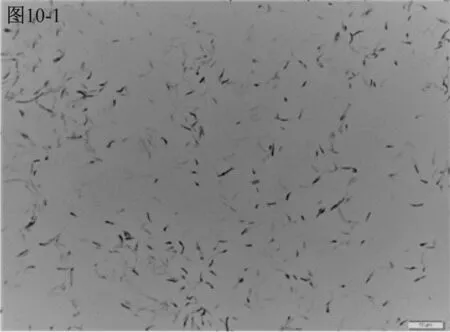
进一步镜检结果见图10。A类水样检测平板上的三种细菌分别为以弧菌、长杆菌与短杆菌,并有少量芽孢菌存在,如图10-1、10-2、10-3所示。有芽孢菌说明水中的部分细菌由于各种原因受抑制、损伤而在短时间内尚未形成肉眼可见的菌落,需继续培养后使其复苏并繁殖形成菌落[10],培养刚开始2 d形成的菌落比较少,此类菌生长缓慢需培养7 d。而B类水样检测平板上的两种看似大小不一的细菌,经镜检发现都是球菌,见图10-4,说明B类水样生长的菌,在需氧条件下生长比厌氧条件下生长形成的菌落更快速,总的来说,此类细菌是一种容易生长的优势菌,培养2 d~3 d即可。
图8 A类样品修复0 h~6 h后培养7 d的照片(从上右顺时针0 h、2 h、4 h和6 h)

图9 B类样品的0 h~6 h后培养7 d的照片(从上右顺时针0 h、2 h、4 h和6 h)

因此加强充足的营养物质,只会让某类易生长的优势菌大幅生长,没能让所有细菌达到同步生长繁殖,反而出现增殖或减少,影响检测结果,故生活饮用水中菌落总数的检测不宜采用营养修复方式进行预处理,一般水样收到后应尽快开始检验,以尽量减少细菌群的变化,零星送检的瓶装采样,若未经冷却,采样后6 h之内应行检验[11]。
2.5 按改进后方法对批量样品检测结果的统计分析
按改进后方法对62个水样进行检测,记录培养2 d、3 d和7 d时的计数结果,发现7 d计数与2 d和3 d计数有一定的关系,采用SPSS 17.0对这些数据进行线性回归拟合。
62个水样中有7个样品(占比11.3%),3 d与2 d计数的比值<2,7 d检测结果与3 d计数接近,拟合后得线性回归方程(1):Y=-0.387+1.155X(R=0.989),其中Y为7 d检测结果,X为3 d计数。这类样品的菌落易生长且单一,培养2 d~3 d就达到生长峰值,与B类水样相似。
另外55个样品(占比88.7%),3 d与2 d计数的比值≥2,3 d时计数与7 d时检测结果有显著性差异,培养2 d时菌落较少,3 d时生长速率加快,7 d时达到生长高峰,与A类水样的特征比较相似,生长缓慢且有色素菌,需培养7 d后才能达到峰值。对这55个样品7 d检测结果和3 d计数进行拟合,得线性回归方程(2):Y=27.455+2.525X(R=0.928),其中Y为7 d检测结果,X为3 d计数。
改进后的方法需要培养7 d才能得到检测结果,但经过以上统计分析,可根据培养2 d、3 d计数以及相应的回归方程,预测7 d计数,从而预判样品的检测结果。
3 结 论
参考GB 4789.2—2016,对生活饮用水中菌落总数的检测方法进行了改进,发现GB/T 5750.12—2006中使用营养琼脂(36±1) ℃培养2 d的计数结果偏低,采用平板计数琼脂培养基、30 ℃下培养2 d时,计数结果达到生长最高峰值的0%~11.2%,培养3 d计数结果能达到32.6%~40.8%,培养7 d达到生长最高峰值。
涂布平板法与倒平板法的计数结果无明显差异,但涂布平板法在相同培养时间下菌落形态更大,更易于计数。
营养修复实验发现水样中的菌落有两种类型,A类特点是生长缓慢且有多种色素菌,需培养7 d才能达到峰值;B类特点是易生长且单一,培养2 d~3 d即可。营养修复不能加快菌落总数的检测时间,不建议对水样进行营养修复前处理,应立即检测。
采用平板计数琼脂培养基30 ℃培养7 d的方法检测水样的菌落总数,可根据培养3 d与2 d时计数的比值以及相应的回归方程,预测7 d时的计数结果。当样品培养3 d与2 d计数的比值<2时,7 d 检测结果Y=-0.387+1.155X(R=0.989,X为3 d计数);当培养3 d与2 d计数的比值≥2时,7 d检测结果Y=27.455+2.525X(R=0.928,X为3 d计数)。
今后生活饮用水中菌落总数测定标准GB/T 5750.12—2006的改版,可参照国标GB4789.2—2016中的水产品要求,用平板计数琼脂30 ℃培养3 d~7 d,这样更能接近反映水中菌落总数的真实数值。另外,采用改进后方法计数时有相当比例的计数结果大于100 CFU/mL,故建议对现有生活饮用水的菌落总数判定限值进行合理的修订。

