能力验证样品中玉米赤霉烯酮含量测定的不确定度评定
陆春胜 马 莉 陈云忠
(上海市崇明食品药品检验所,上海 202150)
玉米赤霉烯酮(zearalenone,以下简称ZEA)是由以禾谷镰刀菌和三线镰刀菌为主的镰刀菌产生的一种次级代谢产物,广泛存在于玉米、小麦等谷物中,可对人和动物健康产生严重影响。其主要特点是具有类雌激素样作用,对雌性动物的生殖系统损害极大,文献报道其还能导致免疫抑制、肝肾损伤、具有潜在的致癌性[1-3]。目前可以使用高效液相色谱、气相色谱、酶联免疫、薄层色谱、酶联免疫和生物传感器等方法进行检测[45]。
能力验证是实验室质量控制的主要手段之一,通过参加能力验证可以综合考察实验室的质量运行是否可靠,同时可以识别实验室存在的问题,制定相应的预防和纠正措施[5]。本实验室参加中国检验检疫测试研究院测试评价中心组织的玉米油中玉米赤霉烯酮能力验证,通过回收率t检验,对测量结果进行了修正,并给出了报告结果的测量不确定度。本研究建立了ZEA测量不确定度的评定方法,以期为实验室日常质量控制提供参考[6-9]。
1 材料与方法
1.1 试剂、仪器与材料
1260 高效液相色谱配有荧光检测器(美国 Agilent Technology 公司);ST 8R 冷冻离心机、REACTI-THERMⅢ 氮吹仪(美国 Thermo Fisher 公司);MS205DU 十万分之一电子天平、PL2002百分之一电子天平(瑞士 METTLER TOLEDO 公司);ULTRA TURRAX 高速匀浆机(德国 IKA 公司)。
乙腈、甲醇(HPLC,德国 CNW 公司);氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、吐温-20、盐酸(AR,国药集团化学试剂有限公司);实验用水为Thermo Fisher GEN PURE PRO 制备的超纯水。
玉米赤霉烯酮标准品(98.0%,加拿大 TRC 公司);玉米赤霉烯酮免疫亲和柱(3 mL,美国Beacon公司)。
试验用玉米油样品为中国检验检疫科学研究院测试评价中心提供的能力验证样品,能力验证计划编号为ACAS-PT834,样品编号分别为19-F935、19-G210;空白玉米油为市售。
1.2 试验方法
1.2.1标准溶液配制
精密称取5.0 mg,置于50 mL容量瓶中,用乙腈溶解并稀释至刻度,得最终浓度为100 μg/mL的标准储备液。
标准系列溶液配制:分别准确吸取100 μg/mL 的标准储备液0.03、0.05、0.10、0.15、0.20、0.25和0.30 mL,用乙腈-水-甲醇(46∶46∶8,V/V)定容至100 mL,配制成质量浓度为30.0、50.0、100.0、150.0、200.0、250.0和300.0 ng/mL的标准系列溶液。
1.2.2样品处理
本方法采用GB 5009.209—2016 《食品安全国家标准 食品中玉米烯酮的测定》中第一法 高效液相色谱法测定样品中ZEA的含量[5],具体测定步骤见图1。
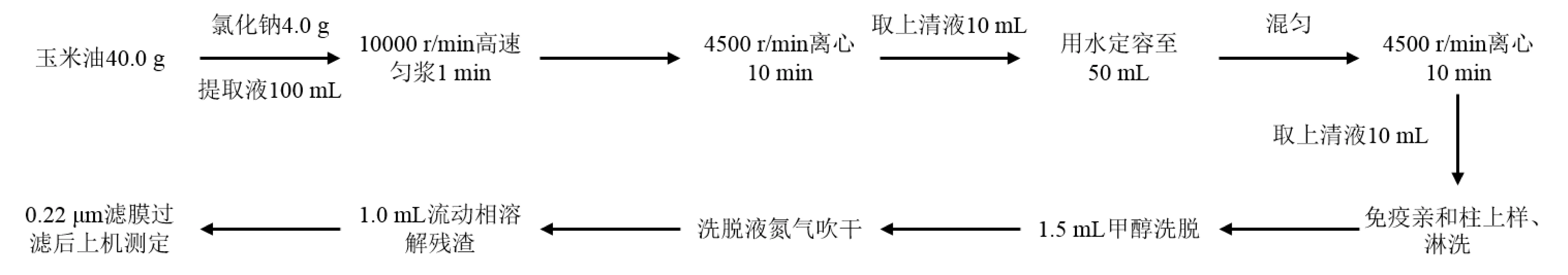
图1 玉米油中玉米赤霉烯酮含量测定步骤
样本加标:称取空白玉米油样品40.0 g,加入100 μg/mL的标准储备液0.10 mL,混匀,余同图1样品处理过程。
1.2.4色谱条件
色谱柱:Agilent XDB C18 1.8 μm 0.3×10 cm;流动相:乙腈-水-甲醇(46∶46∶8,V/V);流速:0.6 mL/min;检测波长:激发波长274nm,发射波长440 nm;进样量:10 μL;柱温:35℃。
1.2.5数学模型的建立
根据玉米油中ZEA的测定原理和方法,ZEA含量的计算公式为:
式中:X试样中ZEA的含量,μg/kg;C测定试样中ZEA的含量,ng/mL;V测定试样的最终定容体积,mL;m试样的称样量,g;1000 单位换算系数;f稀释倍数。
2 结果与分析
2.1 不确定度来源分析
从测量过程和数学模型分析,样品中ZEA测定不确定来源主要有:标准溶液、标准曲线拟合、样品称样、处理过程和测量重复性等。不确定度来源因果关系见图2。
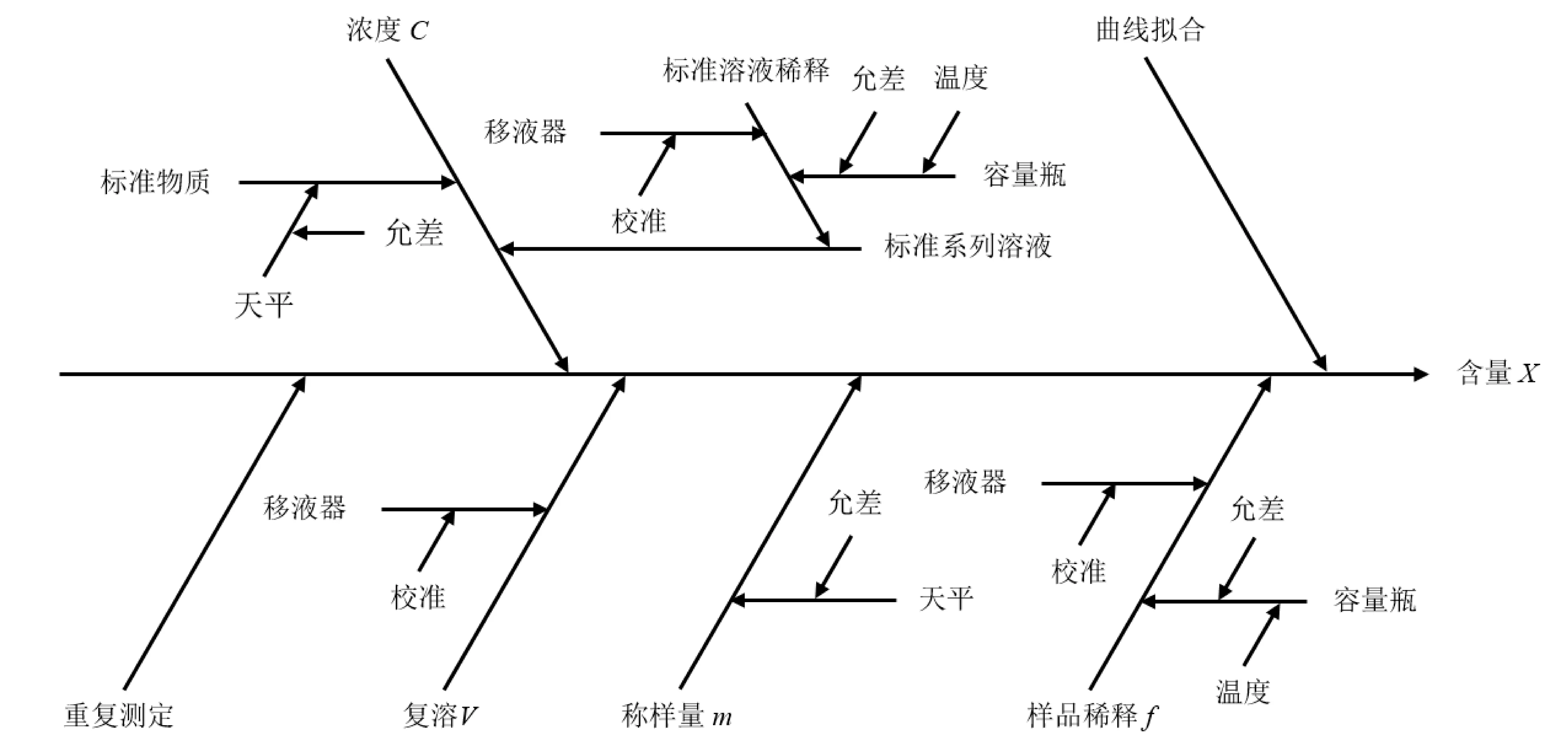
图2 不确定度来源因果关系
2.2 配制标准储备液和标准系列溶液引入的相对不确定度urel(C)
配制标准储备液和标准系列溶液引入的不确定度主要有以下几个分项构成[10-14]:ZEA标准品本身引入的不确定度urel(C1);称量标准品引入的不确定度urel(C2);50mL容量瓶定容引入的不确定度urel(C3);30~300μL可调移液器移液引入的不确定度urel(C4);100 mL容量瓶定容引入的不确定度urel(C5)。
2.2.1标准物质本身引入的不确定度urel(C1)
ZEA标准物质证书显示,纯度为98.0%,相对扩展不确定度为2.0%(k=2),引入的不确定度为u(C1)=2.0%/2=1.0%,其相对不确定度为urel(C1)=(1.0%/98.0%)×100%=1.020%。
2.2.2标准物质称量引入的不确定度urel(C2)
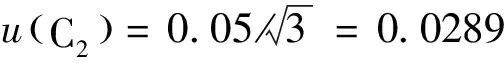
2.2.3标准物质溶解定容引入的不确定度urel(C3)
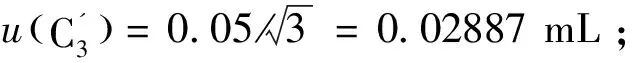
2.2.4标准系列溶液移液引入的不确定度urel(C4)

2.2.5标准系列溶液定容引入的不确定度urel(C5)
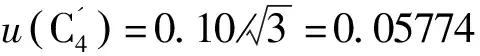
2.2.6合成urel(C)
=1.227%
2.3 样品称样引入的相对不确定度urel(m)
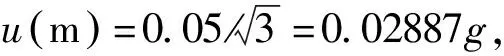
2.4 待测样品处理稀释引入的相对不确定度urel(f)
根据方法,实验中共用到100 mL单标线吸管1次,10 mL单标线吸管2次,50 mL容量瓶1次,证书显示100 mL单标线吸管MPE为0.08 mL,10 mL单标线吸管MPE为0.02 mL,50 mL容量瓶MPE为0.05 mL,均取矩形分布。乙腈和水的膨胀系数分别为1.37×10-3mL/℃和2.1×10-4mL/℃,设实验室温度变化为4℃。
按照2.2.3的计算方法,分别算得其相对不确定度urel(f1)=0.320%,urel(f2)=0.337%,urel(f3)=0.076%,urel(f4)=0.126%。
由样品稀释处理引入的相对不确定度:
=0.487%
2.5 待测样品复溶引入的相对不确定度urel(V)
根据方法,用1000 μL可调移液器定量加入1.0 mL流动相溶解残渣,证书显示其扩展不确定度为0.53 μL(k=2),引入的不确定度为u(V)=0.53/2=0.265 μL,其相对不确定为urel(V)=(0.265/1000)×100%=0.026%。
2.6 标准曲线拟合引入的相对不确定度urel(Cpred)
配制的标准系列溶液及待测样品溶液重复进样2次,以标准溶液浓度(ng/mL)为横坐标,以峰面积值为纵坐标,采用最小二乘法拟合标准曲线。标准系列溶液浓度及其对应的峰面积、校准曲线及相关系数见表1,被测样品测得数据见表2。
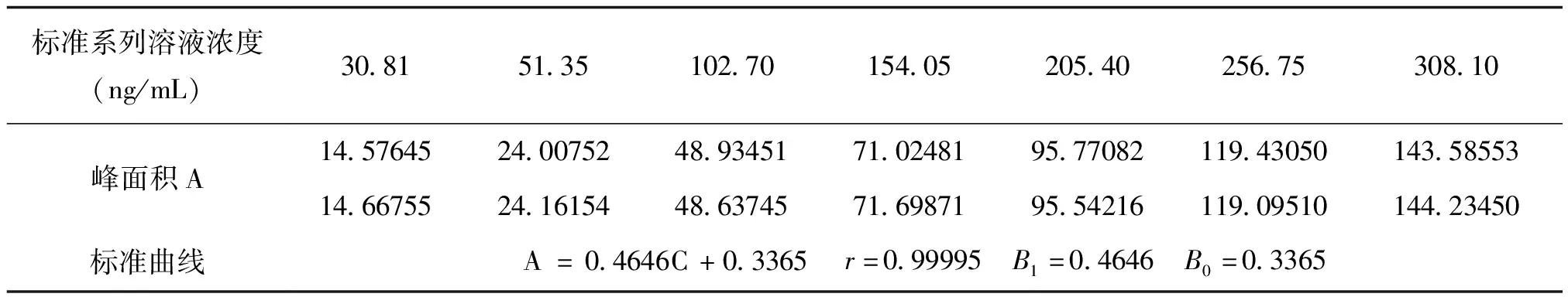
表1 标准曲线数据

表2 被测样品测得数据
采用最小二乘法拟合引入的测量不确定度u(Cpred)采用如下公式计算[15-19]:
式中:u(Cpred)标准曲线拟合引入的不确定度,ng/mL;S标准曲线的拟合标准偏差,ng/mL;B1标准曲线斜率;p对样品溶液的测定次数,本实验平行测定2次;n标准溶液的测试次数,本实验中对7个标准溶液各重复测定2次,n=7×2=14;Cpred测试样品浓度,ng/mL;C系列标准溶液的平均浓度,ng/mL;Ai标准溶液峰面积;Ci标准溶液浓度,ng/mL;B0标准曲线截距。
将表1、表2数据分别带入上述公式,得19-F935样品u(Cpred)=1.46617 ng/mL,其相对不确定度为urel(Cpred)=1.46617/217.35399×100%=0.675%;得19-G210样品u(Cpred)=1.48139 ng/mL,其相对不确定度为urel(Cpred)=1.48139/87.06576×100%=1.702%。
2.7 重复测定引入的相对不确定度urel(rep)
取6份1.2.2中的空白加标样品,按方法处理后进样测定,测得ZEA加标含量及回收率见表3。
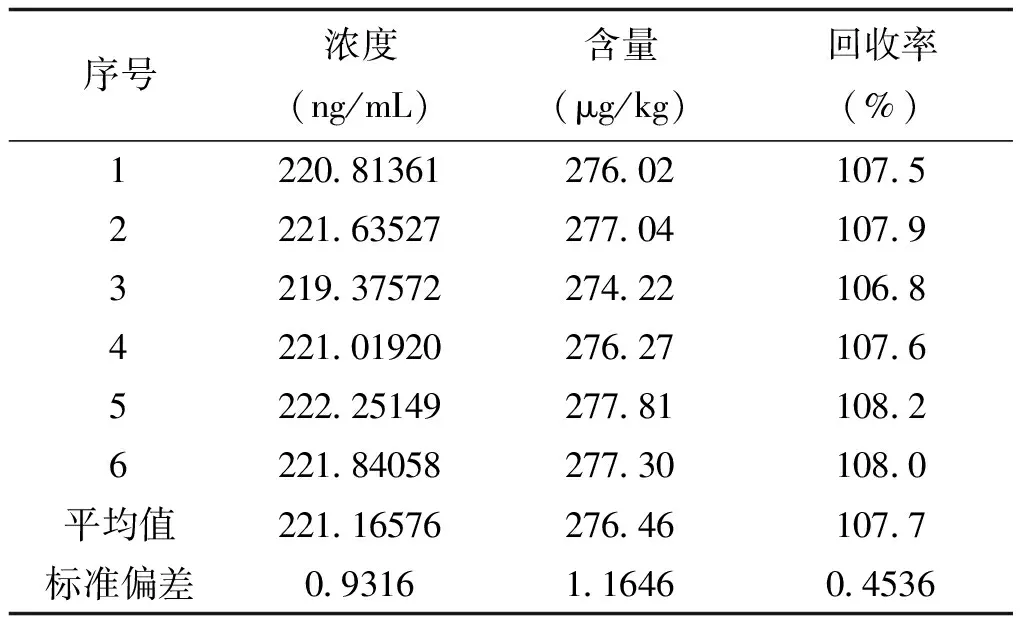
表3 玉米赤霉烯酮加标含量及回收率表

2.8 合成相对扩展不确定度Urel(X)
对各不确定度分量进行汇总,结果见表4。
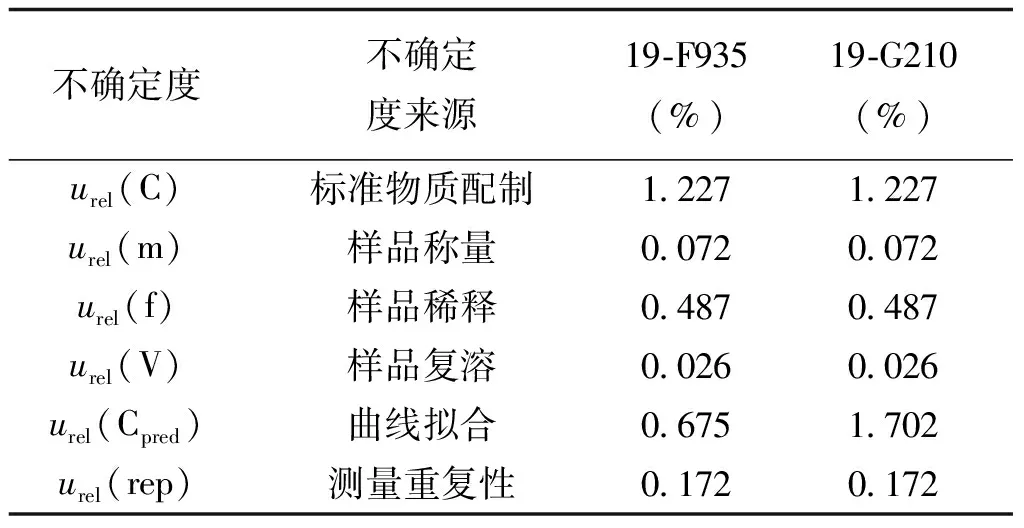
表4 不确定度分量汇总表
样品中ZEA含量测定的相对不确定度urel(X)按下式计算:
将数据代入上式,19-F935样品的urel(X)为1.495%,19-G210样品的urel(X)为2.162%。样品中ZEA含量测定的合成扩展相对不确定度Urel(X)按下式计算:
Urel(X)=k×urel(X)
k取2(包含概率为95%),代入计算得19-F935样品的相对扩展不确定度Urel(X)为3.0%,19-G210样品的相对扩展不确定度Urel(X)为4.4%。
2.9 结果报告

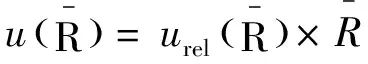
其中urel(Vadd)为加标用30~300 μL可调移液器的相对不确定度,加标样共使用6次。
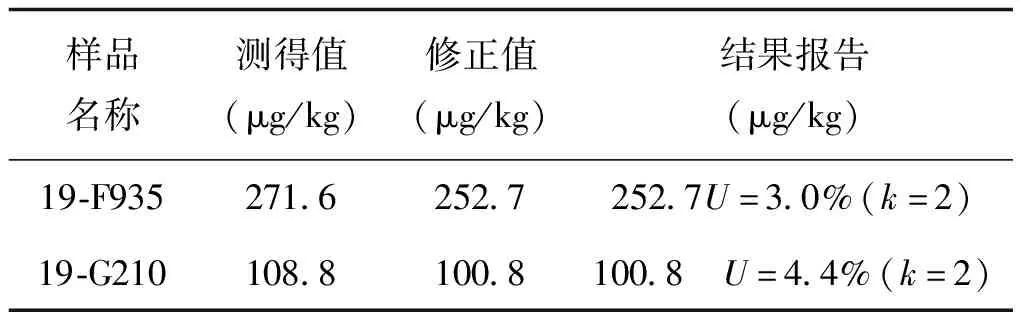
表5 结果报告及能力验证参考值
3 结论
采用回收率不确定度来检验回收率结果是否应用于结果的修正,结果表明实验测得值需进行回收率修正。修正后报告结果252.7 μg/kgU=3.0%(k=2)和100.8 μg/kgU=4.4%(k=2),能力验证结果为满意。
通过不确定度评定分析,本法中样品称样、样品定容和样品重复测量引入的不确定度影响均较小,在实际计算时可以忽略不计;标准物质配制及标准曲线拟合是主要的不确定度来源;本法预处理过程复杂,样品处理过程中引入的不确定度不可忽略。因此,实验室应选择不确定度较小的有证标准物质;在设计实验时,应设置合理的标准曲线范围、增加平行样品测定、确保HPLC系统稳定性,以减小曲线拟合时引入的不确定度;实验员应规范操作,在样品过柱洗脱及氮吹时注意样品损失,避免在复杂的样品处理过程中将不确定度放大,从而提高检测质量。

