基于纸基平台的食品安全快速检测方法研究进展
齐骥 范鑫霞 邓冬梅 何海波 罗立强


摘 要 食品安全是人类社会发展最重要的问题之一,随着食品种类的丰富和发展,快速即时、低成本、便捷化的食品安全检测方法日益受到关注。纸基分析方法具有低成本和简便化分析特点,经历了从试纸到微流控纸芯片的快速发展过程。以纸基材料结合各种分析方法形成的纸基分析装置,在食品快速检测方面显示出了良好的应用前景。本文首先介绍了纸基材料表面的功能化改性,综述了比色分析、荧光分析、电化学分析、表面增强拉曼分析等及其联用技术与纸基平台结合构建的分析方法在食品安全快速检测中研究和应用进展,最后讨论了其在食品安全快速分析检测中面临的挑战和发展前景。
关键词 纸基分析装置; 食品安全; 快速检测; 比色分析; 荧光分析; 表面增强拉曼散射分析; 电化学分析; 评述
1 引 言
食用安全的食品是人类保持健康的基本需要,食品安全和质量一直是人们关注的焦点[1,2]。根据来源和性质,影响食品安全的因素可分为以下几类:自食物原料本身的毒素,如霉菌、植物和海洋藻类; 环境污染物,如重金属离子、持久性有机污染物; 滥用的或未经批准的食品添加剂; 加工过程中的工业中间体; 农药残留; 兽用药品; 食物过敏原,如坚果成分、乳糖成分; 食源性致病菌等[3]。因此,有必要发展灵敏、高效的食品安全与检测技术以准确评估食物产业链的每个阶段潜在的有害因素[4]。目前,食品中有害物质的分析方法主要包括气相色谱法[5]、高效液相色谱法[6,7]、质谱法[8,9]、聚合酶链式反应[10~12]和免疫试剂盒测定法[13]等。因此,为满足快速筛查大量食品的需求, 尤其是对生产过程难以监管的进口食品的分析、难以利用大型仪器设备的日常检测等,发展用于食品快速分析的传感器和装置显得尤为重要[14]。纸基分析平台由于具有快速高效、易于使用、低成本的特点,受到了广泛关注[15]。
从19世纪近似测量pH值的石蕊试纸问世,到2007年Whitesides团队首次提出微流控纸芯片概念,纸基分析平台已经发展出了横向层析式、二维纸芯片、三维纸芯片等多种形式。纸芯片的发展历程也是分析技术融合于纸基平台的发展历程[16~18]。对于食品安全快速分析,纸基分析平台具有诸多优点:纸廉价易得; 纸纤维具有良好的生物相容性,无毒、可降解; 纸可以通过毛细作用使液體矢量流动,而不需要提供额外动力; 纸的可塑造性强,由于纸纤维表面含有大量羟基和少量羧基,纸表面容易进行化学改性; 纸容易加工,进行切割、折叠、堆叠等; 检测背景低,有利于光度法检测; 纸绿色环保可降解等[19]。基于纸基平台的诸多优势,越来越多的分析方法可以在纸基平台上实现,发展与各种仪器设备以及个人电子用品(例如智能手机)联用的微流控纸芯片分析传感方法已成为目前的研究发展趋势[20,21]。同时,纸基分析平台在食品安全快速检测领域展示出强大的发展活力和应用前景[22,23]。本文主要综述了用于食品安全快速检测的比色分析、荧光分析、电化学分析、表面增强拉曼(Surface enhanced Raman scattering, SERS)分析等方法及其联用技术在纸基平台上的构建与应用的研究进展,并展望了其在食品安全快速分析检测中的发展前景与挑战。
2 纸基表面功能化改性
纸基表面功能化改性是构建纸基平台分析方法的基础。纸的种类的选择是纸芯片制作的关键,目前使用最为广泛的是含有98% α-纤维素的Whatman No.1滤纸,其表面光滑均匀,流体在其内部流速合适,颗粒保留效果好。除滤纸外,硝化纤维纸、蜡光纸、玻璃纤维纸和棉纤维纸也常被采用[24]。
最常用的纤维素纸的主要组成为通过缩醛键和长链β-1,4-葡糖糖连接形成的(1→4)-β-D-吡喃葡萄糖的均聚物,具有多糖结构[15]。纤维素纸含有羟基,带负电荷,通常只能吸附阳离子和带正电荷的分子,但生物分子的修饰固定需要更高表面密度的负电荷,而在纸基修饰表面带负电荷的纳米颗粒,则需要在基质表面使用交联剂或添加表面涂层[25,26]。为了使功能分子和粒子固定在纸上,研究者开发了一些纸纤维表面改性方法。
2.1 静电吸附法
这种方法利用静电引力和范德华力将材料吸附在纸上,简单、经济[27]。将含有传感材料的溶液浸泡或直接刷涂在纸上,干燥后,即可获得所需的涂层[28,29]。
2.2 共价键修饰法
纤维素纸上的官能团包括羟基和纤维素环的还原端,可以进行化学修饰,从而引入更多活性基团。羟基是容易反应利用的基团,这些羟基的可用性和反应活性取决于与之相连的碳的位置。根据羟基参与分子内氢键的情况,C3位的OH基团活性最低,而C2和C6位的OH基团活性最强[30]。通过共价键可以使传感材料地与纸基表面稳固结合,但修饰过程通常需要多个步骤,可能破坏纸的强度性能。为了固定传感材料,目前已经发展了多种化学改性方法。纸可以被氧化生成羰基或羧基,然后与带有氨基的分子(如蛋白质或DNA)共价结合。NaBr、NaClO和2,2,6,6-四甲基哌啶-1-基氧自由基可使C6处的羟基基团氧化,形成羧基,这些处理方法已被用于酶的固定[31]。另一种方法不需要氧化产生羧基,而是通过纤维素羟基的醚化,先用NaOH激活OH基团,然后与一氯乙酸反应,进一步制备氟-2-硝基-4-叠氮苯功能化的光反应纸,用于蛋白质的固定[32]。这种技术的优点是可以附着不同的生物分子,而无需考虑其官能团。还有其它可以活化纸基表面的氧化方法,如利用甲基丙烯酸缩水甘油酯反应生成环氧基的方法[33]。生物分子的生物亲和性也可用于纸的功能化,因为很多蛋白质具有纤维素结合域。此外,纤维素纸可以通过羧基酯化羟基后进行修饰,通过这种方法可以在纸上固定偶氮染料[34]。在H3PO4或H2SO4等强酸存在的条件下,可以用HNO3将阳离子硝化纤维素纸羟基酯化[26]。此外,可以在纸上修饰可提高分子结合效率的阳离子聚合物,如聚酰胺-环氧氯丙烷和聚乙烯醇[35]。
2.3 包埋法
生物活性纸的制作可以通过溶胶-凝胶法将生物分子包埋在一些特定基质中实现。首先用喷墨打印的方法在纸上喷涂载有材料的溶胶-凝胶,然后在溶膠-凝胶中形成二氧化硅的底物层,最后通过硅层作为媒介将材料附着在纸纤维上[36]。此外,还可用溶胶-凝胶法制成二氧化硅包裹的活性酶和金纳米粒子,并在此溶胶-凝胶溶液中浸泡纸,从而形成修饰层[37]。Wang等[38]在聚合物(聚精氨酸)和二氧化硅层之间包埋一种酶,多层的包埋可以保证纸纤维修饰的稳定性和酶的活性。
静电吸附法、共价键修饰法和包埋法3种方法结合使用也有相关报道。众多简便可靠、性能优异的纸基表面改性方法,为实现在纸基平台上构建各种分析方法奠定了坚实的基础[26]。
3 纸基分析传感方法
3.1 比色分析法
比色分析法是纸基分析中使用最广泛的技术之一,具有结果直观、检测效率高、操作简单、稳定性好等优点,显色试纸也最早被应用于食品检测领域[39]。纸基平台的比色分析过程通常是样品溶液在毛细作用下进样到测试区,然后与显色试剂发生反应,产生颜色变化[40]。比色测定通过判断颜色形成或颜色变化进行目标物的定性和定量分析,其颜色信号的采集主要有两种方式:(1)使用单镜头反射式照相机、手机或低成本的台式扫描仪直接成像,结合MATLAB或Image J等软件进行定量分析[41]; (2)采用分光光度计检测显色区域在特定波长处的吸光度,这种检测技术提供的定量结果更准确[42]。
Jiang等[43]使用金纳米颗粒作为显色指示剂,将比色免疫测定法结合到纸基微流控装置中,开发了一种低成本的快速检测食品和饲料中的霉菌毒素脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)的纸基微流控芯片(DON-Chip),如图1所示,提出了一种有效提高分析性能的新型比例分析方法,成功实现了粮食饲料或饲料成分提取物中的DON的检测,检测范围为0.01~20 mg/kg (ppm),检出限为4.35 μg/kg (ppb),检测时间少于12 min。
Mooltongchun等[44]将纸芯片与生物传感器技术相结合,提出了一种快速、选择性、低成本的纸基比色分析方法检测肉类样品中的次黄嘌呤。该纸基比色生物传感器以双酶催化反应为基础,黄嘌呤氧化酶催化黄嘌呤生成H2O2; 然后在辣根过氧化物酶存在的情况下,H2O2对与邻二苯胺反应产生棕色产物,最终用扫描仪对纸上检测区域的颜色强度进行成像采集。该纸基传感器可在5 min内完成对肉类的检测,检测限为1.8 mg/L,定量限为6.1 mg/L。Trofimchuk等[45]开发了一种微流控纸芯片比色分析装置,通过亚硝酸盐和添加的Griess试剂反应显色确定亚硝酸盐浓度,同时利用咖啡环效应提高灵敏度,在15 min内完成肉类亚硝酸盐含量的检测,检出限为1.1 mg/kg。Wang等[46]研制了一种用于快速筛查鸡蛋、鸡肉和饲料样品中妥曲珠利(Toltrazuil, TOL)及其代谢物的比色纸基传感器,使用条带扫描仪获得定量结果,15 min内即可实现实际样品中TOL及其代谢物的快速检测,检出限低于2.60 μg/kg。
比色检测多需引入液体显色剂,因此在纸基平台构建各种类型溶液的亲疏水区域尤为重要,但普通蜡印法具有局限性。Lin等[47]报道了一种简单、廉价且环境友好的微流纸芯片制造策略,通过紫外线固化水性聚氨酯丙烯酸酯阻碍表面活性剂溶液和有机溶剂的渗透,可快速检测自水中的大肠杆菌,检测范围为104~109 cfu/mL。
3.2 电化学分析法
电化学分析方法具有成本低、操作简单、选择性高、灵敏度高、功耗低、仪器简单和便携性好等特点,非常适合构建微流控纸芯片平台,即纸基电化学分析装置(Paper-based electrochemical devices, PEDs 或 Electrochemical paper-based analysis device, ePADs)[48]。电化学传感器三电极系统由工作电极、参比电极和对电极组成,工作电极和对电极在电解液中形成电流通路,根据电化学信号实现样品检测[49]。用碳浆料和Ag/AgCl浆料可以很容易地在纸基上构建电极[50]。目前,在纸芯片上构建电化学系统的种类有微电极、表面修饰电极、流动注射法、信号放大系统、离子选择电极和离子交换膜等,电化学分析技术包括伏安法和电位法[51]。
Cinti等[52]报道了用于检测啤酒中乙醇的纸基丝网印刷电极生物传感装置,该装置用普通办公用纸制作而成,以炭黑和普鲁士蓝纳米颗粒形成的纳米复合材料作为催化剂,通过检测乙醇氧化酶催化氧化乙醇生成的H2O2,采用计时电流法实现啤酒中乙醇含量的检测,检出限为0.52 mmol/L(0.003%, V/V)。采用电化学技术可对食品亚硝酸盐进行检测,然而传统的电化学传感器因电极表面吸附氧化产物易受到污染,而一次性使用的纸基平台可以克服上述问题。Wang等[53]开发了一次性纸基电化学传感平台,利用石墨烯纳米薄片和金纳米颗粒的独特物理化学性质,实现了亚硝酸盐的灵敏检测。Guadarrama-Fernández等[54]研制了一种用于检测饮料中葡萄糖含量的新型纸基生物电化学传感器,以铂纸为工作电极载体,以含有葡萄糖氧化酶的聚乙烯醇和壳聚糖混合物生物相容性高分子膜为识别层,采用电位检测法快速检测橙汁中的葡萄糖含量,检测灵敏度为(Symbolm@@119.6±6.4) mV/dec,检测范围为0.03~1.0 mmol/L, 检出限为0.02 mmol/L。
食源性致病菌可造成严重的疾病暴发, 然而常用的大多数生物检测试剂昂贵。Bhardwaj等[55]使用抗体(Ab)与单壁碳纳米管(Single-walled carbon nanotube, SWCNT)的偶联物(Ab-SWCNT)开发了一种快速、低成本的纸基电化学免疫传感器,用于金黄色葡萄球菌的免标记检测。将Ab-SWCNT固定在工作电极上,采用差分脉冲伏安法可在30 min内对牛奶中的金黄色葡糖球菌进行快速检测,检出限为13 CFU/mL。Silva等[56]报道了用于无标记检测沙门氏伤寒杆菌的新型纸基电位免疫传感平台,采用了两种不同的免疫传感组装方式(依赖于抗体与聚合物膜的直接结合和依赖于中间的聚酰胺树状分子层),并比较了两种方式的分析性能,发现修饰后的电极噪声更小,对苹果汁中的沙门氏伤寒杆菌检测限为5 cell/mL,检测时间少于1 h。
与化学发光法相比,电化学发光检测可通过控制电信号的开关实现,因此电化学发光分析法应用于纸基分析平台极具吸引力。Chinnadayyala等[57]利用雙极电极实现基于纸基平台的电化学发光检测,双极电极不需要直接连接外部电源,因此有利于检测设备的小型化和多路检测。Liu等[58]研制了一种基于纸基双极电极的电化学发光分析检测装置用于致病菌的识别,通过在纸基上蜡印形成的亲水通道上构建碳墨的双极电极和驱动电极,使用[Ru-(phen)2dppz]2+作为报告分子,能够检测低至10 copies/μL的单核细胞增生李斯特菌的基因组DNA,具有较高的选择性。
3.3 荧光分析法
荧光分析法中,高效可靠的捕获荧光发射信号是设计纸基分析装置的关键。近年来,纸基装置结合荧光分析法已被用于检测细菌、蛋白质、生物标志物和重金属等[59~61]。纸基荧光检测可同时用于定性/定量分析,通常有较宽的检测范围; 操作过程简易; 荧光检测重复性好,需要的样品量少,荧光检测仪器简单[62]。荧光传感的方式主要有两种:一种是目标物本身发荧光,可通过检测目标物本身的荧光强度直接确定其浓度[62]; 另外一种是目标物本身没有荧光特性,可通过与荧光探针发生作用,根据荧光探针的荧光信号的变化,检测目标物质。外源性物质与荧光探针的作用机理主要有静态荧光猝灭、动态荧光猝灭、荧光共振能量转移、光致电子转移和荧光内滤效应[25]。这些作用机理被应用于构建纸基荧光传感方法,并应用到食品安全的快速检测中。
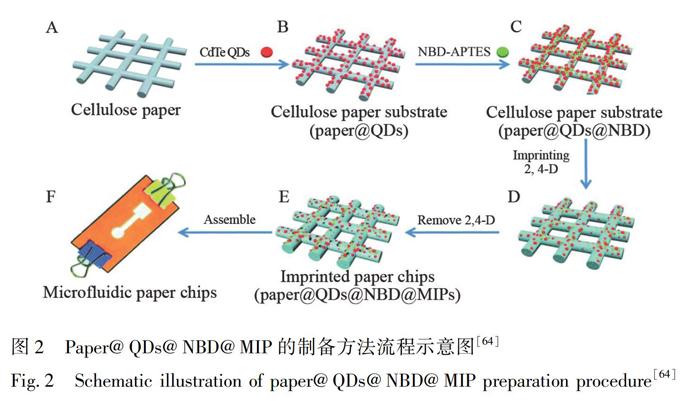
农药残留的快速检测一直是一个挑战。Zhang等[63]通过电子转移诱导荧光猝灭机制,开发了一种新型分子印迹荧光传感微流控纸芯片,实现了农药2,4-二氯苯氧乙酸(2,4-D)的特异性识别和灵敏检测。首先将荧光CdTe量子点(QDs)修饰到纸上,进一步在荧光纸基质上合成分子印迹聚合物(Paper@QDs@MIPs), 18 min内即可对豆芽表面残留的2,4-D进行快速分析,检出限为90 nmol/L。进一步通过硝基苯并恶二唑和QDs的荧光共振能量转移构建比率荧光纸芯片(图2),实现了豆芽和湖水中2,4-D残留的快速、选择性比色检测[64]。
甲醛是一种常见的食品添加剂,过量摄入会对人体健康产生不良影响。Guzman等[65]研发了一种由纸基分析装置和便携式检测系统组成的低浓度甲醛检测平台。该平台可通过互补性氧化金属半导体摄像机观察甲醛与醋酸铵/乙酰乙酰苯胺反应得到的二氢吡啶衍生物的荧光,然后将彩色图像传输到智能手机上,利用RGB色彩分析软件计算甲醛浓度。该方法用于快速检测商业食品的甲醛含量,检测时间仅需10 min。
过氧化苯甲酰是一种高活性氧化剂,因其良好的氧化漂白性能而被广泛用作小麦粉的食品添加剂。Hu等[66]制备了一种基于香豆素的分子荧光探针,并将其与纸基分析平台结合用于过氧化苯甲酰的快速检测,在0~70 μmol/L范围内呈现较好的可视化检测效果,可在10 min内实现小麦粉、饺子面粉和面条中的过氧化苯甲酰检测。针对动物食品中抗生素的快速检测,Zong等[67]报道了一种纸基荧光免疫分析法,以量子点标记的诺氟沙星单克隆抗体作为探针,可实现水和牛奶中诺氟沙星的高灵敏、选择性检测,检出限分别为1和10 pg/mL。
3.4 SERS分析法
目前已报道的SERS传感分析方法主要使用纳米颗粒为SERS基底,如银纳米颗粒、金纳米棒和金纳米球等,可以显著增强(104~1012倍)目标分析物的拉曼散射信号 [68]。含有苯环的共振分子结构、含有胺或硫醇官能团的分子,能够迅速附着在金纳米颗粒上,并获得最佳的效果[69]。纸材料由于具有三维的纤维基质,表现出更好的SERS增强效果; 但是,由于纸纤维的各向异性和非均匀结构,导致纳米粒子的不均匀吸附和等离子体热点的随机形成和分布,且拉曼信号只在5 μm左右的激光光斑区域采集,信号的重现性是纸基SERS传感面临的主要挑战[70]。纳米粒子修饰方法的发展,有助于纳米粒子在纸上的均匀分布从而提升灵敏度[71]。
2013年,Li等[72]采用喷雾方法构建SERS传感的纸基芯片。该方法将高灵敏度的SERS纳米银粒子沉积在纸基平台上,制备过程快速、可靠, 并且不需要特殊的仪器,建立的检测方法具有良好的灵敏度和重现性。除喷涂法外,Ma等[73]利用丝网印刷技术在纤维素纸上固定了纳米银和氧化石墨烯,建立了超灵敏的SERS方法,可用于现场检测农药残留,对果蔬表面的福美双、噻菌灵和甲基对硫磷的检出限分别为0.26、28 和7.4 ng/cm2。
甲基对硫磷等农药通常具有独特的拉曼特征峰,因此可采用SERS法快速检出。Xie等[74]采用种子介导生长法合成金纳米粒子,然后用浸渍法组装到滤纸上,采用结合便携式拉曼光谱仪检测甲基对硫磷的检测限为0.011 μg/cm2。Zhang等[75]报道了一种基于Ag NPs功能化的纸基疏水性SERS基底平台。这种新型的SERS纸基平台不仅制备简单、可重复使用且可大规模制备的要求,而且可实现液滴检测。该方法用于检测稀释牛奶中的三聚氰胺,检测时间仅10 s,检测限为1 mg/kg(ppm),线性范围为1~1000 mg/kg(ppm)。分子印迹聚合物功能化的SERS传感纸基平台也有报道[76],如图3所示,该纸基传感系统由三维树突状银晶体、分子印迹聚合物层与纳米银层多层偶合形成,可灵敏性检测烟碱类杀虫剂,检测时间仅需150 s。该方法检测蔬菜表面提取物中烟碱类杀虫剂的结果与液相色谱-质谱联用方法的结果一致。
3.5 纸基平台的多种分析方法联用
基本的纸基微流控的功能是毛细动力矢量运输液体与分流特性,可以自动将流体导向多个不同区域。例如构建纸基阀门,通过切断和连接不同的区域实现控制流体通断[77, 78]。纸基平台上的操作方式可支撑多种分析方法联用的实现。多分析方法的联用,使纸芯片在满足快速检测的基础上降低假阳性、提高特异性和灵敏度[17]。多种分析方法在纸芯片平台上展现出快速、便捷、高效的性能,在食品安全快速检测中展现了强大的活力。
Li等在纸芯片上实现了比色、荧光、SERS多种分析方法结合的高选择性和高灵敏检测亚硝酸盐[79]。Adkins等[80]开发了基于透明胶片的电化学分析和纸基比色分析相结合的检测平台,用于食品和水中大肠杆菌和肠球菌代谢物的快速分析检测。Li等[81]提出了一种SO2比色/SERS双模式传感策略,将顶空采样与纸基分析装置结合,用于葡萄酒中SO2的测定,检测结果与传统的Monier-Williams方法相吻合。荧光和比色法结合的双通道检测是比较常见的选择,如图4所示,Wang等[82]建立了一种简单、快速的智能荧光比色双模式纸基传感系统,利用Cu2+氧化邻苯二胺(OPD)法测定大肠杆菌,可通过智能手机颜色扫描应用程序定量检测。该研究为大肠杆菌的快速检测提供了有效的双模式方法,具有较强的实用价值。Erdemir等[83]研究了纸基比色和荧光双模式检测水和食品中的氰化物离子,制备的分子荧光探针表现出选择性的荧光变化,并且可以产生裸眼可见的颜色变化,可通过智能手机直接读出颜色值,检出限达0.45 μmol/L。
4 总结与展望
本文从纸基表面功能化改性及分析传感方法出发,综述了基于纸基分析平台的食品安全快速检测方法的研究进展。纸基表面修饰技术的发展推动了各种分析方法在纸基平台上的成功构建,纸基平台上以光学与电化学传感信号为主的分析方法已经被广泛研究。在纸基平台上构建多种分析方法在提升食品安全检测效率的同时,也逐渐从定性分析发展到半定量和定量分析,以及高灵敏、高选择性检测。食品样品的前处理过程和食品快检标准化的实现是纸基分析平台面临的挑战。纸基平台在食品安全检测方面将向着多功能化、与移动设备结合的“一站式”快速检测方向发展,随着纸基传感技术的不断成熟和完善,有望实现产业化应用,在食品安全即时快速检测方面发挥重要的作用。
References
1 Unnevehr L. Glob. Food Secur. Agric. Policy, 2015, 4: 24-29
2 Hamburg M A. Science, 2011, 331(6020): 987-987
3 Hua M Z, Li S M, Wang S, Lu X N. Micromachines, 2018, 9(1): 32
4 Hermann C A, Duerkop A, Baeumner A J. Anal. Chem., 2019, 91(1): 569-587
5 Wang S Q, Chen H T, Sun B G. Food Chem., 2020, 315: 126158
6 Naczk M, Shahidi F. J. Chromatogr. A, 2004, 1054(1-2): 95-111
7 Kataoka H, Lord H L, Pawliszyn J. J. Chromatogr. A, 2000, 880(1-2): 35-62
8 Bronzi B, Brilli C, Beone G M, Fontanella M C, Ballabio D, Todeschini R, Consonni V, Grisoni F, Parri F, Buscema M. Food Chem., 2020, 315: 126248
9 Wang X, Wang S J, Cai Z W. TrAC-Trends Anal. Chem., 2013, 52: 170-185
10 Liu G, Su W, Xu Q, Long M, Zhou J, Song S. Food Control, 2004, 15(4): 303-306
11 Salihah N T, Hossain M M, Lubis H, Ahmed M U. J. Food Sci. Technol.-Mysore, 2016, 53(5): 2196-2209
12 De Medici D, Kuchta T, Knutsson R, Angelov A, Auricchio B, Barbanera M, Diaz-Amigo C, Fiore A, Kudirkiene E, Hohl A, Tomic D H, Gotcheva V, Popping B, Prukner-Radovcic E, Scaramaglia S, Siekel P, To K A, Wagner M. Food Anal. Meth., 2015, 8(2): 255-271
13 YANG Hai, WANG Ye-Hong, MAO Xiang. Environ. Sci. and Technol., 2017, 40(10): 98-105
楊 海, 汪业红, 毛 翔. 环境科学与技术, 2017, 40(10): 98-105
14 Krska R, Molinelli A. Anal. Bioanal. Chem., 2009, 393(1): 67-71
15 Yetisen A K, Akram M S, Lowe C R. Lab Chip, 2013, 13(12): 2210-2251
16 Yamada K, Henares T G, Suzuki K, Citterio D. Angew. Chem. Int. Ed., 2015, 54(18): 5294-5310
17 Salentijn G I J, Grajewski M, Verpoorte E. Anal. Chem., 2018, 90(23): 13815-13825
18 Martinez A W, Phillips S T, Butte M J, Whitesides G M. Angew. Chem. Int. Ed., 2007, 46(8): 1318-1320
19 Gong M M, Sinton D. Chem. Rev., 2017, 117(12): 8447-8480
20 Lopez-Ruiz N, Curto V F, Erenas M M, Benito-Lopez F, Diamond D, Palma A J, Capitan-Vallvey L F. Anal. Chem., 2014, 86(19): 9554-9562
21 Kaneta T, Alahmad W, Varanusupakul P. Appl. Spectrosc. Rev., 2019, 54(2): 117-141
22 Carrilho E, Martinez A W, Whitesides G M. Anal. Chem., 2009, 81(16): 7091-7095
23 Nie Z H, Nijhuis C A, Gong J L, Chen X, Kumachev A, Martinez A W, Narovlyansky M, Whitesides G M. Lab Chip, 2010, 10(4): 477-483
24 Mahadeva S K, Walus K, Stoeber B. ACS Appl. Mater. Interfaces, 2015, 7(16): 8345-8362
25 Ju Q, Noor M O, Krull U J. Analyst, 2016, 141(10): 2838-2860
26 Ahmed S, Bui M P N, Abbas A. Biosens. Bioelectron., 2016, 77: 249-263
27 Li H, Fu S Y, Peng L C, Zhan H Y. Cellulose, 2012, 19(2): 533-546
28 Khatri V, Halasz K, Trandafilovic L V, Dimitrijevic-Brankovic S, Mohanty P, Djokovic V, Csoka L. Carbohydr. Polym., 2014, 109: 139-147
29 Elsharkawy M, Schutzius T M, Megaridis C M. Lab Chip, 2014, 14(6): 1168-1175
30 Credou J, Berthelot T. J. Mater. Chem. B, 2014, 2(30): 4767-4788
31 Karra-Chaabounia M, Bouaziz I, Boufi S, do Rego A M B, Gargouri Y. Colloid Surf. B, 2008, 66(2): 168-177
32 Ibrahim M M, Koschella A, Kadry G, Heinze T. Carbohydr. Polym., 2013, 95(1): 414-420
33 Tyagi C, Tomar L K, Singh H. J. Appl. Polym. Sci., 2009, 111(3): 1381-1390
34 Isaad J, El Achari A. Tetrahedron, 2011, 67(26): 4939-4947
35 Geffroy C, Labeau M P, Wong K, Cabane B, Stuart M A C. Colloid Surf. A, 2000, 172(1-3): 47-56
36 Hossain S M Z, Brennan J D. Anal. Chem., 2011, 83(22): 8772-8778
37 Luckham R E, Brennan J D. Analyst, 2010, 135(8): 2028-2035
38 Wang J Y, Bowie D, Zhang X, Filipe C, Pelton R, Brennan J D. Chem. Mater., 2014, 26(5): 1941-1947
39 Ellerbee A K, Phillips S T, Siegel A C, Mirica K A, Martinez A W, Striehl P, Jain N, Prentiss M, Whitesides G M. Anal. Chem., 2009, 81(20): 8447-8452
40 Sun X G, Li B W, Qi A J, Tian C G, Han J L, Shi Y J, Lin B C, Chen L X. Talanta, 2018, 178: 426-431
41 Kong T, You J B, Zhang B, Nguyen B, Tarlan F, Jarvi K, Sinton D. Lab Chip, 2019, 19(11): 1991-1999
42 Morbioli G G, Mazzu-Nascimento T, Stockton A M, Carrilho E. Anal. Chim. Acta, 2017, 970: 1-22
43 Jiang Q, Wu J D, Yao K, Yin Y L, Gong M M, Yang C B, Lin F. ACS Sens., 2019, 4(11): 3072-3079
44 Mooltongchun M, Teepoo S. Food Anal. Meth., 2019, 12(12): 2690-2698
45 Trofimchuk E, Hu Y, Nilghaz A, Hua M Z, Sun S, Lu X. Food Chem., 2020, 316: 126396
46 Wang Z X, Zhang J, Liu L Q, Wu X L, Kuang H, Xu C L, Xu L G. Food Chem., 2019, 276: 707-713
47 Lin D, Li B W, Qi J, Ji X F, Yang S X, Wang W H, Chen L X. Sens. Actuators B, 2020, 303: 127213
48 Liu B W, Du D, Hua X, Yu X Y, Lin Y H. Electroanalysis, 2014, 26(6): 1214-1223
49 Lan W J, Maxwell E J, Parolo C, Bwambok D K, Subramaniam A B, Whitesides G M. Lab Chip, 2013, 13(20): 4103-4108
50 Arduini F, Cinti S, Caratelli V, Amendola L, Palleschi G, Moscone D. Biosens. Bioelectron., 2019, 126: 346-354
51 Paschoalino W J, Kogikoski S, Barragan J T C, Giarola J F, Cantelli L, Rabelo T M, Pessanha T M, Kubota L T. ChemElectroChem, 2019, 6(1): 10-30
52 Cinti S, Basso M, Moscone D, Arduini F. Anal. Chim. Acta, 2017, 960: 123-130
53 Wang P, Wang M Y, Zhou F Y, Yang G H, Qu L L, Miao X M. Electrochem. Commun., 2017, 81: 74-78
54 Guadarrama-Fernandez L, Novell M, Blondeau P, Andrade F J. Food Chem., 2018, 265: 64-69
55 Bhardwaj J, Devarakonda S, Kumar S, Jang J. Sens. Actuators B, 2017, 253: 115-123
56 Silva N F D, Almeida C M R, Magalhaes J, Goncalves M P, Freire C, Delerue-Matos C. Biosens. Bioelectron., 2019, 141: 111317
57 Chinnadayyala S R, Park J, Le H T N, Santhosh M, Kadam A N, Cho S. Biosens. Bioelectron., 2019, 126: 68-81
58 Liu H X, Zhou X M, Liu W P, Yang X K, Xing D. Anal. Chem., 2016, 88(20): 10191-10197
59 Wu M R, Lai Q Y, Ju Q, Li L, Yu H D, Huang W. Biosens. Bioelectron., 2018, 102: 256-266
60 Fu L M, Wang Y N. TrAC-Trends Anal. Chem., 2018, 107: 196-211
61 Lin Y, Gritsenko D, Feng S L, Teh Y C, Lu X N, Xu J. Biosens. Bioelectron., 2016, 83: 256-266
62 Ulep T H, Yoon J Y. Nano Converg., 2018, 5: 14
63 Zhang Z, Ma X, Jia M F, Li B W, Rong J H, Yang X B. Analyst, 2019, 144(4): 1282-1291
64 Zhang Z, Ma X, Li B, Zhao J, Qi J, Hao G, Jianhui R, Yang X. Analyst, 2020, 145(3): 963-974
65 Guzman J, Tayo L L, Liu C C, Wang Y N, Fu L M. Sens. Actuator B, 2018, 255: 3623-3629
66 Hu Q, Li W, Qin C Q, Zeng L T, Hou J T. J. Agric. Food Chem., 2018, 66(41): 10913-10920
67 Zong L J, Jiao Y C, Guo X Y, Zhu C X, Gao L, Han Y F, Li L, Zhang C W, Liu Z P, Liu J H, Ju Q, Yu H D, Huang W. Talanta, 2019, 195: 333-338
68 Wang Y Q, Yan B, Chen L X. Chem. Rev., 2013, 113(3): 1391-1428
69 Zong C, Xu M X, Xu L J, Wei T, Ma X, Zheng X S, Hu R, Ren B. Chem. Rev., 2018, 118(10): 4946-4980
70 LI Bo-Wei, CHEN Ling-Xin. Journal of Instrumental Analysis, 2015, 34(3): 302-307
李博伟, 陈令新. 分析测试学报, 2015, 34(3): 302-307
71 Kumar A, Santhanam V. Anal. Chim. Acta, 2019, 1090: 106-113
72 Li B W, Zhang W, Chen L X, Lin B C. Electrophoresis, 2013, 34(15): 2162-2168
73 Ma Y D, Wang Y H, Luo Y, Duan H Z, Li D, Xu H, Fodjo E K. Anal. Methods, 2018, 10(38): 4655-4664
74 Xie J, Li L, Khan I M, Wang Z, Ma X. Spectrosc. Acta A, 2020, 231: 118104
75 Zhang C M, You T T, Yang N, Gao Y K, Jiang L, Yin P G. Food Chem., 2019, 287: 363-368
76 Zhao P N, Liu H Y, Zhang L N, Zhu P H, Ge S G, Yu J H. ACS Appl. Mater. Interfaces, 2020, 12(7): 8845-8854
77 Li B W, Yu L J, Qi J, Fu L W, Zhang P Q, Chen L X. Anal. Chem., 2017, 89(11): 5708-5713
78 Han J L, Qi A J, Zhou J R, Wang G, Li B W, Chen L X. ACS Sens., 2018, 3(9): 1789-1794
79 Li D, Ma Y D, Duan H Z, Deng W, Li D W. Biosens. Bioelectron., 2018, 99: 389-398
80 Adkins J A, Boehle K, Friend C, Chamberlain B, Bisha B, Henry C S. Anal. Chem., 2017, 89(6): 3613-3621
81 Li D, Duan H Z, Ma Y D, Deng W. Anal. Chem., 2018, 90(9): 5719-5727
82 Wang C, Gao X, Wang S, Liu Y. Anal. Bioanal. Chem., 2020, 412(3): 611-620
83 Erdemir S, Malkondu S. Talanta, 2020, 207: 120278
Progress in Rapid Detection Techniques Using
Paper-based Platforms for Food Safety
QI Ji1,2, FAN Xin-Xia2, DENG Dong-Mei*1, HE Hai-Bo2, LUO Li-Qiang*1,2
1(Department of Physics, Shanghai Key Laboratory of High Temperature Superconductors,
Colloge of Sciences, Shanghai University, Shanghai 200444, China)
2(Department of Chemistry, College of Sciences, Shanghai University, Shanghai 200444, China)
Abstract Food safety has always been one of the most important issues for human being. With the variety of food, it is required to develop rapid, low-cost and convenient detection techniques for food safety. As a representative, paper-based detection techniques have developed rapidly from simple test papers to various microfluidic paper-based devices. The paper-based analytical devices combining paper platform with a variety of advanced analysis methods have shown great application prospects for rapid food safety testing. In this review, the surface functionalization and modification of paper are introduced. Then, the construction and development of various detection techniques are discussed, including colorimetric analysis, fluorescent analysis, electrochemical analysis, surface enhanced Raman spectroscopic analysis, and multimethods on paper-based platforms for the application in rapid food safety detection. Finally, the prospects and future challenges of rapid detection techniques in food safety are also discussed.
Keywords Paper-based analysis device; Food safety; Rapid detection; Colorimetric analysis; Fluorescent analysis; Surface enhanced Raman spectroscopic analysis; Electrochemical analysis; Review
(Received 31 March 2020; accepted 19 August 2020)
This work was supported by the National Natural Science Foundation of China (Nos. 21974085, 61571280, 61971274).
2020-03-31收稿; 2020-08-19接受
本文系國家自然科学基金项目(Nos. 21974085, 61571280, 61971274)资助
* E-mail: dmdeng@shu.edu.cn; luck@shu.edu.cn

