非小细胞肺癌中p-mTOR、Beclin1及Atg1蛋白表达及其临床意义
张秀义 许浩然 孙亚东
细胞周期调控基因突变导致细胞正常增殖调节失控及抗凋亡功能异常亢进是发生肿瘤的重要原因,细胞自噬(autophagy)是与细胞凋亡相似的生物学过程,是细胞内折叠错误、老化的蛋白质及受损、失去作用的细胞器在溶酶体内降解的过程[1]。现代研究显示自噬作为一种细胞内大分子物质的降解通路,对细胞生存起多种作用。磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin, PI3K/Akt/mTOR)信号通路是重要的自噬信号调节通路,磷酸化的mTOR(p-mTOR)是通路活化的生物学标志[2]。自噬相关基因Beclinl是自噬过程中最重要的正调节因子,主要诱导自噬的启动[3]。自噬相关蛋白Atg(autophagy related gene)在自噬不同阶段发挥不同的作用,Atg1是诱导自噬通路启动阶段最关键、最直接的蛋白质,受mTOR的调控,诱导自噬的下游信号[4]。既往研究显示p-mTOR、Beclin1及Atg1通过调节细胞自噬活性,在多种肿瘤发生、发展过程中起重要作用。肺癌是目前中国病死率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的绝大多数,探讨三者在NSCLC中表达及相关性的研究较少,本研究应用免疫组化方法测定p-mTOR、Beclin1及Atg1蛋白在非小细胞肺癌的表达水平,分析其表达与临床病理特征是否存在相关性,探讨细胞自噬在NSCLC发病中的作用机制。
资料与方法
一、一般资料
收集承德市中心医院心胸外科于2017年3月到2018年3月行外科手术治疗的NSCLC病例 96例(患者术前均未进行化疗、放疗及其他抗肿瘤治疗,所有病例资料均真实、完整),其中女性34例,男性62例,年龄48~75岁,平均年龄61.4岁。手术切除标本证实有鳞状细胞癌病例50例,腺癌病例46例;低中分化癌病例58例,高分化癌病例38例;无周围淋巴结转移病例56例,存在周围淋巴结转移病例40例。NSCLC多发生于支气管粘膜上皮及肺泡上皮,本实验设正常支气管和肺泡双正常对照组,标本取自肺癌同侧远端距离肿块3~5 cm的支气管及肺泡正常组织,其中支气管粘膜标本60例,肺泡标本64例。本研究获得我院医学伦理委员会批准,病理切片经病理科医师诊断证实。
二、检验方法
1. 主要试剂: 兔抗人p-mTOR、Beclin1及Atg1单克隆抗体购自美国Cell Signaling Technology公司,免疫组化试剂盒及DAB试剂盒购自丹麦 Dako公司。
2. 常规组织学处理: 组织标本经福尔马林溶液浸泡、固定,石蜡包埋、切片,HE染色。根据2004 版WHO肺癌组织学分类标准判定肿瘤组织学分类,根据患者临床资料确定临床病理特征。
3. 免疫组织化学检测: 采用SP免疫组织化学法染色,DAB显色,应用已知p-mTOR、Beclin1及Atg1蛋白为阳性的组织切片作阳性对照,采用PBS液代替一抗为阴性对照。
4. 结果判定: 采用光学显微镜双盲法观察染色后切片,p-mTOR、Beclin1及Atg1蛋白均为细胞质染色,每张切片随机选取5个400倍视野,其中阳性结果判定以细胞着色强度及着色细胞数占观察细胞总数百分比综合判定,百分比取平均值:<5%判定为0分,6~25%判定为1分,26~50%判定为2分,≥51%判定为3分。着色强度:不着色判定为0分,浅黄色判定为1分,棕黄色为2分,黄褐色判定为3分。上述两项得分相加,≤3分判定为阴性结果,>3分判定为阳性结果。
三、统计学方法
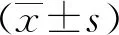
结 果
一、Beclinl蛋白表达水平组间比较
Beclinl蛋白在NSCLC中表达阳性率为31.25%(30/96),如图1A-D,肺泡及支气管表达阳性率分别为75.0%(48/64)、66.67%(40/60),Beclinl蛋白在NSCLC中表达水平显著低于对照组(χ2=29.418、18.723,P<0.01)。Beclinl蛋白在肺鳞癌中阳性表达率为32.0%(16/50),显著低于对照组(χ2=21.079、13.115,P<0.01)。Beclinl蛋白在肺腺癌中表达阳性率为30.43%(14/46),显著低于对照组(χ2=21.612、13.677,P<0.01)。Beclinl蛋白在对照组之间表达差异无统计学意义(χ2=1.044,P=0.307)。
二、p-mTOR蛋白表达水平组间比较
p-mTOR蛋白在NSCLC中表达阳性率为66.67%(64/96),肺泡及支气管黏膜表达阳性率分别为10.94%(7/64)、18.33%(11/60),p-mTOR蛋白在NSCLC表达水平显著高于对照组(χ2=48.316、34.554,P<0.01)。p-mTOR蛋白在肺鳞癌中表达阳性率为72.0%(36/50),显著高于对照组(χ2=44.553、32.099,P<0.01)。p-mTOR蛋白在肺腺癌中表达阳性率为60.87%(28/46),显著高于对照组(χ2=30.758、20.258,P<0.01)。p-mTOR蛋白在对照组之间表达差异无统计学意义(χ2=1.365,P=0.243)。
三、Atg1蛋白表达水平组间比较
Atg1蛋白在NSCLC中表达阳性率为26.04%(25/96),如图2A-D,肺泡及支气管黏膜表达阳性率分别为81.25%(52/64)、80.0%(48/60),Atg1蛋白在NSCLC表达水平显著低于对照组(χ2=46.883、43.178,P<0.01)。Atg1蛋白在肺鳞癌中表达阳性率为26.0%(13/50),显著高于对照组(χ2=34.963、32.194,P<0.01)。Atg1蛋白在肺腺癌中表达阳性率为26.09%(12/46),显著高于对照组(χ2=33.473、30.81,P<0.01)。Atg1蛋白在对照组之间表达差异无统计学意义(χ2=0.031,P=0.86)。
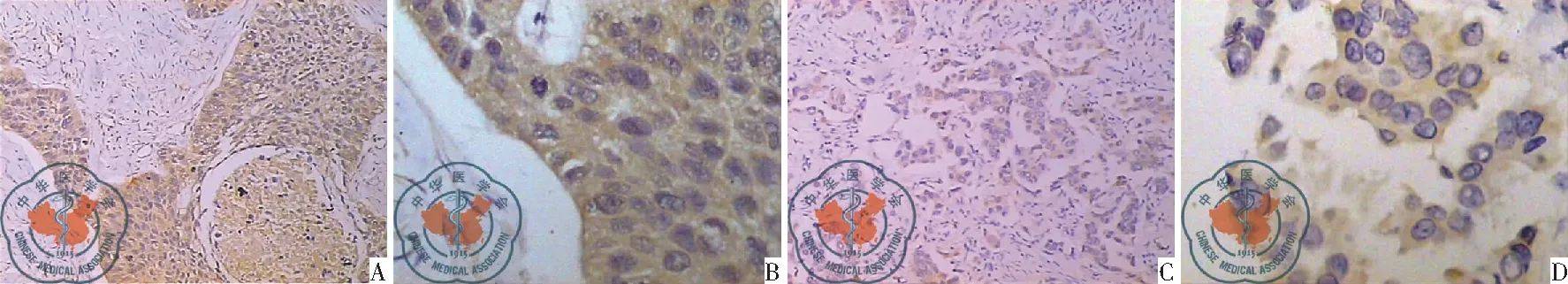
图1 Beclinl蛋白水平在肺鳞癌、肺腺癌中的表达;注:A:肺鳞癌Beclinl蛋白阳性(HE染色 SP×100);B:肺鳞癌Beclinl蛋白阳性(HE染色 SP×400);C:肺腺癌Beclinl蛋白阳性(HE染色 SP×100);D:肺腺癌Beclinl蛋白阳性(HE染色 SP×400)

图2 Atg1蛋白在肺鳞癌、肺腺癌中的表达;注:A:肺鳞癌Atg1蛋白阳性(HE染色 SP×100);B:肺鳞癌Atg1蛋白阳性(HE染色 SP×400);C:肺腺癌Atg1蛋白阳性(HE染色 SP×100);D:肺腺癌Atg1蛋白阳性(HE染色 SP×400)
四、Beclinl蛋白表达水平与肿瘤直径、分化程度及淋巴结转移相关性分析
NSCLC中Beclinl蛋白表达水平与肿瘤直径、分化程度及淋巴结转移显著相关,随着肿瘤体积增大、分化程度下降及出现淋巴结转移,Beclin1蛋白表达水平呈现下降趋势,见表1。
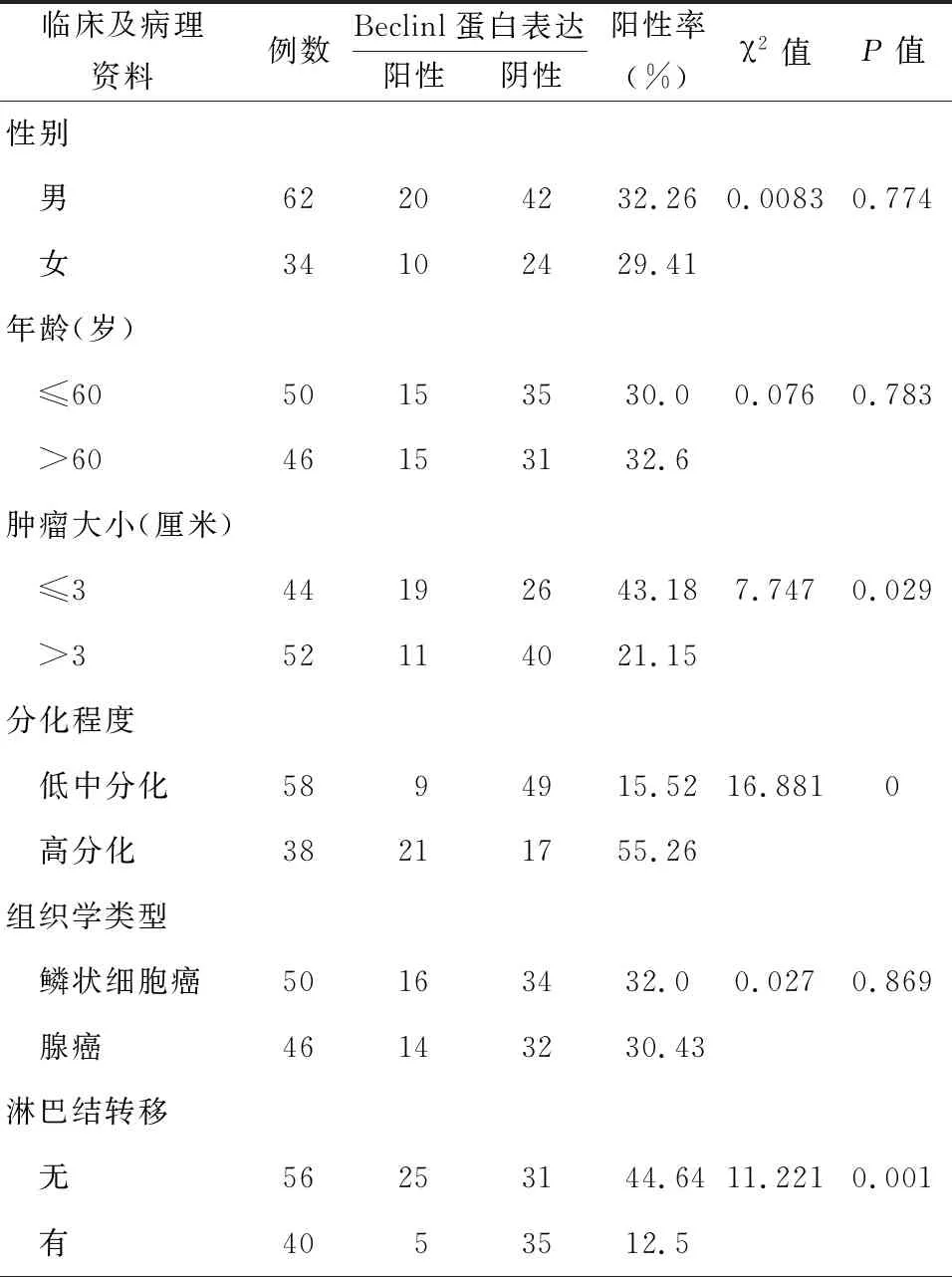
表1 非小细胞肺癌中Beclinl表达水平与临床病理特征的关系
五、p-mTOR蛋白表达水平、肿瘤分化程度与淋巴结转移的相关性分析
随着肿瘤分化程度下降及出现淋巴结转移,p-mTOR蛋白表达水平呈升高趋势,见表2。
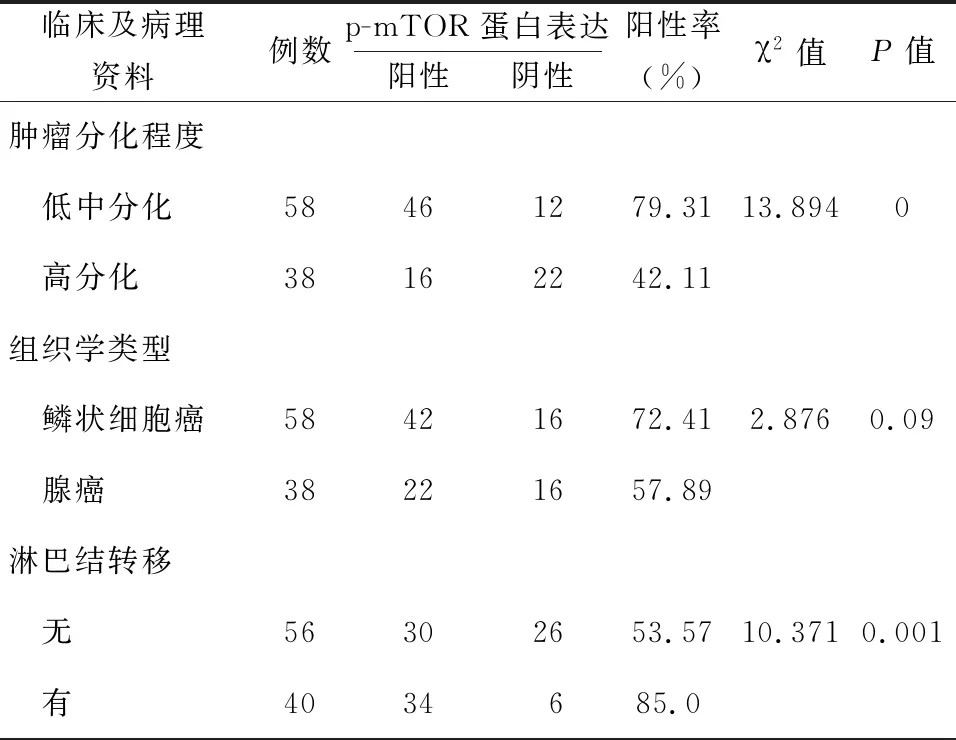
表2 非小细胞肺癌中p-mTOR表达水平与临床病理特征的关系
六、NSCLC中Atg1蛋白表达水平与肿瘤直径、淋巴结转移的相关性分析
随着肿瘤体积增大及出现淋巴结转移,Atg1蛋白表达水平呈现下降趋势,见表3。NSCLC组织中Beclin1、Atg1蛋白表达水平正性相关,p-mTOR与Beclin1及与Atg1表达水平均呈负性相关。
讨 论
细胞自噬是细胞器和大分子物质降解的细胞程序性、非凋亡性死亡,通过降解自然衰老及因环境压力受损的细胞器及长寿命、合成或折叠错误的蛋白质,分解为小分子成分,实现受损细胞器自我修复、蛋白质循环利用、加强蛋白质检验点的检查纠错作用,稳定基因组、保持细胞自稳状态。正常组织中自噬活性长期受到抑制,细胞自稳及纠错功能无法有效发挥,有害因素在细胞内持续积累,导致肿瘤发生,因此保持基础、适当水平的自噬活性对生物体极其重要。在多种人类恶性肿瘤如乳腺癌、卵巢癌和前列腺癌细胞中均发现自噬正性调节因子缺失,而在肿瘤细胞中,大分子物质通过自噬降解为小分子物质,为肿瘤细胞提供营养物质,促进其生长,一旦出现自噬受抑,可观察到由环境压力导致的细胞凋亡增多。可见自噬在对肿瘤起双重作用,在正常组织中是对抗细胞癌变的防御机制,起抑癌作用,而对已经恶变的组织,能使肿瘤细胞耐受严苛环境,起促癌作用。
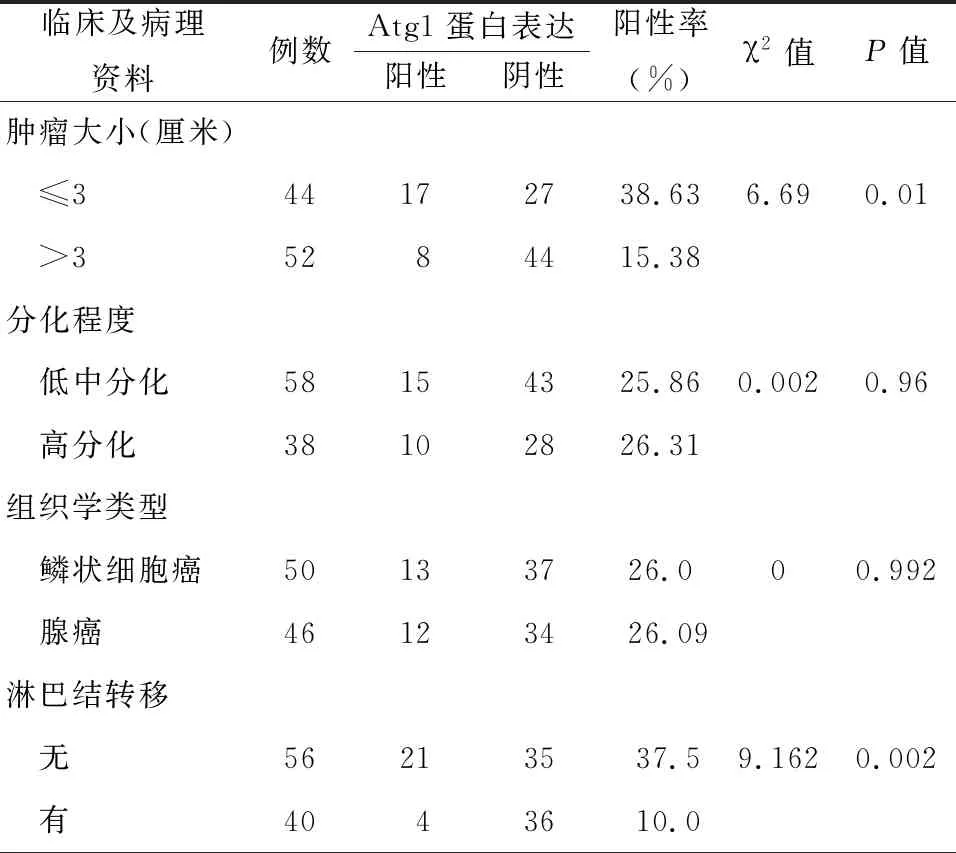
表3 非小细胞肺癌中Atg1表达水平与临床病理特征的关系
Atg1蛋白是丝氨酸苏氨酸激酶,是自噬通路启动阶段最关键、最直接的因子,Atg1与 Atg13、Atg17形成复合体后能够增强自身酶活性,从而诱导细胞自噬的发生,其活性受mTOR的调控。mTOR通路是调控细胞生长、增殖、自噬的重要信号通路,mTOR作为雷帕霉素的靶分子,具有丝氨酸苏氨酸激酶活性,是调控Atg1复合体活性的最主要上游分子。mTOR信号通路过度活化在多种肿瘤组织中被发现[5]。p-mTOR表达水平是mTOR通路活化程度的最敏感指标。研究显示p-mTOR在恶性肿瘤中呈异常高水平表达,显示其能抑制细胞凋亡、促进肿瘤生长的特征[6]。mTOR 通过与Atg1结合形成复合体,抑制Atg1的激酶活性,进一步抑制自噬的发生。
本文结果显示NSCLC组织中p-mTOR的表达水平显著升高,而Atg1的表达水平显著下降,印证p-mTOR通过与Atg1结合形成复合体,抑制Atg1发挥激酶活性,进一步抑制自噬的发生。由于肿瘤细胞自噬受到抑制,已经出现恶性倾向的细胞不能被清除掉,细胞恶性化逐渐积累,最终导致癌变发生。
Beclin1基因是哺乳动物细胞中发现的唯一的特异性自噬基因,其编码蛋白与磷酯酰肌醇3激酶家族Ⅲ形成自噬体,调节Atg蛋白在自噬前体结构中的定位,和它的上下游信号调节蛋白组成细自噬控制通路,在调节自噬活性、激活程序性细胞死亡过程中扮演重要角色,是重要的抑癌蛋白。研究证实Beclin1基因缺失及蛋白表达减少与肿瘤发生显著相关,小鼠细胞Beclin1等位基因被敲除后,恶性病变几率明显增加,Beclin1+/-突变小鼠较野生型小鼠更容易发生肺癌、肝癌和淋巴癌[7-8]。人类多种恶性肿瘤存在Beclinl基因失表达,卵巢癌突变率最高达75%,乳腺癌突变率也高于50%,乳腺导管癌、胰腺癌及宫颈癌中编码Beclinl蛋白的mRNA明显减少,相应蛋白表达水平也显著降低,乳腺癌细胞中稳定超表达Beclin1可降低癌细胞增殖和转移能力,应用基因技术抑制Beclin1基因表达可导致舌鳞癌细胞的自噬水平下降,肿瘤生长加速[9-10]。也有研究发现Beclin1在原发性肝癌中的表达水平明显升高,Ahn证实结直肠癌和胃癌组织中存在Beclin1过表达,而几乎没有或很少在正常胃及结直肠组织中表达[11-13]。不同部位肿瘤组织中表达水平存在明显差异可能与Beclin1对细胞自噬过程调整的双重性有关。
本文结果显示Beclin1蛋白在NSCLC中表达显著下降,提示其直接增强细胞自噬活性,是最重要的正向调控基因[14-15],其基因杂合缺失及蛋白表达减少是正常细胞发生恶性转化的重要原因之一。既往实验证实前列腺癌、乳腺癌及卵巢癌中均存在Beclinl单等位基因缺失突变[16-18],本实验结果与上述研究结果相一致,Beclinl蛋白在非癌组织中表达量高于肺癌标本,而在癌旁组织中表达差异无统计学意义,表明Beclinl在NSCLC中发挥抑癌作用,提示自噬活性在NSCLC中明显降低,验证了在NSCLC中,自噬体形成减少,自噬发生强度减弱。由于肿瘤细胞自噬功能下降、凋亡不足,导致异常细胞继续存货,异常细胞持续增加,最终出现肿瘤进展。
研究证实p-mTOR在低分化胃癌表达水平明显高于高分化胃癌[19-20]。朱伦等[21]证实在食管鳞癌中p-mTOR表达率随癌组织分化程度升高而降低。本实验发现p-mTOR表达水平与肿瘤分化程度显著相关,癌组织分化越好,p-mTOR表达水平越低,与现有研究结果相一致,提示p-mTOR正性调控肿瘤相关蛋白质合成,与肺癌细胞增殖及恶性倾向密切相关[22-24]。本实验证实p-mTOR表达水平越高,出现淋巴结转移几率越大,肿瘤临床分期越靠后,预后越差,对判断预后有重要意义。本实验显示p-mTOR表达水平与NSCLC患者年龄、性别、组织学类型和肿瘤直径等均无相关性。
本文结果显示Atg1和Beclinl蛋白均在肿瘤体积较小、尚未出现淋巴结转移及Beclinl蛋白在肿瘤组织分化尚可时的表达水平较高,提示二者在肿瘤早期表达活跃,仍发挥一定的促进自噬作用,以抑制肿瘤进展,其表达水平随肿瘤体积增大、分化恶化而下降,考虑持续基因低表达及蛋白缺失使肿瘤细胞自噬功能下降、凋亡不足,导致本应该通过凋亡或自噬性死亡的细胞生长呈现无节制、不受控状态,异常细胞持续累积,最终导致癌变。Atg1和Beclinl在出现淋巴结转移NSCLC病例中呈现明显低表达,考虑肺癌局部浸润及远处转移与其低水平表达关系密切,提示其完全失活多发生在肿瘤晚期,逐渐丧失其抑癌功能,更具侵袭性和转移能力,因而预后较差,在NSCLC的研究结果一致[25]。
本文结果发现在NSCLC中Beclinl和Atg1蛋白表达正性相关,推测两者作为细胞自噬调节通路的上下游靶点,在肺癌发生、浸润及转移中发挥协同抑癌的作用,其同步低水平表达导致细胞自噬能力降低、内环境自稳能力障碍。p-mTOR蛋白表达分别与Beclinl和Atg1蛋白表达负性相关,p-mTOR在细胞自噬过程中具有门控作用,其活性是自噬体形成和成熟的关键[26-29]。它在肿瘤细胞中通常被激活,是细胞自噬的负性调节因子,细胞自噬的许多信号传导通路都要经过mTOR通路,故p-mTOR是细胞自噬最主要的抑制性因子。肿瘤形成以后, Beclin1、Atg1的高表达促进自噬发生,mTOR阴性者对自噬的抑制作用减弱,二者所诱导的持续激活的自噬导致肿瘤细胞发生自噬性细胞死亡,从而产生肿瘤抑制作用。在肿瘤的发生、发展中,mTOR、Beclinl可能通过不同的信号通路各自发挥其自噬调控作用。Beclinl基因通过结合Ⅲ型PI3K,促进自噬的发生,而mTOR受其上游的I型PI3K信号转导通路的调控,抑制自噬活性,Beclinl过表达促进自噬的发生,mTOR被激活,抑制自噬活性,并且Beclinl过表达产生的自噬促进作用远大于mTOR过表达产生的自噬抑制作用。
自噬现象因细胞周围环境不同、疾病发展的不同阶段及给予不同的治疗干预措施,会对细胞会产生不同影响:细胞自噬可降低DNA突变概率、促进细胞凋亡、抑制肿瘤生成;在癌前病变期,自噬受到抑制,细胞内环境稳态无法维持,基因组错误率增加,致癌突变累积,正常细胞出现恶性转化;肿瘤进展期对营养物质需求增加,通过自噬弥补营养不足,保护癌细胞免受化疗药物的作用并延长肿瘤细胞生存时间,帮助其度过应激状况,使肿瘤细胞在恶劣环境中生存和发展。深入研究p-mTOR、Beclin1及Atg1在肺癌演变过程中的作用机制,为NSCLC早期诊断及预后评价提供理论基础,探索通过采用蛋白抑制剂靶向干预自噬,诱导肿瘤细胞自噬死亡,防止肺癌的侵袭和转移,为肺癌的早期预测及个性化治疗提供新思路。

