严重脓毒症/脓毒症休克患者预后的高危因素
晋正敏 朱 琴 龙云霞
脓毒症是由病原微生物感染引起的全身性炎症反应综合征,可进一步发展成为脓毒症休克、严重脓毒症,甚至引发急性器官功能障碍综合征[1-2]。近年来国内外相关专家学者对严重脓毒症/脓毒症休克的发病机制和诊断方法进行了不断深入的研究,但严重脓毒症/脓毒症休克的发病率和病死率仍然在持续增长[3-5]。因此,对严重脓毒症/脓毒症休克预后进行早期预测并采取有效防治措施显得非常重要。本文回顾性分析我院收治的1 013例严重脓毒症/脓毒症休克患者的临床资料、致病菌分布及生化指标情况,进一步探讨影响严重脓毒症/脓毒症休克患者预后的高危因素,为临床治疗提供参考,现报道如下。
对象和方法
一、研究对象
收集2009年12月至2017年12月本院收治的严重脓毒症和脓毒症休克患者分别为612和401例,其中男617例,女396例,平均年龄(52.73±12.61)岁。所有患者均符合《2012年国际严重脓毒症和脓毒症休克诊疗指南》所规定的诊断标准[6],中途退出治疗及合并严重外伤(例如头部、颈部、脊柱部位伤及胸背部开放伤等)患者予以排除[7]。
所有患者均按照《2014年中国严重脓毒症/脓毒性休克治疗指南》中的治疗规范进行积极治疗,具体包括早期液体复苏、抗微生物治疗、感染源控制、预防感染、必要时采用强心治疗、血管活性药物使用、机械通气等治疗。
二、研究方法
入院24 h内使用全自动生化分析仪检测患者谷丙转氨酶、谷草转氨酶、血清白蛋白、总胆红素、纤维蛋白原等血生化指标;C-反应蛋白(c-reaction protein, CRP)采用快速免疫比浊法测定,血乳酸检测采用乳酸脱氢酶比色法测定;采用酶偶联连续监测法测定尿素氮(blood urea nitrogen, BUN),苦味酸动力学法测定血肌酐(serum creatinine, Scr);降钙素原(procalcitonin, PCT)检测采用酶联免疫吸附试验(ELISA)。CRP试剂盒为芬兰Orion Diagnostica Oy公司提供,血乳酸试剂盒由上海天烨医疗科技有限公司提供,BUN及Scr试剂盒由上海科华公司提供。800TOSHIBA TBA-40FR全自动生化分析仪由日本东芝公司生产,全自动多功能酶标仪由美国Thermo公司生产。
观察指标包括患者年龄、性别、体重、基础疾病情况、重症加强护理病房(intensive care unit, ICU)住院时间、总住院时间、是否合并休克、是否院内感染、出院状态等。在脓毒症患者确诊当天进行急性生理学和慢性健康状况评分Ⅱ(APACHE Ⅱ),采集痰、血、尿、粪、分泌物、引流液等标本进行菌株分离、培养,然后使用法国梅里埃生物公司生产的ATB细菌鉴定仪进行菌株鉴定,记录患者的致病菌种类和感染部位分布情况。
三、统计学方法

结 果
一、一般资料比较
根据患者预后情况分为存活组(562例)和死亡组(451例),死亡患者中严重脓毒症患者223例,脓毒症休克患者228 例,见表1。死亡组患者与存活组相比,年龄、APACHE Ⅱ评分、脓毒症休克所占比率方面差异均具有统计学意义(P<0.05),见表1。

表1 存活组和死亡组患者一般资料比较
二、感染部位分布比较
存活组与死亡组患者中呼吸系统感染比例最高,分别为35.05%和36.59%,往后排列依次为血液系统、泌尿系统和消化系统,将这两组患者各个感染部位的感染比例分别相互比较发现,组间无显著性差异(P>0.05)。但脓毒症休克患者的血液系统感染比例(38.65%)明显高于严重脓毒症患者(24.84%,P<0.05),此外这两组患者呼吸系统、泌尿系统和消化系统感染比例相互比较无显著性差异(P>0.05),见表2。

表2 致病菌感染部位组间分布构成比较[n(%)]
三、致病菌分布比较
存活组和死亡组患者G-菌感染比例最高,分别为46.44%和63.64%,而且两组患者G-菌感染比例之间差异具有具有统计学意义(P<0.05)。在G-菌种类中,死亡组患者鲍曼不动杆菌感染比例(12.64%)明显大于存活组(4.09%);在G+菌种类中,死亡组患者粪肠球菌感染比例(14.41%)明显大于存活组(5.87%,P<0.05),见表3。
四、检测指标比较
存活组患者的降钙素原与血乳酸水平明显低于死亡组患者,组间差异具有统计学意义(P<0.05)。而存活组患者的血清白蛋白水平与血小板计数明显高于死亡组患者,组间差异具有统计学意义(P<0.05)。这两组患者其他检测指标的比较差异不具有统计学意义(P>0.05),见表4。
五、危重脓毒症预后的Logistic回归分析
采用多因素Logistic回归分析各检测指标与危重脓毒症患者预后的关系,结果发现患者年龄、APACHEⅡ评分、血乳酸、降钙素原及血清白蛋白与危重脓毒症患者的预后有显著相关性(P<0.05),是影响危重脓毒症患者是否存活的独立危险因素,见表5。

表3 存活组和死亡组患者主要致病菌分布构成比较[n(%)]

表4 存活组和死亡组患者检测指标比较

表5 影响严重脓毒症/脓毒症休克预后的多因素Logistic回归分析
六、危险因素联合预测严重脓毒症/脓毒症休克患者死亡的ROC分析
3项以上的危险因素相互联合检测对严重脓毒症/脓毒症休克患者死亡均有预测价值(AUC≥0.5),但效能各不相同,其中年龄+APACHEⅡ+血乳酸+血降钙素原+血清白蛋白联合检测的AUC最大,表明这五种危险因素一起联合对严重脓毒症/脓毒症休克患者死亡具有更高的预测价值,见表6。
讨 论
危重脓毒症是指脓毒症进展为严重脓毒症、脓毒症休克的状态,是ICU中死亡的主要病因[8]。据统计,在ICU病房的严重脓毒症的发病率在15%~42%,病死率30%~70%,而脓毒性休克患者的病死率更可达50%~87%[9-10]。本文严重脓毒症患者病死率为36.44%,脓毒性休克患者病死率为56.86%,总体病死率为44.52%,与国内外研究基本一致。因此,通过收集临床资料和检测有关指标来预测危重脓毒症患者的预后,进而采取具有针对性地有效措施,对降低患者死亡率,促进患者尽快恢复非常重要。
相关研究报道严重脓毒症患者年龄与病死率增加相关,尤其是老年人的身体机能和抵抗力下降,而且经常合并多种慢性疾病,导致器官储备能力和代偿能力进一步降低,进而加重脓毒症患者病情,导致患者死亡率上升[11-14]。APACHEⅡ评分是目前使用比较普遍的危重病严重程度评价方法,由急性生理学评分、年龄指数及慢性健康指数三个方面组成,其分值高低与患者病情严重程度呈现负相关性,即得分越高,则病情越重,死亡的风险也就越大[15-17]。本文中危重脓毒症死亡组患者的年龄、APACHEⅡ评分均明显高于存活组(P<0.05),进一步证实除了年龄以外,APACHEⅡ评分与脓毒症患者的病死率密切相关,可作为预测危重脓毒症患者预后的指标。
脓毒症主要由感染引起,不同感染部位及病原菌会对脓毒症的发展和预后产生重要影响。有研究结果提示肺、腹部、尿路感染约占严重脓毒症患者的70%,而呼吸道仍是ICU患者感染最常见的部位[18-20]。本文中存活组与死亡组患者呼吸系统感染比例最高,分别为35.05%和36.59%,往后排列依次为血液系统、泌尿系统和消化系统,与上述研究结果基本一致。同时还发现脓毒性休克患者的血液系统感染率最高,表明血液系统感染是引发脓毒性休克的首要原因。研究报道G-菌感染在脓毒症致病原中占主导地位,本文中死亡组患者G-菌感染比例(63.64%)明显高于存活组(46.44%),而死亡组患者耐药粪肠球菌和鲍曼不动杆菌的感染比率(14.41%,12.64%)明显高于存活组(5.87%,4.09%),差异均具有统计学意义(P<0.05),说明对这两种致病菌进行抗生素的有效治疗是影响脓毒症预后的关键[21-22]。
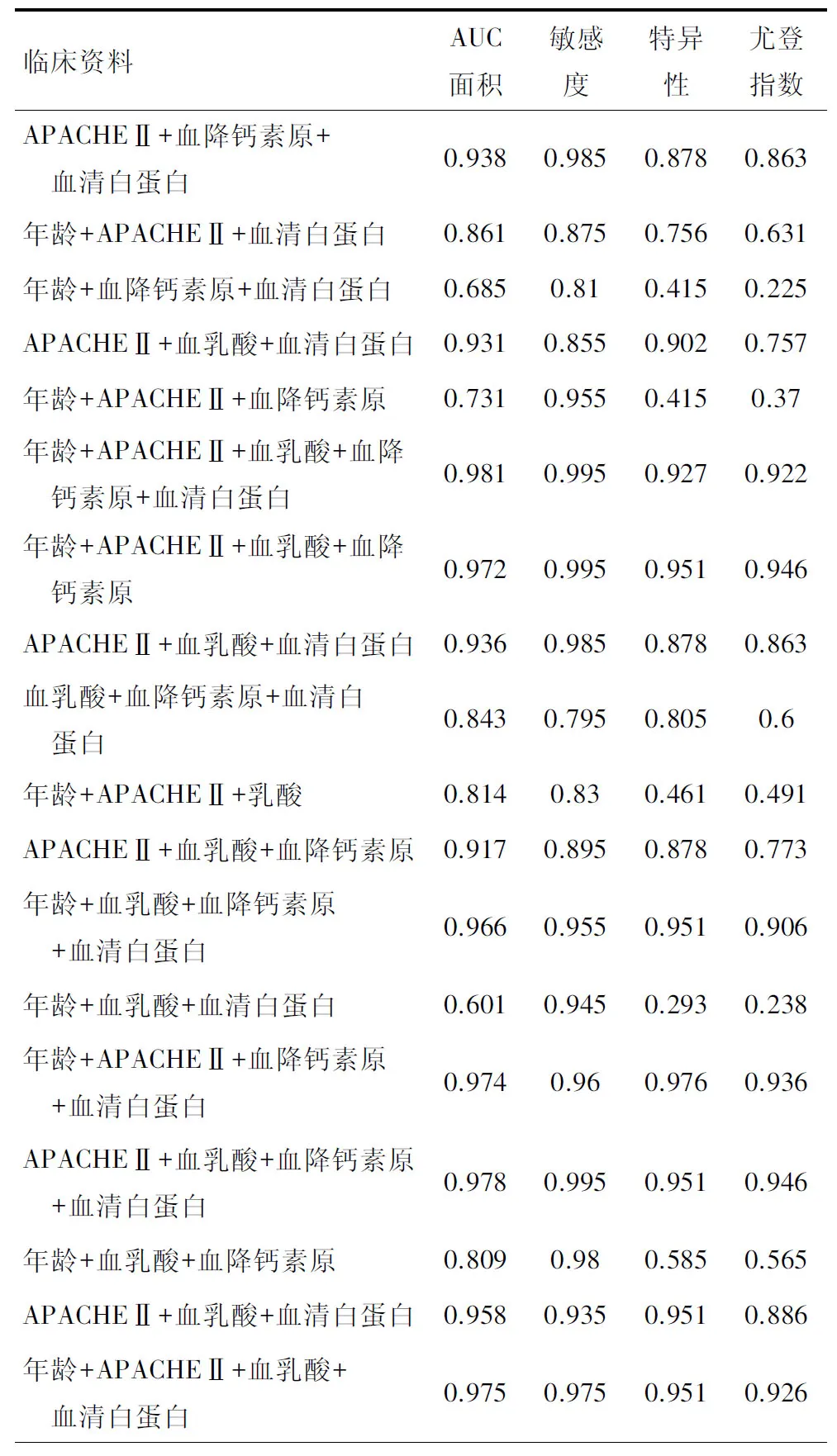
表6 危险因素联合预测严重脓毒症/脓毒症休克患者死亡的ROC分析
降钙素原(PCT)是与重症感染密切相关的炎症指标,在全身性感染的情况下,甲状腺以外的多种组织和细胞开始释放PCT,严重全身性感染患者PCT浓度可达健康者的数百倍[23-25]。在严重脓毒症、脓毒性休克患者中存在氧输送不足、组织灌注不良等状况,导致乳酸产生过多,乳酸浓度的高低对脓毒症患者的预后具有预测价值[26-28]。血清白蛋白在肝细胞内合成,在维持血浆胶体渗透压及人体营养方面具有重要作用,由于严重感染患者的代谢消耗大,肝脏合成能力下降,所以常导致危重脓毒症的白蛋白水平偏低,有研究提出低白蛋白血症是影响疾病预后的最重要因素之一,本文发现,患者年龄、APACHEⅡ评分、血乳酸、降钙素原及血清白蛋白与危重脓毒症患者的预后有显著相关性(P<0.05),都是影响危重脓毒症患者预后的独立危险因素[29]。而且ROC曲线分析结果显示,年龄+APACHEⅡ+血乳酸+血降钙素原+血清白蛋白联合检测的AUC最大,表明这五种危险因素一起联合对严重脓毒症/脓毒症休克患者死亡具有更高的预测价值。
因此,危重脓毒症患者应尽早、定期地监测APACHEII评分、血乳酸、降钙素原及血清白蛋白这些重要指标,以及时采取有针对性的治疗措施,对改善患者病情和预后具有重要的临床意义。

