雷公藤红素对高糖诱导的H9C2细胞损伤的保护作用
吴章,吕望,陈新国,金爽,陈玲珑,卢中秋
(1.温州医科大学温州市第三临床学院 温州市人民医院 急诊科,浙江 温州 325000;2.温州医科大学附属第一医院 急诊医学中心,浙江 温州 325015)
糖尿病性心肌病(diabetes cardiomyopathy,DCM)是指糖尿病引起的心肌病变,是一种常见的糖尿病并发症,可引发心肌性坏死,最终进展为心力衰竭、心律失常和心源性休克,因此也成为糖尿病患者死亡的主要原因之一[1-2]。氧化应激和活性氧簇(reactive oxygen species,ROS)积聚是诱导糖尿病并发症和糖尿病血管疾病的重要因子,甚至可能是糖尿病血管病变最重要的诱发因素。内皮细胞和血管平滑肌细胞暴露于蛋白和脂质的氧化产物中,造成细胞凋亡并成为糖尿病患者的主要病理改变之一[3-4]。
雷公藤红素(Celastrol)是传统中药雷公藤中的一种单体,是从雷公藤属及南蛇藤属植物中分离出的五环三萜类色素,具有较强的抗炎、免疫抑制、抑制血管形成以及抗肿瘤等药理活性[5]。相关研究显示,雷公藤红素可以抑制炎症因子的产生,例如IL-1、TNF-α、IL-6、IL-8,并通过与cdc37蛋白以及p23分子伴侣相互作用阻断热休克蛋白90(heat shock protein 90,Hsp90)的生物学活性[6],可以发挥心肌细胞保护作用[7],但是否对高糖诱导心肌细胞损伤具有保护作用尚不清楚。本研究通过高糖条件培养大鼠心肌H9C2细胞,并用雷公藤红素进行干预,分析雷公藤红素对H9C2细胞生长抑制率、ROS产生以及炎症因子相关基因表达的影响,探讨雷公藤红素对于高糖诱导心肌细胞损伤的保护作用,并为下一步的研究提供理论基础和实验依据。
1 材料和方法
1.1 材料 大鼠心肌H9C2细胞株购于南京凯基生物公司,雷公藤红素购于上海源叶公司;ROS荧光探针购于南京凯基生物公司;抗大鼠GAPDH、NFκB P65、TGF-β和IL-1β购于美国Abcam公司;TRNzol RNA提取试剂、2×Taq PCR MasterMix、反转录试剂盒FastQuant RT Kit(with gDNase)和DNA Marker购于天根生化科技(北京)有限公司;DMEM培养基购于南京凯基生物公司;胎牛血清购于美国Gibco公司。
1.2 方法
1.2.1 细胞培养:大鼠心肌H9C2细胞用含5%胎牛血清的DMEM培养基,于37 ℃,5% CO2细胞培养箱中培养;待细胞生长至90%左右,PBS清洗后用胰蛋白酶消化细胞,用培养基吹打悬浮细胞,按1:3 比例加入新鲜培养基进行传代培养或者调节细胞浓度至1×105细胞/mL,分别取100 μL和2 mL铺种于96孔或者6孔细胞培养板中。
1.2.2 MTT法检测细胞活力:实验设立低糖组、等渗组、高糖组、10 ng/mL雷公藤红素组和100 ng/mL雷公藤红素组。当细胞生长至90%以上覆盖率后,用胰蛋白酶消化H9C2细胞,分别用含10%胎牛血清的低糖DMEM(5.6 mmol/L)和高糖DMEM培养基(30 mmol/L)终止消化并吹打细胞呈悬浮状态后计数,铺种100 μL细胞悬液于96孔板中,铺种密度为1 000个/孔。等渗组中,加入甘露醇溶液(24.4 mmol/L)至低糖培养基铺种的96孔板中;干预组中,加入雷公藤红素至高糖培养基铺种的96 孔板中,使终浓度分别为10 ng/mL和100 ng/mL。 37 ℃,5% CO2继续培养48 h和72 h后加入20 μL浓度为5 mg/mL的MTT溶液,继续培养4 h后去掉培养基,加入150 μL DMSO后并吹打均匀使得结晶紫充分溶解,酶标仪上检测490 nm处吸光度。
1.2.3 流式细胞实验分析细胞内ROS产生水平:实验分组及细胞培养步骤同上,低糖组和等渗组用低糖DMEM完全培养基悬浮细胞,高糖组、10 ng/mL雷公藤红素组和100 ng/mL雷公藤红素组用高糖DMEM完全培养基悬浮细胞,调整细胞浓度至1×106细胞/mL,取2 mL铺种于6孔板中;等渗组中,加入甘露醇溶液(24.4 mmol/L)至低糖培养基铺种的6孔板中;10 ng/mL雷公藤红素组和100 ng/mL雷公藤红素组中,加入雷公藤红素至高糖培养基铺种的6孔板中,终浓度分别为10 ng/mL和100 ng/mL。37 ℃,5%CO2培养48 h后用无EDTA的胰蛋白酶消化,并用完全培养基吹打制成单细胞悬液;参照说明书加入ROS荧光探针使终浓度为10 μmol/L,37 ℃培养30 min后离心去上清液,加入1 mL的培养基继续于37 ℃培养30 min;离心去上清,用PBS清洗2次;离心后并加入500 μL PBS,混匀后进行上机检测。
1.2.4 RT-PCR实验分析细胞NF-κB、TGF-β和IL-1β mRNA的表达:实验分组及细胞铺种方法同上,37 ℃、5% CO2培养48 h后收集细胞并加入TRNzol试剂,按照产品说明书步骤抽提总RNA,用DEPC水溶解并测定RNA浓度,按照反转录试剂盒说明书配置反应液和设置反应程序,取1 μg RNA溶液并进行反转录反应;用2×Taq PCR Mastermix试剂配置PCR扩增反应液,并加入等体积的cDNA后进行扩增。引物序列为:GAPDH正向:5’-ACTGGCCACGCTAATCTGAC-3’,反向:5’-GATGGTGATGGGTTTCCCGT-3’;NF-κB正向:5’-GCCACTAAATCCAACACAGG-3’,反向:5’-CATCTTCACA TCTCCCGTAAC-3’;TGF-β正向:5’-TCAGACATTCGGGAAGC AG-3’,反向:5’-TTCCGTCTCCTTGGTTCAG-3’;IL-1β正向:5’-TTCAGGAAGGCAGTGTCAC-3’,反向:5’-GGAGAATA CCACTTGTTGGC-3’。扩增完成后用2%的琼脂糖凝胶进行电泳分离,凝胶成像系统拍照后用ImageJ软件对电泳条带进行灰度值分析,并计算目的基因的相对表达量。
1.2.5 Western blot实验分析细胞中NF-κB、TGF-β和IL-1β蛋白表达:实验分组及细胞铺种方法同上,37 ℃,5% CO2培养48 h后收集细胞并加入含有1 mmol/L苯甲基磺酰氟(PMSF)的RIPA细胞裂解液,冰上裂解细胞并进行总蛋白提取,BCA法测定各组细胞裂解液中总蛋白浓度,加入含有β-巯基乙醇的5×Loading Buffer,混匀后沸水浴10 min,取等量蛋白进行SDS-PAGE凝胶电泳,电泳结束后进行半干法转膜,10%的脱脂奶粉室温封闭1 h,配置一抗反应液,于孵育盒中覆盖PVDF膜,4 ℃孵育过夜。GAPDH、NF-κB、TGF-β和IL-1β抗体按照1:5 000进行比例稀释,并于4 ℃孵育过夜,用PBST缓冲液清洗后加入HRP标记的二抗室温孵育2 h,清洗后用ECL试剂孵育PVDF膜,暗室中进行曝光显影。ImageJ分析各条带灰度值,计算蛋白的相对表达量。
1.3 统计学处理方法 采用SPSS17.0软件进行统计学分析。计量资料以表示,2组间比较采用两独立样本t 检验;多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 高糖抑制H9C2细胞生长 MTT结果显示,培养24 h和48 h后,与低糖组相比(OD490 分别为0.785±0.015和0.855±0.020),高糖组(0.681±0.012和0.773±0.015)的细胞活力明显降低(P<0.05),提示高糖培养对H9C2细胞的增殖具有抑制作用,等渗组(0.742±0.016和0.861±0.072)与低糖组相比差异无统计学意义(P>0.05)。
2.2 雷公藤红素干预改善高糖对H9C2 细胞的生长抑制作用 雷公藤红素组分别用10 ng/mL和100 ng/mL的雷公藤红素干预高糖培养的H9C2细胞,MTT实验结果显示加入雷公藤红素干预后可以明显增强细胞活力(OD490分别为2.338±0.045和2.449±0.064),与高糖组(2.031±0.107)相比差异有统计学意义(P<0.05),提示雷公藤红素干预可改善高糖对细胞的生长抑制作用。
2.3 高糖诱导和雷公藤红素干预对H9C2细胞中ROS产生的影响 H9C2细胞经ROS荧光探针DHE孵育后,通过流式细胞仪于495 nm激发光条件下检测细胞的荧光活性,实验结果显示高糖组细胞培养48 h后检测到的荧光强度明显高于低糖组和等渗组(P <0.05),但是高糖组中细胞培养基中加入终浓度为100 ng/mL的雷公藤红素后,荧光探针染色阳性细胞比例较高糖组明显降低,直方图显示峰值明显发生左移,见图1。
2.4 高糖培养诱导H9C2细胞中NF-κB、TGF-β和IL-1β mRNA上调表达 高糖培养48 h的H9C2细胞经RTPCR实验分析发现,NF-κB、TGF-β和IL-1β的mRNA表达水平高于低糖组和等渗组,差异有统计学意义(P<0.05),而低糖组和等渗组差异无统计学意义(P>0.05),见图2。
2.5 雷公藤红素干预抑制高糖诱导NF-κB、TGF-β和IL-1β mRNA上调表达 高糖培养H9C2细胞的同时加入终浓度为10 ng/mL和100 ng/mL的雷公藤红素进行干预,结果显示10 ng/mL和100 ng/mL雷公藤红素组中NF-κB、TGF-β和IL-1β的mRNA表达水平与高糖组相比,均出现表达下调,差异有统计学意义(P<0.05),见图3。这提示雷公藤红素可能对参与纤维化和细胞炎症相关基因表达具有调控作用。
2.6 高糖诱导H9C2细胞中NF-κB、TGF-β和IL-1β蛋白水平上调表达 高糖组、低糖组和等渗组H9C2细胞经培养48 h后,Western blot检测结果显示高糖组中NF-κB、TGF-β和IL-1β蛋白相对表达量均明显高于低糖组和等渗组,差异有统计学意义(P<0.05),见图4。
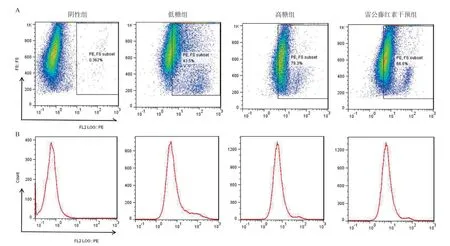
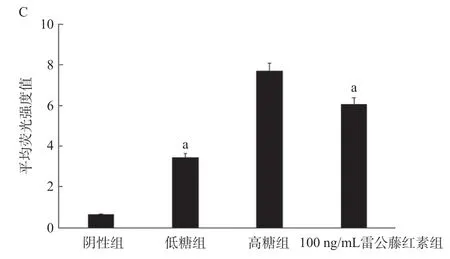
图1 雷公藤红素干预高糖对H9C2细胞内ROS水平的影响
2.7 雷公藤红素干预抑制高糖诱导NF-κB、TGF-β和IL-1β蛋白上调表达 Western blot结果提示10 ng/mL和100 ng/mL雷公藤红素组中H9C2细胞的NF-κB、TGF-β和IL-1β的蛋白表达水平显著低于高糖组,差异有统计学意义(P<0.05),见图5。
3 讨论
线粒体氧化应激被认为是发展DCM的重要因素,处于高糖环境中的细胞内产生晚期糖基化终产物(advanced glycation end products,AGEs),与其受体结合后诱导线粒体产生ROS,激活NF-κB信号途径诱发多种病理变化,在超氧化物歧化酶过表达的转基因糖尿病小鼠模型中,糖尿病视网膜病变和DCM明显受抑制[8-9]。
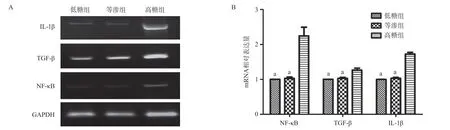
图2 高糖诱导H9C2细胞中NF-κB、TGF-β和IL-1β mRNA表达
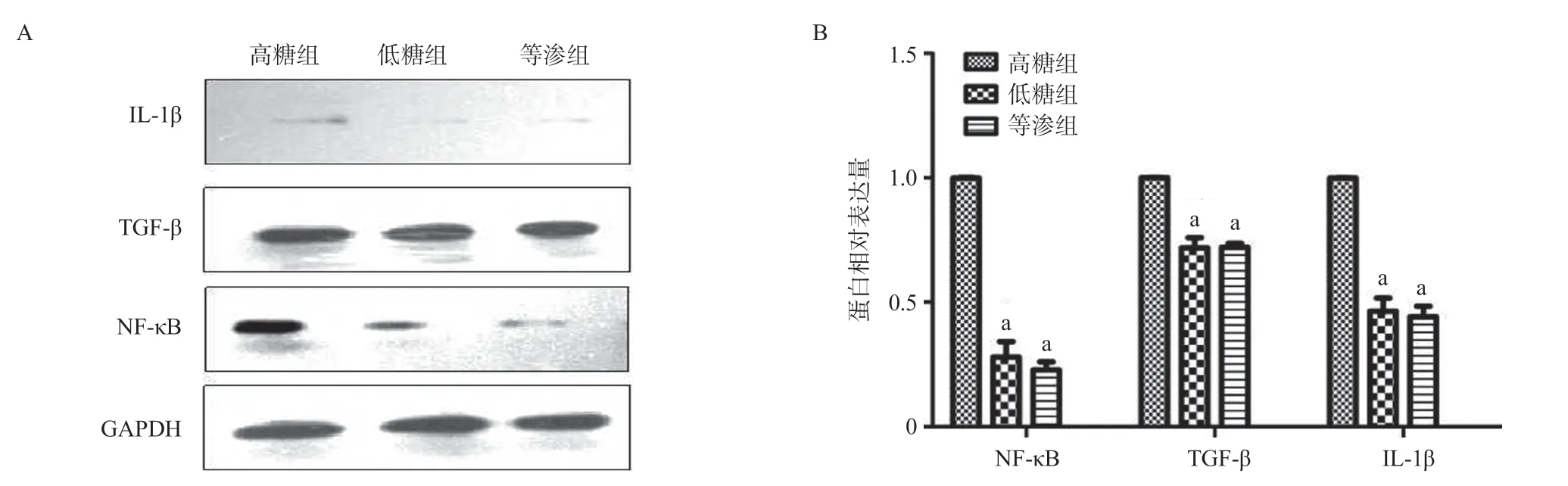
图4 高糖诱导H9C2细胞中NF-κB、TGF-β和IL-1β蛋白表达
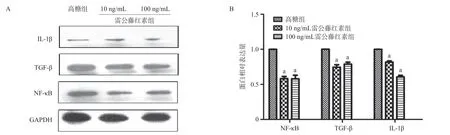
图5 雷公藤红素干预抑制NF-κB、TGF-β和IL-1β蛋白上调表达
有研究显示,雷公藤红素可以减轻大鼠局灶性脑缺血再灌注损伤,其作用机制可能与抑制NF-κB的活化,TNF-α及IL-1β的表达,从而减轻炎症反应有关[10]。YU等[11]通过体内和体外研究表明雷公藤红素能抑制NLRP3炎性小体的活化以及下游的Caspase-1和IL-1β的表达,从而提示雷公藤红素具有治疗NLRP3炎性小体依赖的炎症疾病。还有研究指出雷公藤红素增强细胞内ATP含量、线粒体膜电位和脂肪酸的氧化,从而提高线粒体的生物学功能,另外雷公藤红素可以增加细胞内ATP含量、维持线粒体膜电位、增强枸橼酸合酶活性并降低线粒体超氧化物,从而改善线粒体功能[12-13]。
尽管以上文献报道雷公藤红素具心肌保护、抗炎和增强线粒体功能等作用,但是高糖诱导大鼠心肌细胞损伤相关研究尚未见报道,本研究通过细胞毒性实验发现雷公藤红素干预组细胞活性高于高糖组细胞,提示雷公藤红素可以减轻高糖培养对H9C2细胞生长抑制作用,且对雷公藤红素的作用具有浓度依赖性。高糖毒性可能是通过增强细胞内ROS水平介导细胞毒性作用,本研究也通过流式细胞仪检测细胞内ROS水平,结果显示高糖组细胞内ROS水平明显高于低糖组和等渗组,雷公藤红素干预后细胞内ROS水平明显低于高糖组,提示雷公藤红素可以降低高糖诱导的ROS产生,但是关于雷公藤红素干预ROS产生的作用机制本研究尚未进行探讨,可能与增强线粒体功能和TCA循环有关[12]。HANSEN等[14]通过对雷公藤红素处理/未处理细胞进行蛋白质组学研究发现,雷公藤红素处理后细胞中与线粒体相关的抗氧化蛋白和细胞凋亡调节蛋白明显上调。ZHANG等[15]的研究发现雷公藤红素可以通过抑制mTOR信号途径维持AMPK活性,降低细胞内ROS产生从而保护镉诱导的神经细胞损伤。HU等[16]发现雷公藤红素可以促进转录因子Nur-77从细胞核内转移至线粒体,并与其中的肿瘤坏死因子受体相关因子2(tumor ne-crosis factor receptor-associated factor 2,TRAF2)结合抑制其泛素化连接酶活性,从而减轻炎症反应。
高糖诱导心肌细胞肥大已经得到多数学者的认可。在DCM的进程中,细胞内产生过量的ROS将影响DCM的整个病理进程,包括心肌肥大、纤维化和心脏收缩功能障碍以及心衰[17-18]。钟明等[19]研究表明缬沙坦通过抑制TSP-1/TGF-β1信号途径逆转大鼠DCM心肌间质纤维化进程,大鼠左室心肌组织胶原含量及TGF-β1表达量均明显降低。雷公藤红素还可抑制TGF-β1诱导的人脐静脉内皮细胞发生内皮间质转化作用,其分子机制可能是雷公藤红素具有抑制TGF-β1/Smads信号途径所介导的[20]。在本研究中,高糖培养的H9C2细胞中TGF-β1转录水平明显较低糖组和等渗组高,但是经过雷公藤红素干预后其在mRNA和蛋白水平的表达量均受抑制,但是雷公藤红素是否会抑制高糖培养诱导的心肌细胞肥大,本研究尚未进行实验验证,雷公藤红素诱导TGF-β1下调表达所涉及的信号途径本研究也尚未阐明,但有研究表示雷公藤红素可抑制组织型胶原以及I和IV型胶原的表达,从而改善组织病变[21-22]。
以上结果提示高糖培养的H9C2细胞中,炎症相关的因子表达量和细胞内ROS水平均出现上调,可能与心肌细胞肥大和细胞炎症等病理过程具有一定的相关性。雷公藤红素可以作为一种免疫调节剂通过对多种信号途径参与对高糖诱导的ROS产生和细胞炎症相关基因表达进行调控。尽管其参与的分子机制和信号途径尚未阐明,但是雷公藤红素仍可作为降低高血糖引起的心肌细胞病变候选药物。

