miRNA let-7a靶向抑制ACVR1B表达
洪子璞,关开宇,王韶,徐胜男,郝燕燕,陈肖鸣
(1.温州医科大学附属第一医院 小儿外科,浙江 温州 325015;2.温州医科大学附属康宁医院 精神卫生研究所,浙江 温州 325000;3.温州市中医院 检验科,浙江 温州 325000)
微小RNA(miRNA)是通过结合靶mRNA的3'非编码区(3’UTR)来调节基因表达[1]。miRNA通过转录后调控影响了大约30%人类基因的表达[2]。let-7a是let-7 miRNA家族的重要成员之一,是一个具有肿瘤抑制作用的miRNA,并在多种肿瘤疾病中表达量显著降低,如结肠癌、乳腺癌、肺癌、生殖细胞肿瘤等[3-6]。ACVR1B也被称为ALK4,属于转化生长因子β(transforming growth factor-β,TGF-β)受体中的IB型激活素受体。通过配体与受体结合激活下游信号介质蛋白,继而磷酸化介质蛋白,募集其他转录因子共同作用调控下游靶基因的表达[7-8]。研究表明,let-7a通过调控TGF-β家族中的TGFBR3的转录调节血管的形成[9]。且有实验室发现let-7a和ACVR1B在不同亚型的肺癌中可能存在调控关系[10]。在HEK293T细胞中let-7a可能通过对ACVR1B的转录后调控来行使功能。本研究探讨ACVR1B mRNA与let-7a直接调控的潜在靶点关系,为疾病治疗提供相应分子策略。
1 材料和方法
1.1 细胞株和载体 人肾胚293T(HEK293T)细胞购于中国科学院上海细胞所;pGEM-T载体、双荧光素酶报告载体pmirGLO购于北京Promega公司。
1.2 主要试剂 TRIzol试剂、反转录试剂盒、SYBR Green PCR Master Mix、Lipofectamine2 000、Lipofectamine LTX and Plus试剂购于美国Invitrogen公司;DMEM培养基、胎牛血清、Opti-MEM培养基购于美国Gibco公司;限制性内切酶PmeI和SalI、T4 DNA连接酶购于美国NEB公司;Dual-Luciferase®Reporter Assay试剂盒购于美国Promega公司;QuikChange Site-Directed Mutagenesis试剂盒购于美国Agilent公司;Vinculin单克隆抗体、ACVR1B多克隆抗体购于美国Abcam公司;let-7a mimic、let-7a inhibitor和let-7a NC购于广州锐博公司;蛋白酶抑制剂、磷酸酶抑制剂购于美国Roche公司;ECL显影液购于美国Millipore公司;山羊抗兔IgG HRP抗体购于美国Jackson公司;PCR试剂盒、DH5α感受态细胞、质粒提取试剂、胶回收试剂盒购于北京天根公司;RIPA蛋白裂解液、PMSF、BCA蛋白浓度测定试剂盒购于上海碧云天公司;引物由南京金斯瑞公司合成。
1.3 细胞培养及转染 使用加入10%胎牛血清的DMEM高糖完全培养基培养HEK293T细胞至稳定传代2~3代,20%的浓度种植于24孔板中,let-7a模拟物(let-7a mimic)、let-7a抑制剂(let-7a inhibitor)和let-7a阴性对照组(let-7a NC)由广州锐博公司合成,在细胞融合度达到70%时使用Lipofectamine 2 000试剂盒按照使用说明转染let-7a mimic、let-7a inhibitor和let-7a NC至HEK293T细胞,6 h后将旧培养基更换为含有10% FBS、1% ECGS、无双抗的ECM培养基,继续培养约24 h。
1.4 双荧光素酶报告载体的构建 依照基因组DNA提取试剂盒抽提人基因组DNA,以提取的人基因组DNA为模板进行PCR扩增:94 ℃预变性3 min,94 ℃30 s,55 ℃ 30 s,72 ℃ 60 s循环30 次后,72 ℃最后延伸5 min。ACVR1B 3’UTR引物F:5’-CGTACGA TGGAGGCCTACCTCTCGTTTCTGCCCAGCC-3’,R:5’-GCATGC TACCTCCGGATGGAGAGCAAAGACGGGTCGG-3’,PCR产物进行回收纯化,使用T4连接酶将pGEM-T载体和切胶回收纯化的PCR产物进行连接,经感受态细胞转化扩增后构建野生型pGEMT ACVR1B 3’UTR载体,依照定点突变试剂盒进行点突变PCR反应,构建出突变型pGEMT-ACVR1B 3’UTR载体,ACVR1B 3’UTR突变引物F:5’-CGTACGATGGAGGCCTATAGCTCGTTTCTGCCCAGCC-3’,R:5’-GCATGCTACCTCCGGATATCGAGCAAAGACGGGTCG G-3’。将突变和未突变的pGEMT-ACVR1B 3’UTR载体与双荧光素酶报告载体(pmirGLO载体)进行连接,感受态细胞转化扩增,经测序得到ACVR1B 3’UTR野生型(ACVR1B 3’UTR-WT)和ACVR1B 3’UTR突变型(ACVR1B 3’UTR-MUT)重组双荧光素酶报告载体。
1.5 双荧光素酶报告基因活性检测 将let-7a mimic或let-7a NC和pGEMT-ACVR1B 3’UTR-MUT或pGEMT-ACVR1B 3’UTR-WT双荧光素酶报告载体共转染HEK293T细胞,48 h后去除培养基,细胞裂解液PLB充分裂解后再加LARII,检测萤火虫荧光素酶的活性,加入Stop & Glo试剂,检测海肾荧光素酶活性。结果以萤火虫荧光素酶活性/海肾荧光素酶活性的比值表示。
1.6 qRT-PCR检测相关mRNA表达 根据TRIzol使用手册,提取细胞样本总RNA。RNA纯化后,通过反转录试剂盒获得cDNA。采用qRT-PCR,选取GAPDH作为内参基因比较候选基因的表达情况。结果用2-ΔΔCT法进行分析。
1.7 Western blot检测 Western blot检测相关蛋白表达,使用图像分析软件Image J对目的条带及内参条带进行灰度分析,再以目的条带/内参条带灰度值的比值用统计软件进行统计分析。
1.8 统计学处理方法 采用GraphPad Prism5.0软件进行统计学分析。计量资料用形式表示,2组比较用配对t 检验,多组比较采用单因素方差分析,组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 let-7a的潜在靶基因分析 利用生物信息分析工具targetscan等预测,发现ACVR1B基因是let-7a的一个潜在靶基因。进一步用工具分析出ACVR1B基因的3’UTR第77-83位碱基存在let-7a的潜在结合位点,见图1。

图1 ACVR1B 3’UTR上let-7a潜在结合位点的预测示意图
2.2 双荧光素酶报告载体的构建和鉴定 构建ACVR1B mRNA 3’UTR的双荧光素酶报告载体,并进行双荧光素酶报告基因活性检测实验,测序结果比对显示pmirGLO ACVR1B 3’UTR WT和MT型构建成功,见图2。

图2 pmirGLO ACVR1B 3’UTR构建和鉴定
2.3 转染重组质粒的细胞荧光素酶活性的表达
双荧光素酶报告系统检测显示,共转染ACVR1B 3’UTR-WT报告载体后,let-7a mimic组的荧光素酶活性比let-7a NC组明显降低,差异有统计学意义(P<0.05);而共转染ACVR1B 3’UTR-MUT报告载体后,let-7a mimic组荧光素酶活性与let-7a NC组差异无统计学意义(P>0.05),见图3。
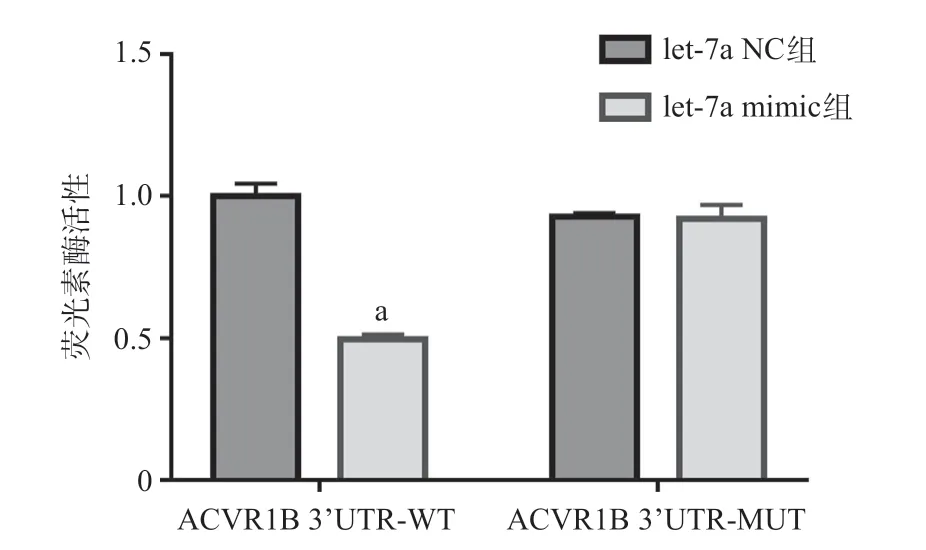
图3 2组报告载体中转染不同质粒后细胞内萤火虫海肾荧光素酶活性比值
2.4 HEK293T细胞中let-7a靶向调控ACVR1B的表达 HEK293T细胞荧光定量PCR显示let-7a mimic组ACVR1B mRNA表达量较let-7a NC组和let-7a inhibitor组低,差异有统计学意义(P <0.05);而let-7a NC组和let-7a inhibitor组ACVR1B mRNA表达水平差异无统计学意义(P>0.05)。Western blot结果显示HEK293T细胞转染let-7a mimic后,ACVR1B的蛋白表达水平显著低于let-7a NC组和let-7a inhibitor组,差异有统计学意义(P <0.05);let-7a NC组和let-7a inhibitor组的ACVR1B的蛋白表达水平差异无统计学意义(P>0.05)。见图4-5。
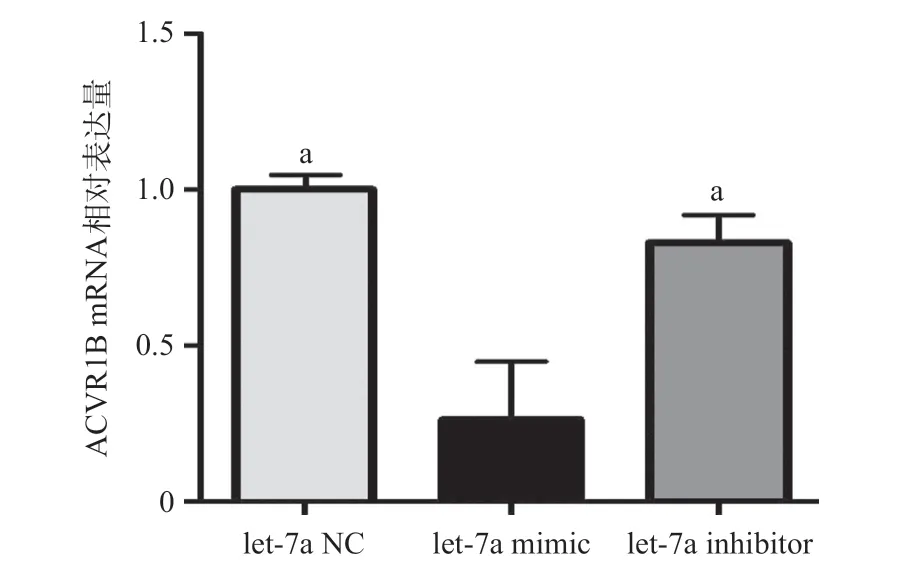
图4 HEK293T细胞中let-7a负调控ACVR1B mRNA表达
3 讨论
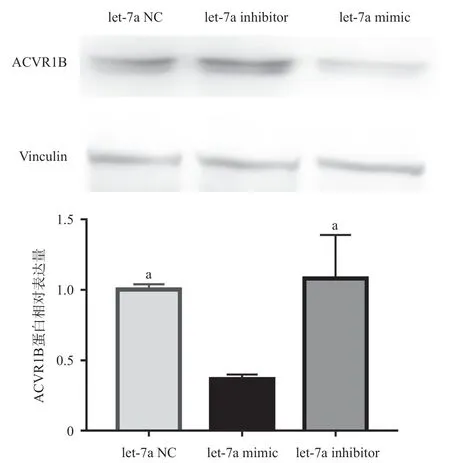
图5 HEK293T细胞中let-7a负调控ACVR1B蛋白表达水平
miRNA是一种普遍存在的非编码小RNA,能够特异性识别并结合到靶mRNA分子的3’UTR的特定区域,通过诱导降解和抑制翻译达到抑制靶mRNA的目的,在细胞的增殖、凋亡、分化、迁移及血管生成中起到作用[1-2]。let-7作为最先发现的miRNA家族成员之一,参与了许多生理过程[11]。POLISENO等[12]使用miRNA芯片技术检测发现,在HUVECs中有15个高表达的miRNAs与血管生成相关,let-7就是其中之一。TANG等[13]研究发现,let-7a在胃癌细胞中通过下调PKM2明显地抑制胃癌细胞的增殖、迁移以及侵袭能力。另外在乳腺癌中,let-7a具有抑制癌细胞增殖、迁移的能力[14]。
ACVR1B是TGF-β受体中的I型激活素受体,参与信号的转导。TGF-β和II型受体ACVRII使招募I型受体磷酸化激活,调控下游Smad蛋白,抑制增殖调节因子的基因转录,在经典的TGFBs/SMAD信号传导通路中发挥作用[15]。ACVR1B在许多疾病的发生发展中起到重要作用。有研究发现,ACVR1B在心房纤维化和心房纤颤发病中发挥着重要作用[16]。SUN等[17]发现在HCMVEC细胞中经过阿霉素处理后,ACVR1B表达水平升高,Smad2/3的转录靶点降低,血管网络的形成减少受到抑制。之前的研究表明,TGF-β家族中的TGFBR3是let-7a的靶基因,且let-7a通过调控TGFBR3的转录调节血管的形成[9]。且有实验室通过收集3种不同亚型的肺癌miRNA,利用富集筛查等方法发现let-7a和ACVR1B之间可能存在调控关系[10]。本研究利用生物信息分析工具发现ACVR1B mRNA是let-7a的一个潜在靶基因,为了进一步分析let-7a是否通过结合到ACVR1B基因的mRNA 3’UTR区域潜在的结合位点来调节ACVR1B基因的表达,通过构建ACVR1B野生型和ACVR1B突变型重组双荧光素酶报告载体,分别与let-7a mimic和let-7a NC转染HEK293T细胞,收集细胞后通过双荧光素酶报告系统检测各组细胞的荧光素酶活性,发现共转染ACVR1B 3’UTR-WT报告载体组中,let-7a mimic的荧光素酶活性比let-7a NC组明显降低,而共转染ACVR1B 3’UTR-MUT报告载体组中,let-7a mimic荧光素酶活性与let-7a NC组差异无统计学意义,证明ACVR1B mRNA 3’UTR存在let-7a的特异性结合位点。为了确定let-7a是否可能靶向调控ACVR1B基因的表达,通过在HEK293T细胞中分别转染let-7a mimic、let-7a NC和let-7a inhibitor来进一步验证let-7a靶向抑制ACVR1B的mRNA和蛋白水平表达。这些结果初步阐述了ACVR1B可能是受let-7a直接调控的。

