北京地区实验大鼠金黄色葡萄球菌的检测结果及MLST分型分析
冯育芳 邢 进 张雪青 岳秉飞 赵德明
(1.中国农业大学动物医学院,北京 100094)(2.中国食品药品检定研究院实验动物资源研究所,北京 102629)
实验大鼠在生物医学中应用广泛,一直是生理、行为、代谢、神经、毒理等研究最常用的实验动物之一[1-3]。金黄色葡萄球菌(Staphylococcus aureus,以下简称金葡菌)是一种广泛分布的细菌,其在空气、水、灰尘及人和动物的排泄物中都可找到。金葡菌也是一类病原菌,特定条件下可引起人类或动物多种感染,包括局部化脓性疾病和全身化脓性疾病[4]。值得特别注意的是,新出现的耐甲氧西林金葡菌(MRSA),被称作超级细菌,几乎能抵抗所有的抗生素,成为人们关注的重点[5]。鉴于金葡菌的广泛性、潜在致病性及耐药性,Jackson Lab和Charles River要求大鼠检测并排除该细菌,日本石中研则要求免疫缺陷大鼠必须检测并排除该细菌,我国国标也要求SPF大鼠必须排除[6-7]。因此,本实验室长期监测北京地区实验大鼠金葡菌的携带情况,并分析其分子特征,探寻其流行趋势,为实验大鼠金黄色葡萄球菌的防控提供基础信息。
1 材料与方法
1.1 材料
1.1.1 受检动物:受检 SPF级实验大鼠来自北京市12家实验动物生产和使用机构。
1.1.2 所用试剂:培养基包括甘露醇氯化钠琼脂培养基(北京三药科技开发公司,11316)、哥伦比亚血琼脂培养基(OXIOD公司,CM0331B)、脱纤维羊血(北京陆桥公司,P62)、生化鉴定试剂为BD阳性菌鉴定板(BD公司,448008),DNA提取试剂盒(QIAGEN,69506),Prime STAR HS(TAKARA,R040A),琼脂糖(TAKARA,5260)。
1.1.3 仪器设备:恒温培养箱(Thermo Scientific Heraeherm)、生物安全柜(Thermo Scientific A2)、显微镜(Nikon)、细菌鉴定仪(BD Phonix-100)。
1.2 方法
1.2.1 样品采集:观察实验大鼠外观,核对动物编号。断颈处死动物,将动物仰卧固定,消毒解剖部位。在动物下腹部皮肤剪开一小口,剥开皮肤层后剪开肌肉,将回盲部剪开,取适量内容物接种高盐甘露醇琼脂平皿(SP)。
1.2.2 金葡菌的检测:将已接种的SP培养基置(36±1)℃培养18~24 h。在 SP培养基上形成1 mm左右、凸起、黄色的菌落,菌落周围的培养基由红色变成黄色。转种血琼脂平皿(36±1)℃培养18~24 h形成白色或金黄色、凸起、圆形、不透明、表面光滑的菌落。革兰氏染色为阳性球菌,排列成葡萄状,无芽孢,无荚膜,直径约为 0.5~0.1μm。 直接用全自动细菌鉴定仪进行鉴定,或参照国标进行手工生化鉴定。结合培养形态、染色以及生化鉴定结果,做出判定。
1.2.3 MLST分型:多位点序列分型(multilocus sequence typing,MLST)实验按照金葡菌MLST网站(http://saureus.mLst.net)提供的方法进行。参照网站的方法合成引物。PCR反应体系为总体积50μL,其中包含 H2O 19μL、2×PCR mix 25μL、上游引物2μL、下游引物2μL、DNA 模板 2μL。 PCR反应条件为98℃10 s、55℃5 s、72℃1 min,共30个循环。PCR后用1.5%琼脂糖电泳鉴定有无扩增条带。符合目标长度的阳性条带产物进行测序。PCR产物送生工生物工程(上海)股份有限公司进行测序。测序结果提交网站进行比对,获得等位基因号和ST型。数据录入BioNumerics 7.1软件构建聚类树。
2 结果
2.1 北京地区实验大鼠金葡菌的流行趋势
为了解北京地区实验大鼠金葡菌的流行趋势,本实验室按照国家标准持续对北京地区SPF级实验大鼠进行抽检,2008—2017年,每年检测大鼠106~288只,总计 1956只。检测结果显示,每年检出金葡菌阳性大鼠6~39只,总计165只;每年金葡菌阳性率为3.17%~18.48%,平均阳性率为8.44%,见表1。金葡菌整体阳性率呈先低中高后低的趋势,在2013年金匍菌大鼠阳性数量和阳性率最高,达到39只和占比18.48%,见图1。进一步分析金葡菌大鼠检测的时间分布,结果发现第四季度检测率最高,但各季节之间没有统计学差异。这些结果说明,金葡菌在北京地区实验大鼠中长期广泛存在,2013年达到阳性峰值,之后阳性率呈逐年下降趋势,阳性率在季节间的差异不大,见图2。

表1 2008—2017年北京地区实验大鼠金葡菌的检出情况Table 1 Detection of Staphylococcus aureus in laboratory rats in Beijing from 2008 to 2017
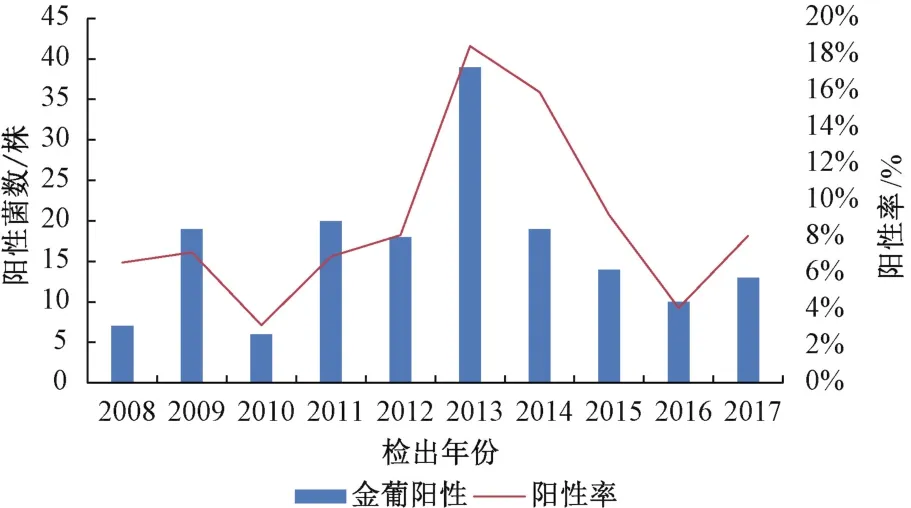
图1 2008—2017年北京大鼠金葡菌的流行趋势图Fig.1 Epidemiological Trend of Staphylococcus aureus in laboratory rats in Beijing from 2008 to 2017
2.2 实验大鼠金葡菌的mLST分型

图2 2008—2017年北京大鼠金葡菌的流行趋势图(分季度)Fig.2 2008—2017 Epidemiological Trend of Staphylococcus aureus in laboratory rats in Beijing(Quarterly)
为了解实验大鼠金葡菌的分子特征,本实验室对实验大鼠来源的148株金葡菌进行了 MLST分型。结果发现,148株菌株共分为7个 ST型别,分别为 ST8、ST3、ST1、ST6、ST2871、ST88、及 ST641,每个ST型包含菌株数1~76株不等。从构成比来看,ST1占比最大,达到 51.35%(76株);其次是ST2871,占比达到30.41%(45株);其余 ST型别占比都小于10%,见表2。从进化上来看,ST1和ST88属于其中的中间环节,见图3。在此基础上,分析不同ST型别在流行时间上的区别。结果发现,2012年之前和2016年ST1占主要位置;2012—2016年,ST2871占比突然增大;2017—2018年ST6占比逐渐升高,占据主要位置,见图4。分析不同 ST型别在实验空间上的区别,结果发现,ST1主要流行于A~F、J、M 等八个机构,ST2871 则在 J、H、I等三个机构占主要地位,见图5。这些结果说明,北京地区实验大鼠金葡菌具有显著的时空分布特点,以及进化相关性。

表2 148株金黄色葡萄球菌mLST分析结果Table 2 mLST analysis of 148 strains Staphylococcus aureus
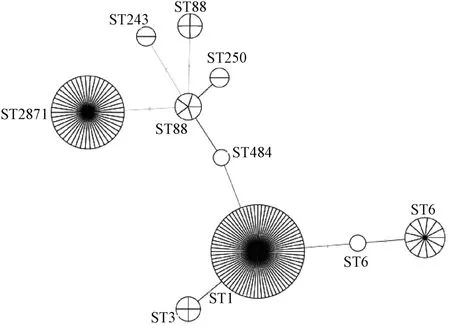
图3 金黄色葡萄球菌mLST结果的聚类树Fig.3 Cluster tree of staphylococcus aureus by mLST analysis

图4 金黄色葡萄球菌型别流行时间分布Fig.4 Time distribution of Staphylococcus aureus by types
3 结论

图5 金葡菌各型别的空间分布Fig.5 Spatial distribution of Staphylococcus aureus by types
金葡菌是人类的一种重要病原菌,属于葡萄球菌属,有“嗜肉菌”的别称,是革兰阳性菌的代表。金葡菌在自然界中无处不在,空气、水、灰尘及人和动物的排泄物中都可找到,人体和动物受到污染的机会很多[8]。美国疾病控制中心报告,由金葡菌引起的感染占第二位,仅次于大肠杆菌。
为排除实验动物的金葡菌,首先要了解其感染情况,2012年葛文平等[9]检测了5个实验动物养殖场不同品系SPF级小鼠,发现其金葡菌的携带率为1.875%。丁浛高等[10]在扬州大学比较医学中心13个隔离设施发现部分小鼠携带金黄色葡萄球菌。黄伟峰等[11]于2011—2017年从7家实验动物养殖场采集完成370只实验动物的金葡菌检测,共检出金葡菌31株,总分离率为 12.16%,且均从 SPF大鼠中分离所得。本研究检测了2008—2017年北京地区实验大鼠1 956只,检测到阳性大鼠165只,阳性率为8.44%,说明金葡菌在实验动物广泛长期存在,特别是在实验大鼠群体中,需要特别重视。
分子流行病学可为病原防控提供策略和措施。黄伟峰等[11]从实验大鼠中检出金葡菌分成5个型别,其中 T2360为优势型别,PFGE型别有10个带型;而且饲养环境中金葡菌的PFGE带型与2017年SPF大鼠中的细菌带型完全一致,说明饲养环境中存在的金葡菌与SPF大鼠感染的金葡菌具有紧密联系[12]。文献报道Charles River实验室99株金葡菌大部分属于 ST88(54.5%),随后是 ST15、ST5、ST188及ST8[13]。本研究对北京地区实验大鼠分离到的148株金葡菌进行了MLST分型检测,结果显示,北京地区实验大鼠的金葡菌以ST1为主,其次是ST2871,与国外及国内现有结果均不同。说明北京地区实验大鼠的细菌来源因为地域或人员引入,需要从这些角度进行防控,确保实验动物质量[14]。
综上所述,本研究长期监测了北京地区实验大鼠的流行趋势,首次使用MLST分型分析国内实验大鼠金葡菌的分子特征,为实验大鼠金黄色葡萄球菌的防控提供了基础信息,为实验大鼠金黄色葡萄球菌的检测提供数据支持,从而保障实验大鼠的微生物质量。

