基于体素内不相干运动成像的三维容积ROI直方图分析在术前评估肝细胞癌病理分化程度中的价值研究
张喆,刘爱连*,赵莹,郭妍
作者单位:
1.大连医科大学附属第一医院放射科,大连 116011
2. 通用电气药业(上海)有限公司,上海 200000
肝细胞癌(hepatocellular carcinoma,HCC)在全球范围内高发且预后差[1-2]。射频消融(radiofrequency ablation,RFA)作为一种肝切除术的替代疗法,具有安全性高、创伤小的优势[3],但有研究[4]表明,低分化HCC是RFA治疗后复发的危险因素,对此类患者不宜采取RFA治疗,而应选择肝切除术或其他治疗方式。因此,术前识别低分化HCC,对治疗方案的选择以及预后预测有着重要的意义。穿刺活检虽可术前检测HCC分化程度,但为侵入性检查,有针道种植转移的风险[5]。扩散加权成像(diffusion weighted imaging,DWI)的表观扩散系数(apparent diffusion coefficient,ADC)可术前评估HCC分化程度[6],但ADC不仅受水分子扩散的影响,还受微循环灌注的影响。体素内不相干运动扩散加权成像(intravoxel incoherent motion,IVIM)能克服ADC的局限性从而更准确地评估HCC分化程度[7-9]。然而多项研究表明HCC具有异质性[10-13],既往研究采用传统感兴趣区域(reign of interest,ROI)法,是在肿瘤最大层面实性部分勾画ROI,得到信号强度均值,此方法无法反映HCC整体的特征。因此,有学者[14]尝试利用容积ROI反映HCC整体特征,并发现其诊断效能高于传统ROI。直方图分析可通过更多定量参数反映肿瘤的异质性[15-16]。目前尚未见有学者采用IVIM容积ROI直方图评估HCC分化程度,笔者旨在对DWI单指数模型和IVIM的双阶单指数模型进行容积ROI直方图分析,以实现术前、无创、准确、整体地评估HCC分化程度。
1 材料与方法
1.1 研究对象
回顾性分析本院2015年7月至2019年5月符合如下标准的患者。纳入标准:(1)穿刺或术后病理证实为HCC;(2)术前行3.0T肝脏MR检查,扫描序列包括肝脏容积加速成像(liver acquistion with volume acceleration,LAVA)动态增强、DWI和IVIM;(3)检查前患者未接受RFA、经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)、肝切除术等治疗。排除标准:(1)病理为肝细胞-胆管细胞混合型癌;(2)病理分化不明;(3) DWI、IVIM参数不统一(统一标准:呼吸门控式DWI且b值相同);(4) DWI、IVIM图像质量欠佳或不可获得:伪影、缺图、未完全覆盖肿瘤;(5) HCC直径≤1 cm以致难以勾画ROI。最终纳入51例患者(52个病灶),年龄31~76岁,平均(60.8±9.0)岁,男41例(42个病灶),女10例(10个病灶)。
1.2 HCC的分组
将病理提示含有低分化HCC (中低分化、低分化)的病灶归为低分化HCC组,不含有低分化HCC(高分化、高中分化、中分化)的病灶归为非低分化HCC组。最终,低分化HCC组包括15个HCC病灶(中低分化病灶8个、低分化病灶7个),非低分化HCC组包括37个HCC病灶(高分化病灶9个、高中分化病灶13个、中分化病灶15个)。
1.3 检查方法
采用GE Signa HDxt 3.0 T MR扫描仪,8通道腹部线圈。扫描参数:LAVA动态增强:使用对比剂(钆喷酸葡胺,Bayer Schering Pharma AG,德国)经肘静脉注射,剂量0.1 ml/kg,流速2.5 ml/s,分别在对比剂注入后16 s (动脉早期)、40 s (动脉晚期)、60 s (门静脉期)、180 s (平衡期)扫描,TR 4 ms,TE 1.8 ms,FOV 42 cm×33.6 cm,矩阵270×224,反转角15°,层厚3 mm,层间距1.5 mm;DWI (SE-EPI):TR 8000 ms,TE 58.0 ms,FOV 40 cm×28 cm,矩阵96×130,层厚7 mm,层间距1 mm,b值0、600 s/mm2;IVIM (SEEPI):TR 3000 ms,TE 88.4 ms,FOV 40 cm×28 cm,矩阵128×128,层厚7 mm,层间距1 mm,b值为0、20、50、100、150、200、400、800、1200、2000、3000 s/mm2。
1.4 图像分析与数据测量
图像传至GE AW4.6工作站,使用Functool软件对DWI重建,得到ADC图;对IVIM重建,得到Dmono、D*mono、fmono(下文简称D、D*、f)图。在ADC、D、D*、f图上识别HCC的方法:参考LAVA动态增强序列,病灶实性部分动脉期明显强化,门脉期和(或)延迟期强化减弱,即符合快进快出强化方式的病灶判定其为HCC。由2名放射科医师(分别具有5年、7年MRI诊断经验)分别完成如下测量。
1.4.1 传统ROI图像分析与数据测量
在ADC、D、D*、f功能图上HCC最大层面的实性部分(增强扫描有强化的部分)以复制法放置三个面积等大的圆形ROI,避开HCC坏死、囊变、肉眼可见的胆管和大血管,ROI的面积至少覆盖肿瘤实性部分的2/3,距离肿瘤边缘2 mm,避免部分容积效应的影响(图1)。记录三个ROI的信号强度后取均数,均数记作cROI (conventional ROI)。
1.4.2 容积ROI直方图图像分析与数据测量
将功能图导入Omni-Kinetics (GE healthcare)软件,参考DWI (b=600 s/mm2),在ADC图上沿HCC边缘逐层勾画ROI;参考IVIM (b=200 s/mm2)图,在D、D*、f图上沿HCC边缘逐层勾画ROI,将这些ROI分别融合成各自的容积ROI (图1)。ROI包括坏死、囊变,但避开肉眼可见的胆管和大血管。得到容积ROI直方图以及直方图参数,共计14个:最小值(minimum value,min)、最大值(maximum value,max)、均数(mean value,mean)、标准差(standard deviation,std)、全距(range)、偏度(skewness)、峰度(kurtosis)、百分位数(quantile 5th、10th、25th、50th、75th、90th、95th)。
1.5 统计学分析
采用SPSS 25.0和medcalc统计软件。利用组内相关系数(interclass correlation coefficient,ICC)评估2名医师所测结果的一致性,若一致性良好(ICC>0.75),则采取两医师所测结果的均数进行后续统计分析。利用单样本Kolmogorov-Smirnov检验数据的正态性。正态分布的数据以±s表示,用独立样本t检验比较两组间各参数的差异;非正态分布的数据以中位数(上、下四分位数)表示,用Mann-WhitneyU检验比较两组间各参数的差异。将差异有统计学意义的直方图特征代入多因素逻辑回归模型,经过逐步向后剔除法,将剩余特征进行联合。利用受试者工作特征曲线(receiver operating characteristic curve,ROC)进行诊断效能分析,计算曲线下面积(area under curve,AUC)、敏感度和特异度。采用Delong检验比较各参数AUC值的差异是否有统计学意义。P<0.05为差异有统计学意义。

表1 2名观察者测量数据的一致性检验Tab. 1 Consistency test of measurements by two observers

表2 低分化和非低分化HCC的ADC容积ROI直方图参数的比较Tab. 2 Comparison of volumetric ROI histogram parameters of ADC between poorly and non-poorly differentiated HCC
2 结果
2.1 2名观察者测得结果的一致性分析
2名观察者测得结果一致性良好,ICC均>0.75(表1)。
2.2 差异性分析
低分化HCC和非低分化HCC的ADC、D、D*、f容积ROI直方图(图2),以及各直方图参数的差异性比较(表2~5),传统ROI测量值的差异性比较(表6)。低分化HCC的ADCrange、Dstd/range高于非低分化HCC (P<0.05),而Dmin/5th/10th/25th/50th/mean、D*min、fmin低于非低分化HCC(P<0.05)。
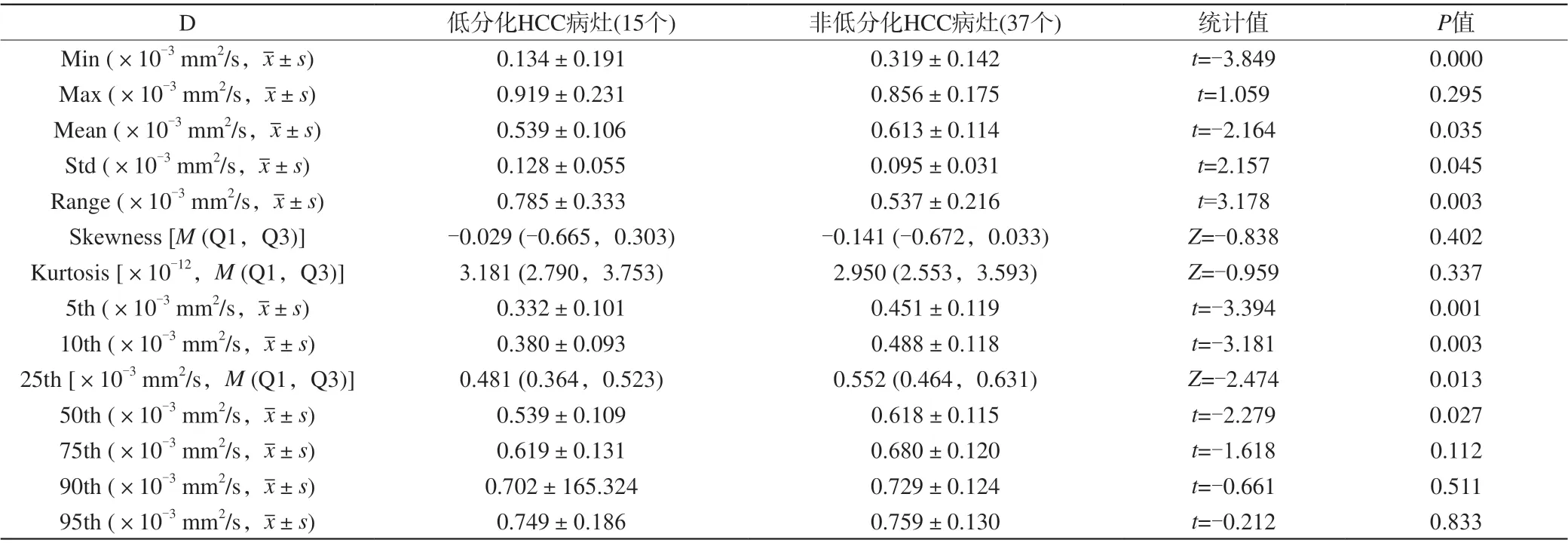
表3 低分化和非低分化HCC的D容积ROI直方图参数的比较Tab. 3 Comparison of volumetric ROI histogram parameters of D between poorly and non-poorly differentiated HCC

表4 低分化和非低分化HCC的D*容积ROI直方图参数的比较Tab. 4 Comparison of volumetric ROI histogram parameters of D* between poorly and non-poorly differentiated HCC

表5 低分化和非低分化HCC的f容积ROI直方图参数的比较Tab. 5 Comparison of volumetric ROI histogram parameters of f between poorly and non-poorly differentiated HCC
2.3 诊断效能分析
将差异有统计学意义的直方图特征(除外min)共8个,代入多因素逻辑回归模型,经过逐步向后剔除法,剩余D5th、D10th、D50th、Drange,然后进行联合诊断,计算公式为:联合模型=0.944-0.057×D5th+0.067×D10th-0.020×D50th+0.005×Drange。

表6 低分化和非低分化HCC的ADC、D、D*、f传统ROI值的比较Tab. 6 Comparison of conventional ROI values of ADC, D, D* and f between poorly and non-poorly differentiated HCC
两组HCC的ADC、D、D*、f值的容积ROI直方图参数以及直方图联合诊断参数Hcom(Histogramcombination)、传统R O I 测量值的R O C 曲线(图3)和诊断效能(表7)。
直方图参数联合诊断后的A U C 值显著高于ADCrange、Dmean、D50th、Dstd的AUC,差异有统计学意义(P<0.05)(表8)。
3 讨论
术前准确识别HCC的病理分化程度,对治疗方案的选择、预后预测尤为重要。IVIM较DWI能够更准确地评估HCC病理分化程度。容积ROI直方图能够反映整个肿瘤的异质性,Wei等[14]已证实容积ROI较单层ROI和三层ROI的诊断效能更高。

表7 ADC、D、D*、f容积ROI直方图参数以及其联合参数、传统ROI值的诊断效能Tab. 7 Discriminant efficiency of volumetric ROI histogram parameters, their combination and conventional ROI value
3.1 b值对直方图参数的影响
b值不同会显著影响直方图的结果。Becker等[17]对8名健康志愿者进行上腹部16种不同b值的DWI扫描,在ADC图像上对肝、肾、脾、胰、脊柱旁肌肉、臀部脂肪进行ROI勾画并进行直方图分析,直方图特征包括变异度、偏度、峰度、熵,结果发现所有器官或组织的ADC的熵值与b值呈负相关,而变异度、偏度、峰度与b值的相关性取决于器官或组织的类型,在肝脏中,ADC值的变异度与b值呈正相关,ADC值的偏度和峰度与b值均呈负相关。总之,b值的变化会影响直方图的结果,为了避免这种影响,本实验选取b值相同的患者进行入组研究。
3.2 DWI、IVIM功能图的容积ROI直方图鉴别HCC分化程度的价值
3.2.1 D容积ROI直方图的鉴别价值
低分化HCC的Dmean/5th/10th/25th/50th显著低于非低分化HCC组(P<0.05)。原因可能为:随着HCC分化程度降低,细胞异型性增大,表现为核质比增高、细胞密度增大,细胞内以及细胞间的水分子扩散更加受限,Dmean/5th/10th/25th/50th减小。
低分化HCC的Dstd高于非低分化HCC组(P<0.05)。原因可能为:(1)随着HCC分化程度降低,肿瘤细胞更具有多形性(①核呈多形性:细胞核失去正常的对称性核分裂象,而表现为非对称的病理性核分裂象;②细胞呈多形性:细胞体积失去正常的一致性,而表现为形态和大小各异),这种多形性导致肿瘤内异质性增加,进而细胞内和细胞间水分子扩散受限程度呈不均一性,Dstd增大。(2)随着HCC分化降低,HCC更易坏死囊变,实性和囊性成分中水分子扩散速率的差异很大,导致Dstd增大。
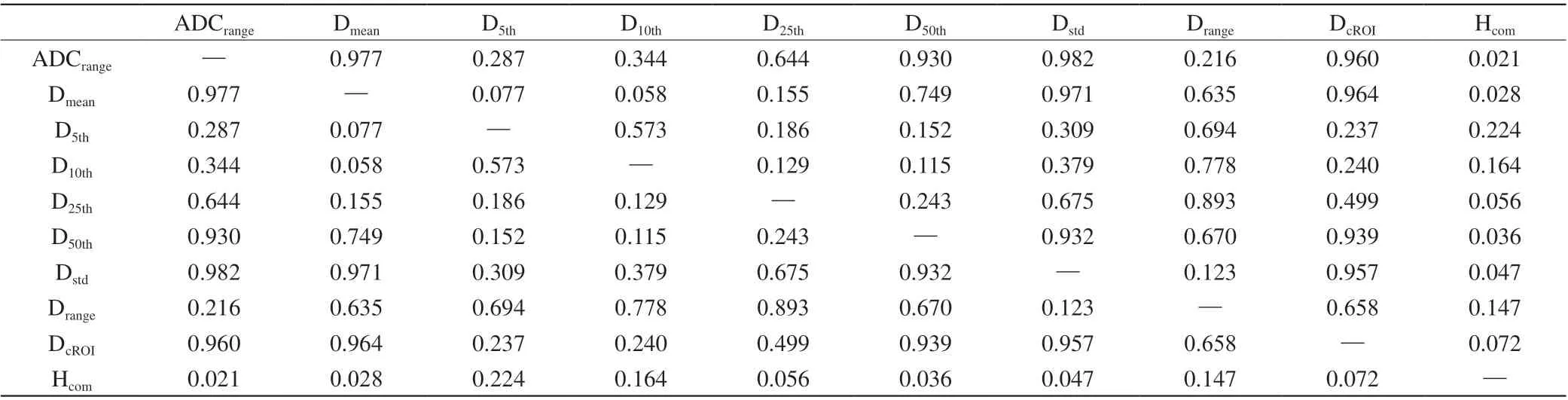
表8 容积ROI直方图参数以及其联合参数、传统ROI值的AUC值的比较Tab. 8 Comparison of AUC of volumetric ROI histogram parameters, their combination and conventional ROI value
低分化HCC组的Drange高于非低分化HCC组(P<0.05),原因可能为:低分化HCC更易囊变坏死,该区域水分子扩散运动几乎不受限,max增大,因range=max-min,故Drange增大。
3.2.2 ADC容积ROI直方图的鉴别价值
低分化HCC组的ADCrange高于非低分化组HCC (P<0.05),原因类似两组Drange差异的原因。另外,笔者观察到ADC直方图其他参数的分布趋势类似于D,即低分化HCC组的ADCquantile/mean更小,而ADCmax/std更大(表2),但两组间差异性无统计学意义,这体现了IVIM较DWI的优势所在:ADC值不仅受到水分子扩散的影响,还受到微循环灌注的影响。而IVIM能够将ADC分解为水分子扩散成分D和微循环灌注成分D*、D值不受微循环灌注的干扰,能够较ADC更准确地评估水分子扩散运动情况,进而提高对HCC分化程度的诊断效能。
3.3 DWI、IVIM功能图的传统ROI鉴别HCC分化程度的价值
本研究显示,低分化HCC的DcROI低于非低分化HCC (P<0.05),而ADCcROI、D*cROI、fcROI在两组HCC间的差异无统计学意义(P>0.05),低分化HCC的DcROI相对较低是因其细胞的核质比和细胞密度相对较高。Yang等[7]、Zhu等[8]、Sokmen等[18]、Shan等[19]研究均显示,低分化HCC的ADCcROI和DcROI低于其他分化HCC,D*cROI异无统计学意义,而fcROI结果不同:Yang等[7]和Zhu等[8]研究显示两组HCC间fcROI的差异无统计学意义;Sokmen等[18]研究显示低分化HCC的fcROI较低;Shan等[19]研究显示低分化HCC的fcROI反而较高。综上研究:DcROI能够评估HCC分化程度而D*cROI不能;ADCcROI、fcROI结果不同。ADCcROI、fcROI结果不同可能是因其包含微循环灌注成分,而微循环灌注受如下多因素影响使两参数不稳定:检查前进餐与否影响门静脉流速,进而影响HCC微循环灌注;部分HCC会导致门静脉瘤栓,进而使HCC微循环灌注下降;肝内胆汁流动亦属于快扩散成分,不同患者胆管疏密程度以及胆汁流速各异会导致与微循环灌注相关的参数的变化。由此可见,ADCcROI、fcROI对HCC分化程度评估的价值,仍需更多研究来证实。
3.4 DWI、IVIM功能图的容积ROI直方图以及其联合诊断、传统ROI的诊断效能的对比
目前尚未见有学者将IVIM容积ROI直方图用于HCC分化程度的评估。本研究结果表明,IVIM容积ROI直方图较传统ROI的AUC值的差异虽无统计学意义(P>0.05),但将IVIM容积ROI直方图的多个定量参数联合后,AUC值高于IVIM容积ROI直方图单个特征(P<0.05),诊断效能有所提高,另外,多参数联合可从多角度反映肿瘤的异质性,对HCC分化程度的判断更加准确。
3.5 本研究的局限性
第一,本研究是回顾性研究,两组的样本量可能存在偏倚。第二,在原始数据中,部分患者的ADC、D、D*、f的容积ROI直方图的min出现了不符合逻辑的负值,故笔者未探讨min的诊断效能,出现负值的原因可能为图像噪声所致。第三,穿刺或术后病理结果存在抽样误差,即无法判断肿瘤各部位的分化程度,因此对于HCC患者“低分化、非低分化”的分组,可能存在一定误差。第四,为了避免不同机型对结果造成影响,本研究只对使用同一机型检查的患者进行研究,在后续研究中将进一步探讨不同机型对结果稳定性的影响。
综上,IVIM容积ROI直方图能够术前评估HCC病理分化程度,将D5th、D10th、D50th、Drange进行联合后,诊断效能有所提高。
利益冲突:无

