PCT与凝血指标在重症ARDS患者预后判断中的应用价值
李洪 蒋红英 庄乐 周丹 陆岑琳
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种以急性呼吸衰竭为特征的威胁生命的临床综合征,临床表现常为顽固性低氧血症及呼吸窘迫[1-2]。降钙素原(procalcitonin,PCT)是降钙素的前体,它参与了机体中复杂的炎症级联反应,血清PCT水平也常作为许多感染性疾病的炎症严重程度的评价指标[3]。最新研究认为[4-5],凝血和纤溶系统功能紊乱在ARDS的发病机制中也发挥了重要作用。本研究通过分析ARDS患者血清PCT及凝血指标的变化,评价其在患者预后预测中的价值和临床意义。现报告如下。
临床资料与方法
一、一般资料
纳入标准:(1)ARDS诊断符合柏林定义标准[6]。(2)年龄>18岁。排除标准:(1)患有难以控制的糖尿病、心脑血管疾病、肾功能不全、慢性阻塞性肺疾病等严重疾病。(2)患有血液系统疾病、自身免疫性疾病,或使用免疫抑制剂治疗。(3)孕产妇或患有其它严重精神或心理疾病,检查不配合。(4)预计入院30 d内可能发生死亡者。(5)病历资料不完整、未定期复查或未完成随访。
共纳入2016年1月至2019年12月在常州市武进中医医院重症监护病房(intensive care unit,ICU)住院治疗的ARDS患者60例进行回顾性临床研究,其中男性 34例,女性26例;年龄 34~75 岁,平均( 55.8±11.2)岁。
二、方法
对符合纳入与排除标准的患者进行随访,将患者按照入院30 d时是否死亡,分为生存组(36例)与死亡组(24例)。生存组患者年龄34~72岁,平均(55.4±10.7)岁;包括男性20例,女性16例;原发病因分别为肺部感染14例(38.9%),肺外感染12例(33.3%),创伤6例(16.7%),其他4例(11.1%)。死亡组患者年龄36~75 岁,平均(56.3±11.8)岁;包括男性14例,女性10例;原发病因分别为肺部感染9例(37.5%),肺外感染8例(33.3%),创伤4例(16.7%),其他3例(12.5%)。两组患者在年龄、性别构成、体质指数(body mass index,BMI)、原发病因方面差异均无统计学意义(P>0.05),见表1。

表1 两组重症ARDS患者的基线资料对比[例(%)]
三、观察指标
(一)临床资料
根据病历系统数据,收集所有ARDS患者的年龄、性别、身高、体重、原发病因等资料,并且评估急性生理和慢性健康评分(acute physiological and chronic health evaluation,APACHE Ⅱ)和肺损伤评分(Murray 评分)等临床参数。
(二)PCT水平
在患者确诊ARDS后的24 h内采集外周静脉血10 mL,分离血清检测血清PCT水平。
(三)凝血功能
运用全自动血凝分析仪检测凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinogen,FIB)、D二聚体(D-dimer,DD)等指标。
四、统计学分析
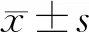
结 果
一、临床评分及血清学分析结果
死亡组患者的APACHEⅡ评分、Murray评分,血清PCT、PT、APTT、DD均高于生存组,但FIB水平低于生存组,差异均有统计学意义(P<0.05);TT与生存组的差异无统计学意义(P>0.05)。见表2。

表2 两组重症ARDS患者的临床指标及血清学检测结果对比
二、血清学检测结果与临床指标的相关性
Pearson相关性分析显示,ARDS患者的血清PCT、PT、APTT、DD与APACHEⅡ评分和Murray评分均呈显著正相关(P<0.05),FIB与APACHEⅡ评分和Murray评分均呈显著负相关(P<0.05),见表3。
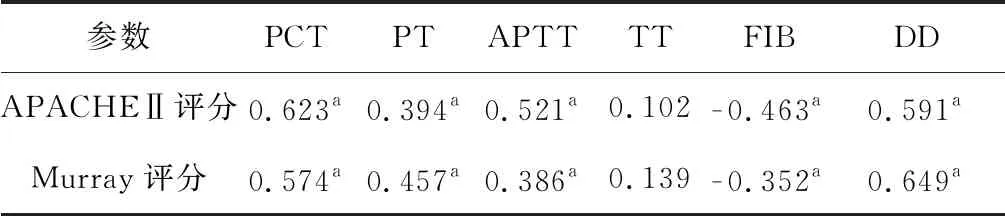
表3 60例重症ARDS患者的血清学检测结果与临床指标的相关性分析(r值)
三、血清学检测结果对患者死亡的预测价值
笔者选择了与APACHEⅡ评分和Murray评分有显著关联的PCT、PT、APTT、DD、FIB指标,绘制了预测ARDS患者30 d死亡的ROC曲线。结果显示,PCT、PT、APTT、FIB、DD的曲线下面积(AUC)分别是0.91、0.83、0.80、0.83、0.85,PCT联合PT、APTT、FIB、DD的预测预后的AUC是0.96,显著高于各单一指标的预测价值(表4),ROC曲线见图1。
讨 论
目前研究认为,ARDS不仅是一种肺部疾病综合征,而是全身炎性反应的表现。其本质是以炎性介质过度释放为特征的广泛性炎性反应,是一系列复杂事件的级联反应,涉及到许多细胞类型(巨噬细胞、中性粒细胞、单核细胞、树突细胞和肥大细胞等)及相关分子产物(前列腺素、细胞因子、核因子κB、趋化因子等)[7-8]。当全身性炎症因子随血液进入肺组织,引起肺泡上皮细胞和血管内皮细胞损伤,造成肺内促炎与抗炎平衡失调,最终可导致危及生命的急性呼吸衰竭。此外,炎症反应程度越重,对肺组织造成的损伤也越严重,而ARDS患者的预后也越差[9]。
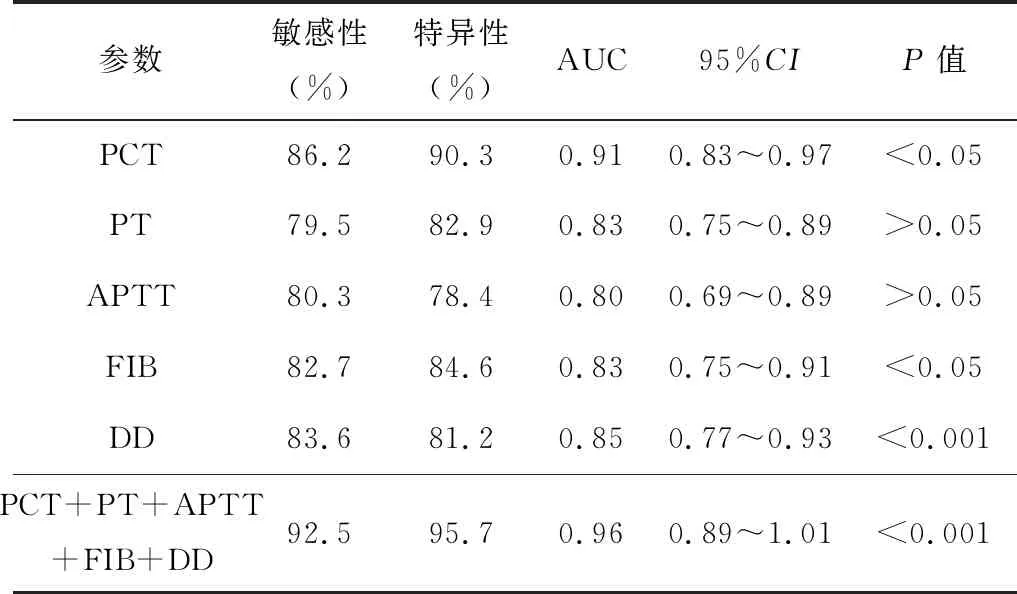
表4 PCT与凝血指标对ARDS患者死亡预测的ROC曲线分析

图1 PCT与凝血指标预测ARDS患者30 d死亡的ROC曲线
降钙素原(procalcitonin,PCT)由Canale等[10]在1975年首先报道,它是降钙素的前体分子。健康人血清PCT水平极低,只有在全身性严重感染情况下,其水平才会立即升高。有关社区获得性肺炎患者的临床试验报道,入院24 h内,患者的血清PCT值迅速升高,其高水平可维持达1周时间[11]。Sharma等[12]对ICU住院的重症肺炎患者研究发现,血清PCT值升高还与感染性休克、多器官功能障碍和患者死亡率增加密切相关。也有学者对社区获得性肺炎患者开展研究发现,预后不良的患者在第1、3和7天的血清PCT水平较高,PCT水平持续升高则预示死亡风险增加。因此,血清PCT值可用于评价炎症反应程度和临床结局[13]。本研究观察到ARDS患者的血清PCT与APACHEⅡ和Murray评分呈正相关,且死亡组患者的血清PCT高于生存组,也证实随着PCT水平增高,ARDS患者的肺功能越差,预后也越不佳,与既往文献结论相符合。
凝血和纤溶系统已被认为是炎症反应的重要组成部分。许多炎性细胞因子,例如白细胞介素-6(interleukin-6,IL-6)、IL-8和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),可以激活凝血系统以及抑制纤溶系统,引起抗凝成分减少或活性下降,导致血管床内广泛的纤维蛋白沉积,甚至出现严重的弥漫性血管内凝血(disseminated intravascular coagulation,DIC)[14]。在ARDS的发病过程中,炎症介质和凝血级联反应之间的相互作用导致了肺泡内纤维蛋白沉积,进而使肺泡表面活性剂失活并干扰气体交换,促进肺泡纤维化的发生,使得患者的肺功能进一步受损[15]。Amory等[16]通过尸检研究发现,ARDS患者的肺部毛细血管聚集了大量纤维蛋白降解产物,存在显著的毛细血管栓塞与微循环障碍,并且使血管内皮细胞变性和通透性增加。PT和APTT是凝血功能的常用评价指标。当Ⅴ、Ⅶ、Ⅹ因子减少时,PT会延长,表明外源性凝血途径存在异常;当除Ⅶ或ⅩⅢ因子以外的凝血因子减少时,APTT会延长,这表明内源性凝血途径存在异常。本研究中,ARDS患者的PT、APTT延长与肺功能下降存在关联,死亡组患者的PT、APTT也高于生存组,表明ARDS患者存在内源性和外源性凝血系统紊乱,且凝血功能障碍与临床结局密切相关。DD是纤维蛋白原的降解产物,其与纤维蛋白原均是纤溶系统的反映指标[17]。本研究发现,死亡组患者的FIB水平降低而DD水平升高,提示存在继发性纤溶亢进,纤维蛋白原消耗增多。既往有学者报道,ARDS患者肺泡灌洗液中的DD水平显著增高,提示在肺泡上皮存在继发性纤溶过程的激活,本研究的结果也证实了这一点。
有学者对ARDS患者大量使用抗凝血酶Ⅲ、活性蛋白C治疗,远期的死亡率也显著低于对照组患者,他们认为逆转炎症、凝血和纤溶系统异常反应可能会延缓ARDS的进展[18]。这也反映出炎症及凝血系统在ARDS病理生理机制中发挥的重要作用。本研究采用的ROC曲线能够反映连续性变量的敏感度和特异度。曲线下面积越大,表明对ARDS的预后判断越有意义。结果发现,PCT联合PT、APTT、FIB、DD对ARDS患者死亡的预测敏感度和特异度均高于单一指标,具有临床应用价值,也进一步表明炎症反应与凝血和纤溶系统变化在ARDS发病机制中的重要作用。
综上所述,本研究发现血清PCT以及PT、APTT、FIB、DD凝血指标与ARDS患者的肺损伤程度密切相关,且PCT联合凝血指标对ARDS患者预后判断的准确性高,具有临床推广价值。

