高孕激素下促排卵方案在POR患者IVF/ICSI助孕中的应用
周冬梅,宋 晖,滑 玮,黄艳红
(空军军医大学第一附属医院生殖中心,陕西 西安 710032)
随着二胎政策的开放,越来越多的高龄女性想通过辅助生殖技术再次实现生育的愿望。而高龄往往伴随着在促排卵过程中出现卵巢低反应(poor ovarian resposnse,POR)的情况。有报道称在促排卵过程中POR的发生率为5.6%~35.1%[1]。POR表现为卵巢对促性腺激素刺激的反应低下、获卵少、胚胎质量差、周期取消率高、体外受精(in vitro fertilization,IVF)结局差,这给患者带来较大的经济负担和心理压力。因此为这类患者选择更合适的促排卵方案就显得尤为重要。目前国内POR的患者多采用微刺激或拮抗剂方案,但微刺激方案容易出现早发黄体生成素(luteinizing hormone,LH)峰,引起提前排卵或卵泡黄素化,影响取卵率和卵子质量,使助孕周期取消率增加。而拮抗剂药物费用高,且常出现药物短缺,使该方案无法在临床上广泛应用。
随着胚胎冷冻技术的进步,冷冻胚胎复苏率有了显著的提高,使辅助生殖治疗过程中不用再顾虑取卵后立即要移植新鲜胚胎的问题。Kuang等[2]首次提出了卵泡期高孕激素下促排卵方案(progestin primed ovarian stimulation,PPOS),该方案能够有效抑制早发LH峰,获得良好的妊娠结局。匡国平教授的团队将此方案用于卵巢功能正常患者也取得了成功的经验[3]。本研究拟在POR患者中比较卵泡期PPOS方案与微刺激方案的实验室结局,为POR患者选择助孕方案提供临床依据。
1 研究对象与方法
1.1 研究对象
回顾性分析2018年1至10月在空军军医大学第一附属医院生殖医学中心接受体外受精/卵胞浆内单精子注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)助孕的POR患者的临床资料,共59个周期。根据临床方案不同分为PPOS组(34例)和微刺激组(25例)。纳入标准:所有入组患者均符合POR博洛尼亚诊断标准[4],以下3条中至少符合2条:①高龄(≥40岁)或存在卵巢反应不良的其他危险因素;②前次IVF周期POR(常规方案获卵数≤3个);③卵巢储备下降[窦卵泡<5~7个或抗苗勒氏管激素(anti-Mullerian hormone,AMH)<0.5~1.1μg/L]。排除标准:染色体异常患者;甲状腺功能异常、结核及其他全身性疾病患者。
1.2 促排卵方案
PPOS方案:自月经第2天起口服安宫黄体酮(medroxy-progesterone acetate,MPA,2mg/粒,国药准字H33020715)10mg/d,克罗米芬(50mg/片,国药准字H50020039)50mg/日。月经第3天开始注射促性腺激素(gonadotropin,Gn)150~300IU/d。根据卵巢反应调整Gn用量,安宫黄体酮和克罗米芬用量不变。根据卵泡大小、血清激素水平确定扳机时间,当有1个卵泡≥18mm或2个卵泡≥17mm时,同时停用安宫黄体酮、克罗米芬和Gn,注射人绒毛膜促性腺激素(hCG,2 000IU/支,国药准字H44020673)10 000 IU扳机,34~36h后经阴道超声引导取卵。
微刺激方案:月经第2~4日开始使用来曲唑(2.5mg/片,国药准字H19991001)5.0mg/d,共5天;5d后根据B超监测情况添加尿促性素针(hMG,乐得宝,75IU/支,国药准字H10930135)75~150IU/d,用至扳机日停药。其余同PPOS方案。监测过程中若出现早发LH峰,根据卵泡大小、激素水平,紧急取卵。在此研究中,PPOS组紧急取卵者1人,微刺激组紧急取卵者2人。两组方案患者扳机次日均复查LH、雌激素、孕激素及β-hCG水平,若雌激素水平下降50%以上,复查超声,紧急取卵。在此研究中两组患者均无此类情况出现。
1.3 观察指标及定义
卵泡输出率=hCG注射日≥14mm卵泡数/窦卵泡数×100%;早发LH峰=hCG注射前LH值较基础值升高2倍以上;卵子利用率=可移植胚胎数/卵子总数×100%;周期取消率=(未取卵周期+未获卵周期+无可移植胚胎周期数)/促排卵总周期数×100%。观察指标还包括患者一般情况、促排卵周期的情况和临床结局。
1.4 统计学方法
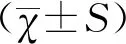
2 结果
2.1 患者一般资料比较
两组患者的年龄、不育年限、BMI、基础FSH、基础LH、基础E2水平比较差异均无统计学意义(均P>0.05),具有可比性。窦卵泡数(antral follicle counting,AFC)和AMH的水平PPOS组略高于微刺激组,差异均有统计学意义(t值分别为2.44、2.61,均P<0.05),见表1。
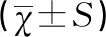
表1 两组患者一般资料比较Table 1 Comparison of basic data of the patients between the two
2.2 患者促排卵情况比较
Gn天数、hCG日E2和P水平、hCG日优势卵泡数、卵泡输出率在两组间比较差异均无统计学意义(P>0.05)。PPOS组的Gn总量高于微刺激组,扳机日LH水平低于微刺激组,差异均有统计学意义(t值分别为7.51、-3.26,均P<0.05);早发LH峰率低于微刺激组,但差异无统计学意义(P>0.05),见表2。

表2 两组促排卵情况比较Table 2 Comparison of ovarian stimulation and ovulation induction outcomes between the two groups
2.3 两组患者临床结局比较
获卵数、授精数、正常受精(two pronucleus,2PN)数两组间比较差异均无统计学意义(均P>0.05)。可移植胚胎数和卵子利用率PPOS组均高于微刺激组,差异均有统计学意义(t=3.05,χ2=9.40,均P<0.05),周期取消率PPOS组低于微刺激组,差异无统计学意义(P>0.05),见表3。

表3 两组临床结局比较Table 3 Comparison of clinical outcomes of the patients between the two
3 讨论
随着辅助生殖技术的发展,IVF/ICSI已成为治疗不孕症的主要方法。控制性促排卵是IVF中的关键环节,其结局与卵巢反应性密切相关。然而随着现代社会经济的发展,女性生育年龄越来越大,高龄患者在控制性促排卵过程中更易出现POR,且POR有年轻化趋势[5]。POR是一种卵巢对外源性Gn刺激不敏感的病理状态,往往造成周期取消率高、获卵数少、不良妊娠结局发生率高等不良临床结局。近年来,有关于不同的促排卵方案改善POR患者的临床结局的研究,针对POR患者的促排卵方案主要有微刺激方案、短方案、拮抗剂方案、自然周期取卵和黄体期促排卵方案等[6]。但对这类患者的治疗,目前仍无获得良好临床结局的最佳方案。
3.1 POR患者的早发LH峰问题
早发LH峰是导致POR患者周期取消率高的一个主要原因。早发LH峰的发生机制尚未明确。有文献报道称卵巢储备功能减退是早发LH峰出现的主要危险因素[7],考虑与小卵泡数目减少,分泌促性腺激素弱化因子(gonadotropin surge-attenuating factor,Gn-SAF)活性下降,不能有效控制LH分泌,从而造成早发LH峰有关[8-9]。因此POR患者在促排卵过程中控制好早发LH峰是获得良好临床结局的关键。有研究提出的卵泡期PPOS方案是一种新型的促排卵方案,他们将该方案用于卵巢储备功能正常患者及多囊卵巢综合征患者中均能有效抑制LH峰[10]。同时其他报道发现,PPOS方案用于POR患者也能够抑制LH峰,使多数患者获得可移植胚胎,降低周期取消率,改善实验室结局[11-13]。本文的观察结果与这些结果一致。本研究发现,PPOS组早发LH峰率明显低于微刺激组,且hCG日LH水平也显著低于微刺激组。观察中发现PPOS组有3例出现早发LH峰,其中1例扳机后24小时紧急取卵,获卵1枚,形成可移植胚胎1枚。微刺激组有5例出现早发LH峰,其中2例扳机后24小时紧急取卵,其中1例无可移植胚胎。由此可见,对于POR患者,PPOS方案对早发LH峰的出现有降低趋势,且能明显降低扳机日LH的水平,是此类患者较理想的促排方案之一。
3.2 PPOS方案对POR患者临床结局的影响
POR患者在超促排卵过程中,相对于卵巢正常反应患者而言,容易出现周期取消率高、获卵数和可移植胚胎数少及胚胎质量差等问题。因此,选择合适的促排方案使POR患者获得良好的临床结局是生殖医生一直关注的热点。
本研究结果提示,可移植胚胎数和卵子利用率PPOS组明显高于微刺激组,差异有统计学意义(P<0.05),这可能与PPOS组患者的卵巢功能较微刺激组稍好一些有关,因为PPOS组患者AMH和窦卵泡数较微刺激组稍高。此外,PPOS组的周期取消率比微刺激组低。总体来讲,PPOS方案可有效抑制POR患者的早发LH峰,避免由此带来的周期取消率高和不良妊娠结局发生率高的问题。
3.3 不足之处
本研究的不足之处是样本量较少,分析结果可能存在一定偏差,还需要大样本、多中心、前瞻性、随机对照研究,进一步对PPOS方案在POR患者中的应用效果进行深入探讨。同时,我中心采用PPOS方案较晚,而且研究中多数POR患者可能需要经过多个促排周期来积攒胚胎,因此大多患者尚未完成移植,所以研究中缺少妊娠相关情况分析。在以后的临床工作中,我们会继续追踪这些患者,观察妊娠情况。
综上所述,PPOS方案可有效抑制早发LH峰,使多数患者获得可移植胚胎,为POR患者提供了一种新型有效的促排方法。

