心脏瓣膜置换术后低心排综合征危险因素的调查分析
高敏
心脏瓣膜病是老年群体常见的心血管疾病,高龄、风湿、冠心病、心肌梗死均为常见病因。随着术中监护、手术技术的进步,心脏瓣膜置换术已成熟用于各类心脏瓣膜病,但术后各类并发症仍是影响手术预后的重要原因[1-2]。李伟等[3]报道,体外循环、主动脉阻断时间较长是术后低心排综合征(LCOS)的主要危险因素,但事实上即使在良好的术中监护下,术后仍可能因钠潴留、心律失常等引起LCOS,因此,本研究纳入104例心脏瓣膜置换术患者为研究对象,调查术后发生LCOS的高危因素并提出针对性预防措施,现报道如下。
1 资料与方法
1.1 临床资料
选择2018年7月到2019年7月本院104例心脏瓣膜置换术患者为研究对象。纳入标准[4]:均因瓣膜病变进行心脏瓣膜置换术;年龄60~80岁;无心脏手术史;无恶性心率失常、严重心力衰竭等心脏疾病史;患者或家属对本研究知情;围术期病历资料完整。排除标准:合并急性脑卒中、全身感染、恶性肿瘤等严重疾病;住院期间死亡;手术失败。男59例,女45例;年龄61~78岁,平均(70.76±3.98)岁;术前纽约心功能分级(NYHA)Ⅱ级45例,Ⅲ级44例,Ⅳ级15例;单瓣膜置换50例,双瓣膜置换54例;合并疾病:高血压38例,冠心病史27例,糖尿病21例,肾功能不全23例。
1.2 方法
LCOS诊断标准[5]:较术前基础收缩压下降超过20%,持续时间超过2 h;尿量低于<0.5 ml/(kg·h),持续时间超过2 h;中心静脉压超过1.73 kPa,持续时间超过2 h;体表体温与中心体温差值超过5℃,持续时间超过2 h,四肢发凉;心脏指数(CI)低于2.5 ml/m2。具备以上5条中的2条及以上即可诊断为LCOS。查阅既往关于LCOS危险因素相关文献,排除心脏解剖结构、外科医师操作后的潜在围术期危险因素[6-7]后包括:体质量过轻(BMI<18.5 kg/m2)、术后心律失常、术前NYHA分级、围术期失血过多(失血量>总血量20%)、电解质紊乱、年龄、冠心病史、合并高血压。以是否发生LCOS为多因素logistic回归分析因变量,上述潜在危险因素为自变量,调查心脏瓣膜置换术后LCOS危险因素。
1.3 统计学处理 采用SPSS 22.00统计学软件,使用logistic回归分析(前进法)进行影响因素分析。入选标准α=0.05。
2 结 果
2.1 变量赋值表(表1)
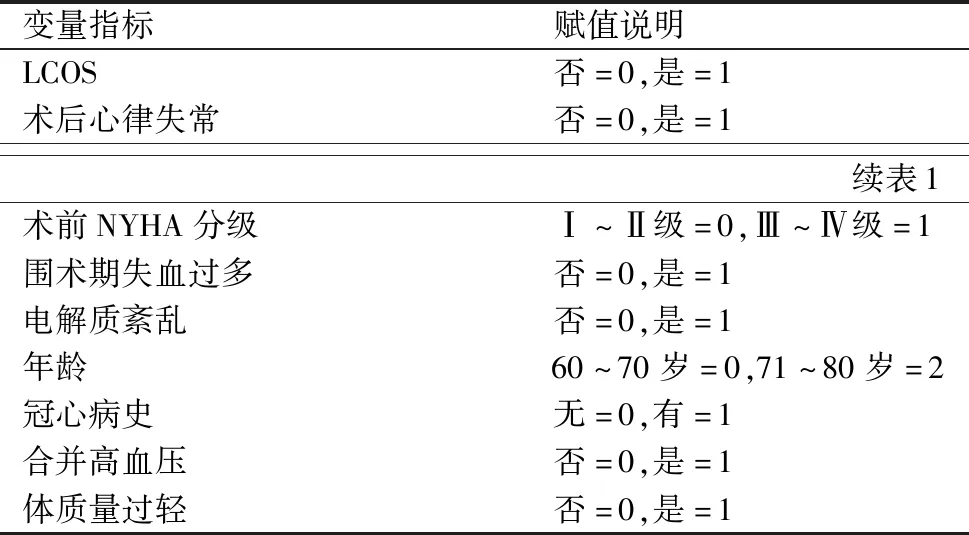
表1 多因素分析变量赋值表
2.2 心脏瓣膜置换术患者术后LCOS多因素logistic回归分析
本组患者术后发生LCOS 26例,发生率25.00%;以是否发生LCOS为因变量,术后心律失常、术前NYHA分级、围术期失血过多、电解质紊乱、年龄、冠心病史、合并高血压为自变量进行多因素logistic回归分析,结果显示,体质量过轻、术前NYHAⅢ~Ⅳ级、围术期失血过多、电解质紊乱是心脏瓣膜置换术患者术后发生LCOS高危因素,见表2。

表2 心脏瓣膜置换术患者术后LCOS多因素logistic回归分析
3 讨 论
术后LCOS是指心脏瓣膜置换术后,短时间经过常规治疗及护理纠正非心脏因素后仍发生低心排相关血液动力学特征及临床表现,心脏直视术后LCOS 是早期死亡的独立危险因素,死亡原因以体循环血流量不足,无法满足器官灌注为主[8]。本研究发生率为25.00%,与Shen等[9]报道的LCOS发生率一致,也提示有必要针对LCOS进行专项预防护理。
成年人BMI<18.5 kg/m2判定为体质量过轻,术前体质量并非心脏瓣膜置换术的绝对手术禁忌证,但低体质量患者术后不良并发症的风险更高。体质量过轻者总血容量相对较少,在体外循环时容易出现控制性休克状态,在经历长时间主动脉阻断、术后心律失常等情况后,身体器官有效灌注下降,严重干扰机体正常代谢,可因心肌长时间缺血造成心肌受损,进而发生LCOS[10]。因此,针对体质量过轻的心脏瓣膜置换术患者,围术期需要积极监测全身血容量,使用血栓弹力图分析仪指导输血,以保证足够的有效输血量;体外循环结束时通过激活全血凝固时间(ACT)管理鱼精蛋白、肝素的使用,尽快使ACT 恢复;提高心脏、肺等身体器官有效灌注[11]。
术前NYHAⅢ~Ⅳ级提示患者心功能较差,一方面影响术中心肌保护作用,加重手术损伤,增加术后LCOS风险;术后射血分数不足容易造成心肌纤维化、心室扩大,加重心室重构,对心肌收缩力、传导功能、电活动均造成严重影响,从而引发LCOS,严重者甚至出现心脏骤停[12]。因此针对术前心脏功能较差者,尤其是NYHAⅣ级患者可进行预防性心脏功能训练。进行运动心肺测试(CPET)计算峰值摄氧量(VO2peak),根据患者耐受性选择进行呼吸器训练、四肢联动、蹬梯训练等增加心肌储备,提高心脏功能,术前NYHAⅢ级患者训练强度不超过80%VO2peak,Ⅳ级者不超过60VO2peak,以保证心脏功能训练的安全性[13]。
围术期失血过多直接影响机体的携氧能力,并引起术后动脉血压下降,冠脉灌注不足,导致不同程度心肌缺氧、缺血,进而影响心肌功能。手术失血>20%总血容量会因心脏压塞对血液回心、心脏跳动产生抑制作用,导致急性循坏衰竭[14]。对于失血量较大者,需积极进行血容量补充,中心静脉压保持在12~15 cmH2O(1cmH2O=0.098 kPa),平均动脉压80~90 mmHg,尿量1~2 ml/(kg·h),保证脏器有效灌注,补液以白蛋白、血浆等胶体液为主,控制晶体液摄入,防止前负荷过大。术中失血过多时还需预防腔静脉梗死,采用中凹卧位,即上半身、下半身分别抬高45和30°,呈“V”字体位2~3 d,以利于胸腔引流以及腔静脉回流,增加肺循环血量[15]。
电解质紊乱对LCOS的发生及发展也具有明显影响,例如,心肌细胞复极化时存在钾离子流失,若血钾水平较低,则心肌细胞复极时间延长,不仅造成心肌细胞损伤,还会增加恶性心律失常风险,而钠潴留是心脏瓣膜置换术心力衰竭的重要原因[16]。因此术后需要严格监测血钾、镁及钠水平,低钾症者可进行静脉补钾、超声雾化补钾,钠潴留者严格控制液量,降低水钠潴留,术后第1天补液量:体质量的第1个10 kg为2 ml/(kg·h),第2个10 kg为1 ml/(kg·h);第2天生命体征平稳后为4 ml/(kg·h)。
综上所述,心脏瓣膜置换术后易发生LCOS,影响因素包括体质量过轻、术前心功能、失血、电解质紊乱等,应开展围术期针对性护理措施,以降低LCOS发生率,改善心脏瓣膜置换术预后。

