黑米花色苷微胶囊的制备
赵丽艳,王磊,任婷,刘长姣
(吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春130507)
黑米是脱去谷壳的黑色糙米,具有很高的营养价值,有“补血米”,“神仙米”等的美称[1]。研究表明,黑米具有许多功能,如清除人体自由基、辅助治疗缺铁性贫血、改善人体的免疫调节等[2-3]。研究证实,黑米所表现出来的生理保健作用主要与黑米中富含的花色苷色素有关。研究人员发现花色苷对肠道益生菌,如双歧杆菌、嗜酸乳杆菌等具有增殖作用,对金黄色葡萄球菌、大肠杆菌等有害菌具有抑制作用,但花色苷属小分子物质,在上消化道就会被吸收,难以到达肠道[4]。因此,人体食用花色苷后,如何使其能够顺利到达肠道,起到促进肠道益生菌增殖作用,是花色苷开发利用需要解决的问题之一。
近年来,微胶囊技术已应用到食品领域,它是一种可以限制目标成分与系统其它部分或与外部环境之间的接触,以达到保护及控制等效果的技术[5-6]。本文将利用微胶囊造粒机制备黑米花色苷微胶囊,并探讨其在胃肠模拟液中的释放性质,同时考察其在自然光和空气中存放的稳定性,为黑米花色苷的开发利用提供研究基础。
1 材料与方法
1.1 材料与试剂
矢车菊素-3-葡萄糖苷对照品:上海市源叶生物科技有限公司;黑米花色苷提取物(花色苷含量25%):西安瑞盈生物科技有限公司;海藻酸钠(直径0.15mm):瑞士步琦有限公司;氯化钙、乙醇(均为分析纯):北京化工厂;试验用水为蒸馏水。
1.2 仪器与设备
B-390微胶囊造粒机:瑞士步琦有限公司;I5分光光度计:济南海能仪器股份有限公司;CP214电子天平:常州市奥豪斯仪器有限公司;WH-2微型旋涡混合仪:上海沪西分析仪器厂有限公司;THZ-92A气浴恒温振荡器:上海博讯医疗生物仪器股份有限公司。
1.3 微胶囊制备工艺流程和操作要点
微胶囊制备工艺流程见图1。
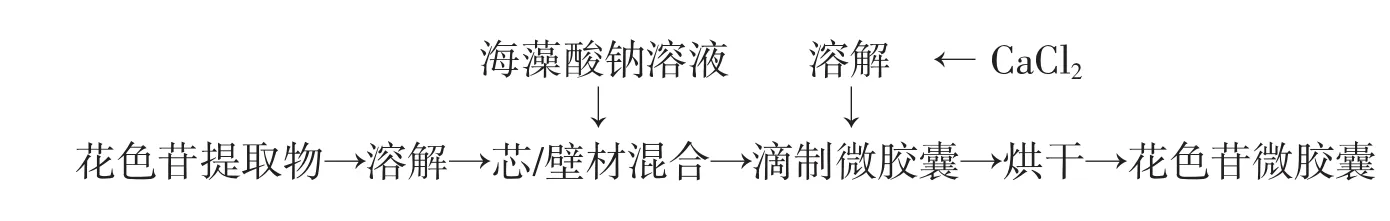
图1 微胶囊制备工艺流程Fig.1 The processing of microcapsules
1)海藻酸钠溶液:按照设计称取适量海藻酸钠,加入约90℃水中溶解,混合均匀后冷却至室温(20℃),加水定容至100 mL,配制成不同浓度的海藻酸钠溶液,作为壁材[7]。
2)氯化钙溶液:按照设计称取适量氯化钙,加水溶解并定容至100 mL,配制成不同浓度的氯化钙溶液。
3)壁芯混合液:准确称取适量黑米花色苷提取物,分别与按照试验设计的壁芯质量比与海藻酸钠溶液混合,均质5min得壁芯混合液。
4)微胶囊滴制:按照试验设计选择所需的壁芯混合液、喷头孔径、氯化钙溶液,设备5号电极、频率为190 Hz、壁芯混合液流速为9.5 mL/min。
1.4 黑米花色苷微胶囊的制备试验设计
1.4.1 喷头孔径对微胶囊中花色苷包埋率的影响
称取2.67 g黑米花色苷提取物粉末,置于4.0%海藻酸钠溶液中,配制成壁芯比为3∶1的壁芯混合液,均质 5 min,选择孔径分别为 0.1、0.3、0.45、0.75、1.0 mm的喷头,在制粒条件稳定后,用3.0%氯化钙溶液接收,计时制粒1 min,利用分光光度法测量氯化钙中花色苷含量,计算包埋率。
1.4.2 壁芯比对微胶囊中花色苷包埋率的影响
称取2.67 g黑米花色苷提取物,置于4.0%海藻酸钠溶液中,配制成壁芯比分别为 2 ∶1、3 ∶1、4 ∶1、5 ∶1、6∶1的壁芯混合液,均质5 min,喷头孔径为0.45 mm,制粒条件稳定后,用3.0%氯化钙溶液接收,计时制粒1 min,利用分光光度法测量氯化钙中花色苷含量,计算包埋率。
1.4.3 海藻酸钠浓度对微胶囊中花色苷包埋率的影响
称取2.67 g黑米花色苷提取物,置于浓度分别为2.0%、3.0%、4.0%、5.0%和6.0%的海藻酸钠溶液中,配制成壁芯比为3∶1的壁芯混合液,均质5 min,喷头孔径为0.45 mm,制粒条件稳定后,用3.0%氯化钙溶液接收,计时制粒1 min,利用分光光度法测量氯化钙中花色苷含量,计算包埋率。
1.4.4 氯化钙浓度对微胶囊中花色苷包埋率的影响
称取2.67 g黑米花色苷提取物,置于浓度为4.0%的海藻酸钠溶液中,配制成壁芯比为3∶1的壁芯混合液,均质5 min,喷头孔径为0.45 mm,制粒条件稳定后,分别用浓度为1.0%、2.0%、3.0%、4.0%和5.0%的氯化钙溶液接收,计时制粒1min,利用分光光度法测量氯化钙中花色苷含量,计算包埋率。
1.5 花色苷标准曲线的绘制
精确称量Cy-3-G标准品2.5 mg,置于25 mL棕色容量瓶中,按参考文献[8]制备并绘制标准曲线,得标准曲线方程为y=52.829x+0.008 3,R2=0.999 4,其线性范围为0~0.020 mg/mL。
1.6 花色苷包埋率计算方法
壁芯混合液配制完成后,根据黑米花色苷提取物中花色苷含量和配制用量,计算壁芯混合液中花色苷浓度。按照试验设计,制备黑米花色苷微胶囊后,取氯化钙溶液适量,按照1.5测定并计算氯化钙溶液中花色苷浓度,则花色苷包埋率计算公式(1)如下:
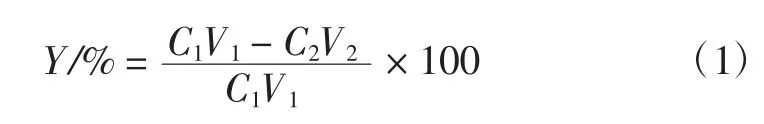
式中:Y为花色苷包埋率,%;C1为壁芯混合液中花色苷浓度,mg/mL;V1为消耗壁芯混合液体积,mL;C2为氯化钙滤液中花色苷浓度,mg/mL;V2为氯化钙滤液体积,mL。
1.7 胃肠模拟液中的释放试验
参考文献[9]进行胃模拟液和肠模拟液配置和释放试验,得到pH 1.2的胃模拟液和pH 6.8的小肠模拟液。取一定质量的花色苷微胶囊,分别加入到25 mL胃模拟液或25 mL小肠模拟液中,37℃水浴条件下,50 r/min下振荡反应,每30 min取模拟液测定花色苷的含量,计算释放度。
1.8 花色苷释放度计算公式
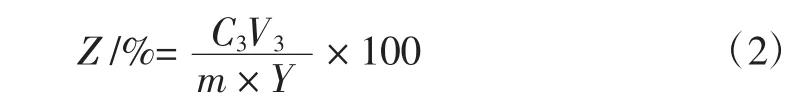
式中:Z为花色苷释放度,%;C3为模拟液中花色苷浓度,mg/mL;Y为花色苷包埋率,%;V3为模拟液体积,mL;m 为微胶囊质量,g。
1.9 花色苷微胶囊稳定性测定
1.9.1 自然光照对微胶囊稳定性的试验
准确称取微胶囊0.20 g,真空包装后置于室温(20℃)条件下自然光照射20 d,每5 d取样测定微胶囊中花色苷含量,以花色苷保留率为评价指标,考察自然光照对微胶囊中花色苷含量的影响[10]。
1.9.2 空气对微胶囊稳定性的试验
准确称取微胶囊0.20 g,置于暗室内避光放置20 d,每5 d测其花色苷含量,以花色苷保留率为评价指标,考察空气对微胶囊中花色苷含量的影响。
1.9.3 保留率计算公式
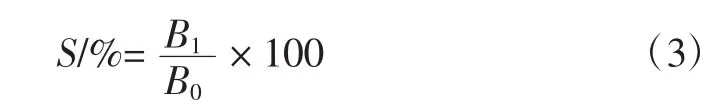
式中:S为花色苷保留率,%;B1为存放数天后微胶囊中花色苷含量,mg/g;B0为微胶囊中花色苷含量,mg/g。
所有试验均平行3次,试验结果以平均值表示。
2 结果与分析
2.1 喷头孔径对花色苷包埋率的影响
喷头孔径大小直接决定微胶囊直径大小,并影响芯材的包埋率。试验选用喷头孔径大小分别为0.1、0.3、0.45、0.75、1.0 mm 的喷头,结果见图 2。
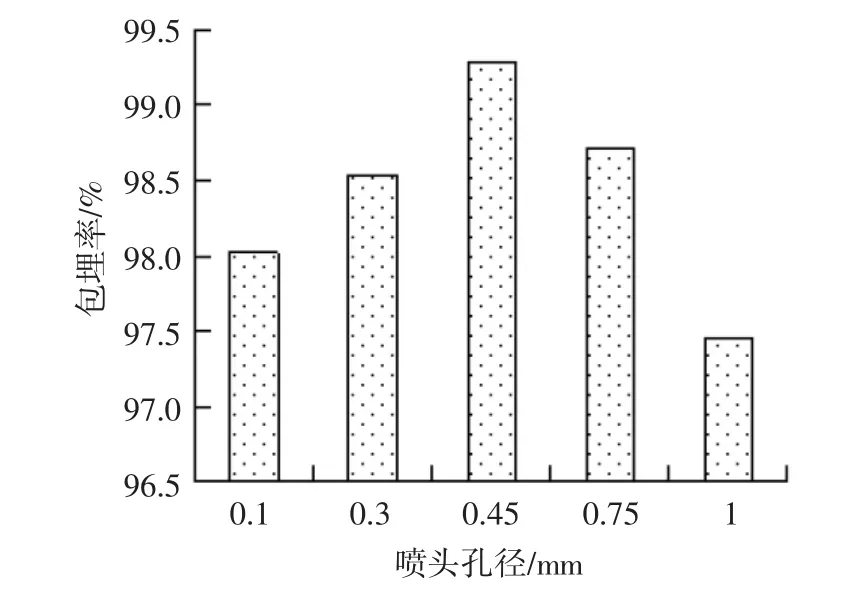
图2 喷头孔径对花色苷包埋率的影响Fig.2 Effect of needle aperture on imbedding ratio of anthocyanins
当喷头孔径大小在0.1 mm~0.45 mm之间时,花色苷包埋率随喷头孔径的增大而增大。当孔径为0.45 mm时,包埋率达到最大值99.28%;增大喷头孔径为0.75 mm和1.0 mm时,花色苷的包埋率降低。这可能是因为在微胶囊制备过程中,喷头孔径过大形成的微胶囊液滴粒径过大,微胶囊成型所需时间增长,因而导致成型效果变差,花色苷更多的溶解到固化溶液中,导致黑米花色苷包埋率下降。因此,制备黑米花色苷微胶囊的最佳喷头孔径确定为0.45 mm。
2.2 壁芯比对微胶囊中花色苷包埋率的影响
在制备微胶囊的过程中,壁芯比是制备微胶囊的一个重要影响因素。壁芯混合液中合理的壁芯比可以确保微胶囊中含有一定量的芯材成分,同时不影响微胶囊的成型效果,试验结果如图3。
由图3可知,花色苷包埋率随着壁芯比的增大呈现先增大后减小的趋势。当壁芯比增加到3∶1时,花色苷包埋率达到最大值99.28%。当壁芯比为2∶1时,壁材用量较低,不能完全包埋芯材,可能会使芯材附着在壁材表面,导致包埋率较低。继续增加壁材比例,壁芯混合液较黏稠,流动性差,微胶囊成型效果差,导致芯材溶到氯化钙溶液中,降低花色苷包埋率。因此确定制备黑米花色苷微胶囊的最佳壁芯比为3∶1。
2.3 海藻酸钠浓度对花色苷包埋率的影响
在制备微胶囊的过程中,海藻酸钠作为壁材,与固化剂反应,形成一层海藻酸钙的薄膜包裹花色苷,因此海藻酸钠的浓度会直接影响微胶囊的成型效果。不同海藻酸钠浓度对花色苷包埋率的影响见图4。

图4 海藻酸钠浓度对花色苷包埋率的影响Fig.4 Effect of sodium alginate concentration on imbedding ratio of anthocyanins
由图4可知,随着海藻酸钠浓度增加,包埋率先增大后减小。当海藻酸钠浓度为4.0%时,花色苷的包埋率达到最大值。海藻酸钠浓度在2.0%~4.0%之间时,微胶囊成型效果越来越好,花色苷包埋率逐渐增大;但当其超过4.0%时,壁芯混合溶液就会过于黏稠,导致微胶囊成型效果不好,包埋率下降,因此,确定制备黑米花色苷微胶囊的最佳海藻酸钠浓度为4.0%。
2.4 氯化钙浓度对微胶囊中花色苷包埋率的影响
在微胶囊制备过程中,氯化钙作为固化剂,浓度直接影响Ca2+与Na+的置换效果,其浓度过高或过低,均会影响Ca2+充分置换Na+,从而导致胶囊整体结构不稳定,花色苷包埋率下降[7]。氯化钙浓度对花色苷包埋率的影响如图5所示。
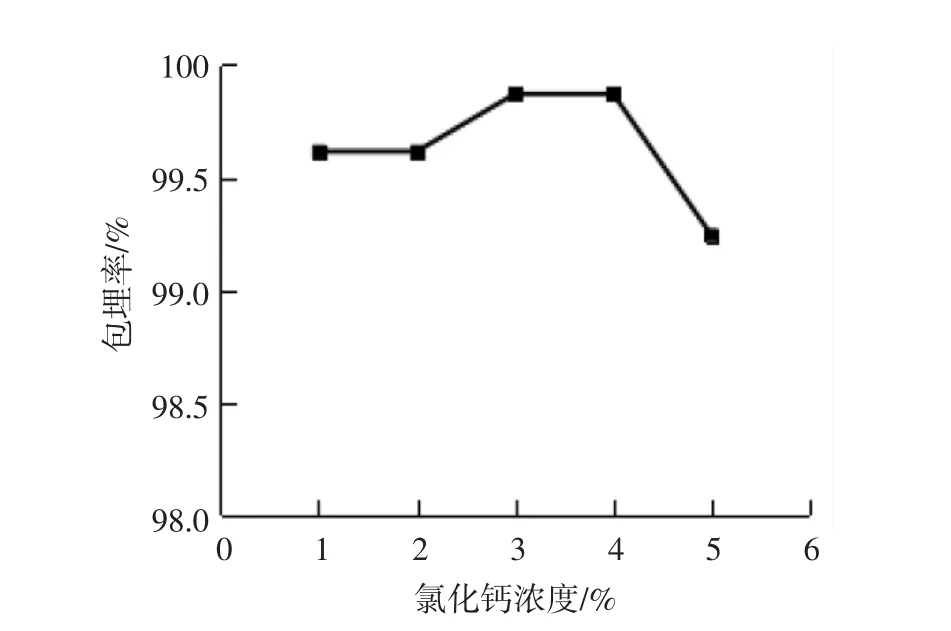
图5 氯化钙浓度花色苷包埋率的影响Fig.5 Effect of CaCl2concentration on imbedding ratio of anthocyanins
由图5可知,随着氯化钙浓度的增加,包埋率先增大后减小。当其浓度为3.0%时,花色苷包埋率达到最高值99.82%。随着其浓度继续增加,花色苷包埋率随之降低。因此确定制备黑米花色苷微胶囊的最佳氯化钙浓度为3.0%。
2.5 花色苷在胃肠模拟液中的缓释
人们进食后,食物在胃中可以存在4.0 h左右;而在人体内,益生菌大多存在于肠道中,因此花色苷微胶囊应在胃液中存在4.0 h以上且不易被溶解,然后到达肠道,在肠道内溶解,才能更好地实现花色苷对肠道益生菌的增殖促进作用。黑米花色苷微胶囊在胃及肠模拟液中的释放试验结果如图6所示。
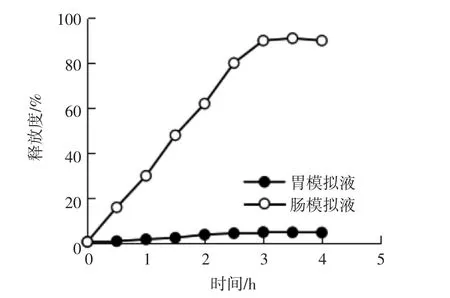
图6 花色苷微胶囊在胃肠模拟液中的缓释Fig.6 The releasing of anthocynins in the stomach and intestine simulated liquid
由图6可知在4.0 h内,微胶囊中的花色苷在胃模拟液中的释放度升高趋势非常缓慢,3.0 h时仅为5%,继续延长时间变化不明显。这表明在4.0 h内,花色苷微胶囊可以在胃模拟液中保持花色苷的低释放率。在肠模拟液中,花色苷释放度随时间的延长,上升趋势较快,在3.0 h时达到91.32%,基本完成芯材成分的释放。由此可知,以海藻酸钠为壁材制备的黑米花色苷微胶囊可以延迟花色苷在胃液中释放,实现在肠道中释放,有利于花色苷在肠道中发挥功效。
2.6 微胶囊稳定性测定
花色苷具有较强的还原能力,其稳定性受不同条件如温度、光照、氧气、pH值等条件影响。本文分别考察自然光照和空气对微胶囊中花色苷保留率的影响,结果如图7所示。
2.6.1 自然光照对微胶囊稳定性的影响
由图7可知,在自然光下,随着放置时间的延长,微胶囊中花色苷的保留率逐渐降低。在0~5 d之间,降低幅度最大;存放20 d后,微胶囊中花色苷保留率降低到47.71%。由此可知经微胶囊技术包埋的花色苷,在自然光照下稳定性仍会受到影响,所以花色苷微胶囊应避光存放,降低光照对花色苷含量的影响。
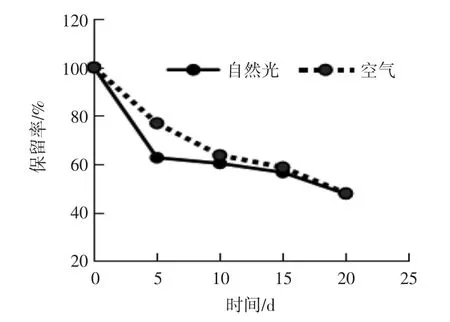
图7 自然光和空气对微胶囊稳定性影响Fig.7 Effect of light and atmosphere on the stability of microcapsules
2.6.2 空气对微胶囊稳定性影响
由图7可知,在空气下存放的微胶囊,花色苷的保留率随存放时间的延长而逐渐降低,放置20 d后,花色苷保留率降低到47.95%。由此可知花色苷虽然经过包埋处理,但空气仍然会影响其中花色苷的稳定性,因此花色苷微胶囊在保存时,应隔绝空气存放。
3 结论
本文通过单因素试验确定了黑米花色苷微胶囊制备的最佳工艺:壁芯比为3∶1、喷头孔径为0.45 mm、海藻酸钠浓度为4.0%、氯化钙浓度为3.0%。在此条件下,制得的微胶囊中花色苷的包埋率达到99%以上。胃及肠模拟液释放试验证明,黑米花色苷微胶囊在胃模拟液中能够保持4.0 h以上,在肠模拟液中随着时间的延长逐渐溶解,证明花色苷可以在肠模拟液中释放,有利于花色苷在肠道中发挥功效。稳定性试验证明自然光和空气对微胶囊化后的花色苷稳定性仍有较大的影响,因此应尽量避光和隔绝空气来保存黑米花色苷微胶囊。

