外周血T淋巴细胞亚群水平对结直肠癌患者术后复发的影响及预测价值分析*
张帆,邸泰霖,韩克松
(河北中石油中心医院 普外科,河北 廊坊065000)
结直肠癌(colorecta carcinoma,CRC)是最常见的消化系统恶性肿瘤之一,全世界每年发病人数约100万、死亡人数约50万,在我国也呈现逐年增加的趋势,有报道称我国每年新发病人数高达15 万[1-2]。该病的5年生存率不到50%,严重威胁人们的身心健康。目前,CRC 的治疗仍以手术为主、放化疗为辅。由于腹腔镜技术具有组织创伤小、脏器干扰少、手术应激反应小和术后恢复快等优点,已被广泛应用于CRC 手术[2-5]。腹腔镜手术对机体免疫功能的影响较传统开腹手术轻,有一定的免疫保护作用[6],且可以减少术后复发。机体对肿瘤免疫以T淋巴细胞介导的细胞免疫为主,T淋巴细胞通过参与调节蛋白质抗原引起的免疫应答过程,可清除细胞表面抗原,或改善细胞内微生物效应[7]。国外有研究[8]表明,CRC 术后肿瘤的发生、发展与T 淋巴细胞有一定程度的关联,而国内外相关的报道较少。本研究拟通过检测患者术后外周血T 淋巴细胞亚群(CD3+、CD4+,CD8+细胞和CD4+/CD8+比值)的水平,了解患者免疫功能的变化,以探讨经腹腔镜根治术治疗后的免疫状况对CRC患者复发的影响及其预测价值。
1 资料与方法
1.1 一般资料
选取2016年1月-2017年1月在本院行腹腔镜根治术治疗CRC 的患者120 例(结肠癌78 例,直肠癌42例)。按术后是否复发分为复发组和非复发组。未复发组96 例,其中男57 例,女39 例,平均年龄(56.32±10.79)岁,体重指数(body mass index,BMI)为(24.46±2.95)kg/m2,肿瘤最大直径(4.23±0.87)cm,术前癌胚抗原(carcinoembryonic antigen,CEA)为(20.83±4.69)µg/L,CA19-9 为(56.08±15.52)u/mL,术后行FOLFOX4化疗方案49例,氟尿嘧啶单独给药47例。复发组24例,其中男13例,女11 例,平均年龄(58.34±9.67)岁,BMI(23.72±2.39)kg/m2,肿瘤最大直径(3.86±0.74)cm,术前CEA(22.89±4.82)µg/L,CA19-9(88.24±13.62)u/mL,术后行FOLFOX4化疗方案11例,氟尿嘧啶单独给药13例。两组患者一般资料(性别、年龄、BMI、临床分期、术前CEA、CA19-9 和术后化疗方案)比较,差异均无统计学意义(P>0.05),具有可比性。见表1。本研究经医院伦理委员会审核批准,入组患者均签署知情同意书。
1.1.1 纳入标准①知晓本研究并签署知情同意书;②经病理学检查确诊为CRC 者;③接受腹腔镜术治疗者;④符合根治性手术指征;⑤术后能参与随访者。
1.1.2 排除标准①合并内分泌系统疾病和肝肾功能不全的患者;②有急性感染和慢性炎症性疾病的患者;③术前影像学检查提示发生广泛转移者;④有腹部手术史者;⑤术前行化疗或接受过免疫抑制剂治疗者。
1.2 观察指标
术后随访3年,观察患者术后复发情况,记录两组患者术前一般资料、经腹腔镜治疗术后第1 天CD3+、CD4+、CD8+及CD4+/CD8+的水平以及是否进行放化疗等。
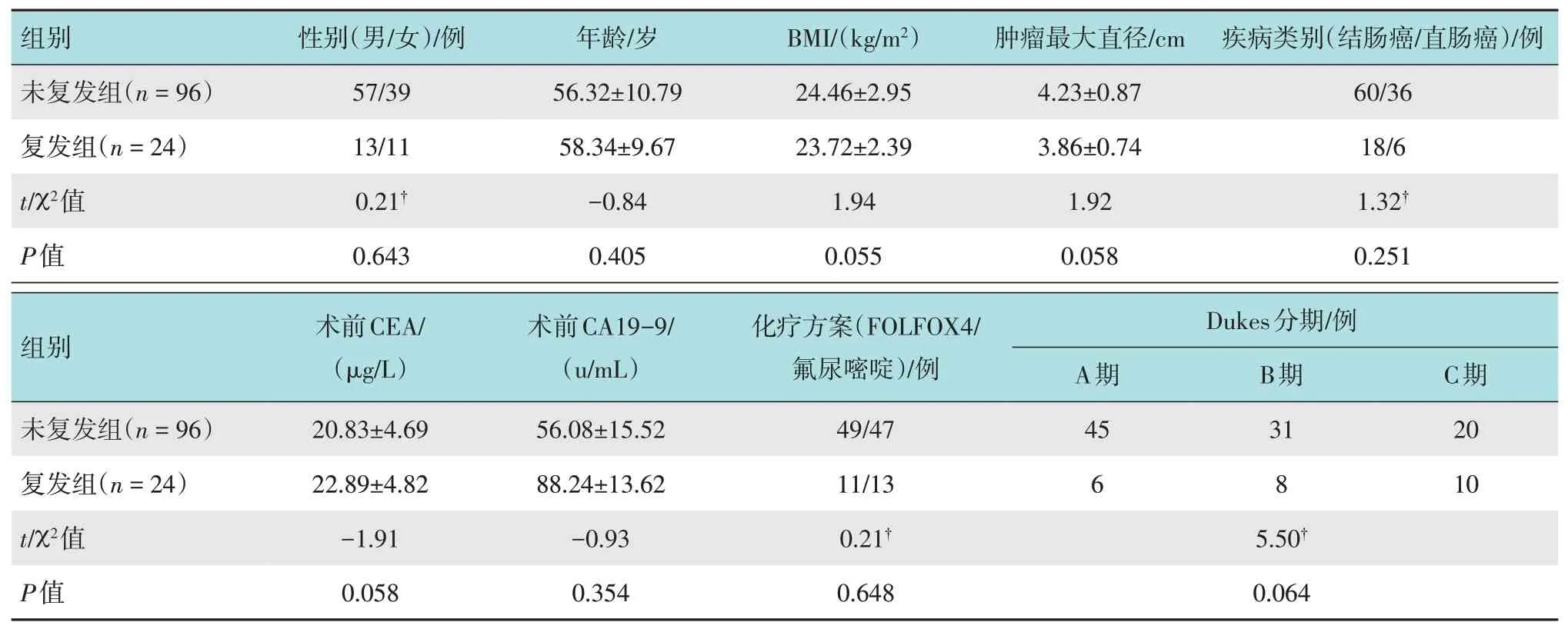
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.3 统计学方法
数据处理采用SAS 9.4 统计软件,计量资料以均数±标准差(±s)表示,行t检验;计数资料以构成比或率(%)表示,行χ2检验;绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),影响因素分析采用多因素Logistic 回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后T淋巴细胞亚群水平比较
复发组术后第1 天CD8+水平高于未复发组,而CD3+、CD4+和CD4+/CD8+水平低于未复发组,两组比较,差异均有统计学意义(P<0.05)。见表2。
2.2 T淋巴细胞亚群水平对患者术后复发的影响
多因素Logistic 回归分析(α入=0.05)表明,血清中CD8+细胞水平(=1.14 >1,95%CI:1.05~1.23)是影响CRC 术后复发的独立危险因素,而CD3+(=0.82,95%CI:0.75~0.90)、CD4+(=0.91,95%CI:0.85~0.98)和CD4+/CD8+(=0.20,95%CI:0.06~0.59)是影响CRC 术后复发的保护性因素。见表3。
表2 两组患者术后T淋巴细胞亚群水平比较 (±s)Table 2 Comparison of T-lymphocyte subsets after surgery between the two groups (±s)
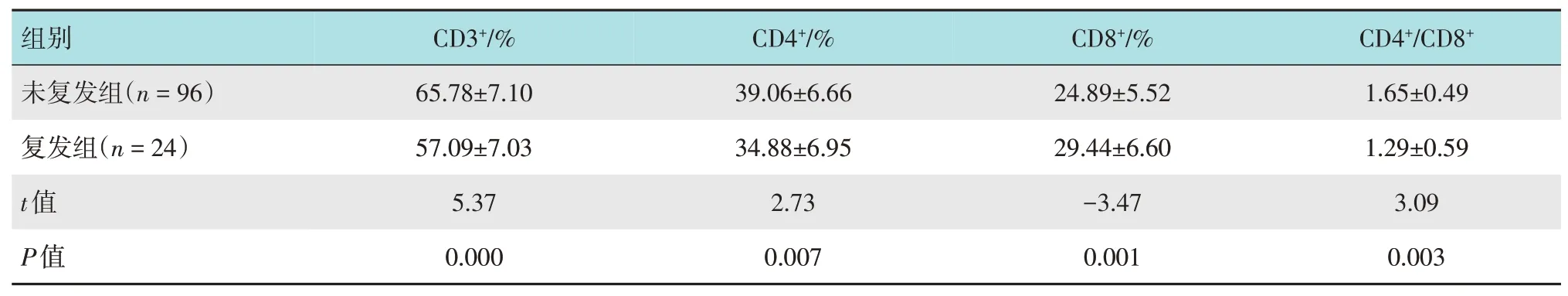
表2 两组患者术后T淋巴细胞亚群水平比较 (±s)Table 2 Comparison of T-lymphocyte subsets after surgery between the two groups (±s)
组别未复发组(n=96)CD3+/%65.78±7.10 CD4+/%39.06±6.66 CD8+/%24.89±5.52 CD4+/CD8+1.65±0.49复发组(n=24)t值P值57.09±7.03 5.37 0.000 34.88±6.95 2.73 0.007 29.44±6.60-3.47 0.001 1.29±0.59 3.09 0.003
2.3 T 淋巴细胞亚群水平对CRC 术后复发的预测价值
ROC曲线显示:CD3+、CD4+、CD8+和CD4+/CD8+对CRC 患者术后是否复发具有一定的预测价值(均P<0.05)。CD3+、CD4+、CD8+和CD4+/CD8+曲线下面积(area under curve,AUC)分别为:0.813(95%CI:0.706~0.919)、 0.671 (95%CI: 0.543~0.799)、0.732 (95%CI: 0.610~0.855) 和0.740 (95%CI:0.619~0.860)。当CD3+=57.602%时,诊断灵敏度为0.667(95%CI:0.463~0.871),特异度为0.917(95%CI:0.863~0.971);当CD4+=34.643%时,诊断灵敏度为0.583 (95%CI:0.501~0.665),特异度为0.771(95%CI:0.618~0.924);当CD8+=26.344%时,诊断灵敏度为0.750(95%CI:0.681~0.819),特异度为0.667(95%CI:0.581~0.753);当CD4+/CD8+=1.599 时,诊断灵敏度为0.917 (95%CI:0.902~0.932),特异度为0.542(95%CI:0.500~0.584)。见表4和附图。
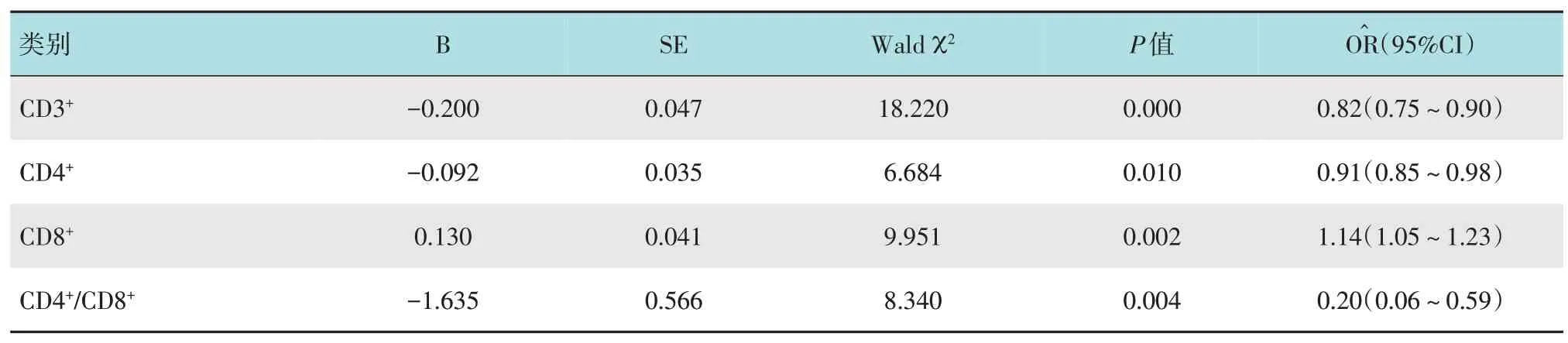
表3 术后复发的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of recurrence after surgery
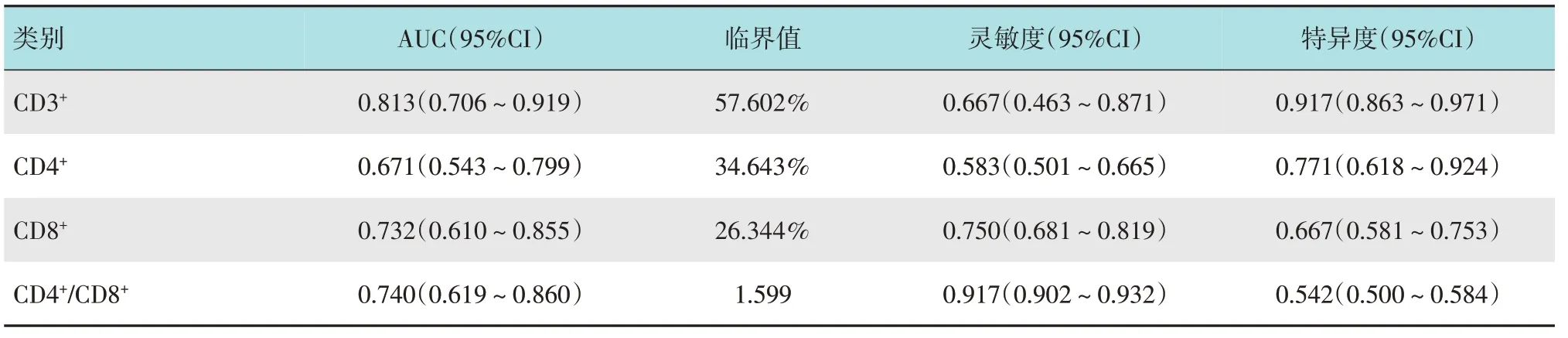
表4 术后外周血T淋巴细胞亚群对CRC复发的预测效能分析Table 4 Predictive efficacy analysis of postoperative peripheral blood T-lymphocyte subsets on recurrence of CRC

附图 T淋巴细胞亚群的ROC曲线及对CRC复发预测效能分析Attached fig.ROC curve of T-lymphocyte subsets and the predictive efficacy analysis of CRC recurrence
3 讨论
腹腔镜手术治疗CRC 不仅能减轻副损伤,也在一定程度上降低了操作难度[6,8-9]。与开腹手术相比,除明显减少出血量和损伤外,还能快速恢复患者术后肠功能,使患者进食时间提早,及时改善肠屏障功能,有效提升患者免疫能力和减少术后并发症发生[10]。有研究[11]表明,手术创伤的大小与机体免疫功能的抑制和应激反应程度呈正相关,而这两种因素对患者术后癌症转移、复发及转归均有严重的影响。因此,越来越多的临床医生选择行腹腔镜手术治疗。
CRC是复发率高且预后较差的恶性肿瘤。尽管腹腔镜手术对患者免疫功能影响较小,但患者术后局部复发率仍较高,严重影响患者术后生活质量,这也是导致患者术后死亡的重要因素。因此,能早期对术后复发转移情况进行预测的指标在临床上尤为重要。
目前,有许多预测诊断CRC 患者术后复发的方法,各有优缺点。粪便潜血和血清中CEA 作为非侵入性筛选方法,被广泛应用于术后早期检测CRC 的复发或转移,但其敏感性和特异性有限[12],仍存在一定争议[13]。钡灌肠、结肠镜检查和18F-FDG PET/CT具有更高的特异性,但对于无症状的一般人群大规模筛查的可行性差[14-16]。
细胞免疫为机体抗肿瘤免疫机制的重要组成部分,临床已将其应用于肿瘤早期诊断、病情监测、疗效评价和预后评估等方面[17-19]。
有研究[20]发现,不同肿瘤患者会出现不同的免疫功能异常,从而导致临床结局不同。机体抗肿瘤的主要机制是T细胞介导的细胞免疫,因T淋巴细胞亚群的生物功能具有多样性,常作为判定机体细胞免疫功能优劣的指标。有文献[21]报道,肿瘤患者免疫细胞在数量或功能方面均存在一定异常,主要表现为T淋巴细胞亚群数量的失衡或功能损伤,其中CD3+、CD4+和CD8+细胞等是近年来发现与肿瘤免疫密切相关的亚型。
CD4+/CD8+比值代表机体细胞免疫功能的稳定与否,机体免疫功能正常时,CD4+/CD8+处于相对平衡状态。本文经多因素Logistic 回归分析表明,CD4+/CD8+细胞水平是影响CRC 术后复发的保护因素(=0.20 <1,P<0.05),且未复发组CD4+/CD8+比值明显高于复发组。正常情况下,CD4+/CD8+比值应大于1.4,低于1.4则反映机体免疫功能低下[22]。本研究复发患者的CD4+/CD8+比值低于1.4,说明细胞免疫功能处于抑制状态,而患者免疫功能低下,促进了肿瘤的增殖[23]。随着CRC 的进展,癌组织中CD4+/CD8+水平逐渐降低,识别和杀伤突变细胞的能力下降。 ROC 曲线分析发现, CD4+/CD8+的AUC=0.740,说明CD4+/CD8+可以作为CRC术后预测复发的指标。
CD8+细胞为抑制性T 细胞或细胞毒性T 淋巴细胞,能抑制机体的免疫应答[24]。本研究发现,经多因素Logistic 回归分析表明,CD8+细胞水平是影响CRC术后复发的独立危险因素(=1.14 >1,P<0.05),复发组明显高于未复发组(P<0.05),这提示:由于术后肿瘤免疫调节功能受抑制,复发组患者的肿瘤免疫耐受状态加重,加速了癌细胞的进展,导致复发概率增加,与冯国丽等[25]的研究结果一致。经ROC 曲线分析发现,CD8+的AUC=0.732,表明CD8+作为预测CRC患者术后是否复发的指标具有一定的意义。
CD4+细胞为辅助性T淋巴细胞,在抑炎因子的作用下可以分泌相关的细胞因子,辅助其他免疫细胞,增强机体免疫系统的耐受性,完成抗肿瘤免疫[26]。本研究结果显示,CD4+是术后复发的保护性因素(=0.91 <1,P<0.05),且复发组明显低于未复发组,可能是在恶性肿瘤的进展过程中,产生或分泌的可溶性免疫抑制因子作用增强,阻止了CD4+细胞的形成和成熟,使机体免疫系统处于抑制状态,导致了肿瘤的进展[27]。ROC 曲线分析结果发现,CD4+的AUC=0.671,表明CD4+细胞水平作为CRC 术后预测复发的指标有一定的临床价值。
CD3+是成熟的T淋巴细胞,它的数量直接反映了机体细胞免疫功能的状态[28-29]。正常情况下的T细胞总数处于相对平衡状态,CD3+细胞总数降低时,表示机体免疫功能降低。本研究发现,CD3+是保护性因素(=0.82 <1,P<0.05),复发组CD3+水平明显低于未复发组(P<0.05),这说明:由于肿瘤的进展,使复发组机体免疫功能处于抑制状态,导致患者CD3+水平降低[29]。ROC曲线分析发现,CD3+的AUC=0.813,提示CD3+细胞水平可以作为预测CRC术后复发的标志。
因此,CRC 患者术后CD3+、CD4+、CD8+和CD4+/CD8+水平与术后复发有关,其中CD8+是CRC患者术后复发的独立危险因素,而CD3+、CD4+和CD4+/CD8+是保护性因素。
综上所述,外周血T淋巴细胞亚群的测定,对于判断CRC 患者的免疫状态具有重要意义,其作为预测术后复发的指标,具有一定的临床价值。

