小球藻叶绿素脱除工艺优化及蛋白提取
马石霞,马咸莹,丁功涛,王家敏
(1.西北民族大学 生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
小球藻(Chlorella)属绿藻门,绿藻目,卵胞藻科,小球藻属[1].小球藻细胞呈椭圆形,体积微小、结构简单,生长和繁殖速度快,直径在3~8 μm[2]之间.细胞内通常含有1个呈板状或杯状的叶绿体.
蛋白质在藻细胞的结构和代谢中起着重要作用,是细胞膜结构和参与光合作用催化酶的主要成分.与传统来源的蛋白质相比较,小球藻中通常含有40%~60%的蛋白质[3].小球藻含有哺乳动物不能合成的必需氨基酸及优质蛋白质,如乳球蛋白、卵清蛋白等.其氨基酸组成高于世界卫生组织(WHO)和联合国粮农组织(FAO)颁布的用于人类营养的蛋白质标准[4].作为高蛋白食品来源,小球藻能够迅速补充体能,因此被FAO列为21世纪人类的健康食品[5].小球藻蛋白具有降血压和抗氧化的作用.蔡震寿等[6]利用小球藻蛋白质水解物对大鼠进行实验,发现原发性高血压大鼠灌食60 mg PN-1粉末/350 g体重(相当于171.4 mg粉末/kg体重)6 h后,其收缩压(SBP)和舒张压(DBP)分别降低2.67 kPa和2.79 kPa重量(BW).王文强[7]和王爽等[8]发现,酶解小球藻蛋白获得的水解肽对DPPH自由基的清除率分别为88.53%和68.93%,对羟自由基的清除率分别为96.81%和82.00%,具有显著的抗氧化作用.
尽管小球藻蛋白具有很多的功效,但叶绿素的存在降低了小球藻蛋白的利用率.小球藻中总色素含量约占4%~5%,其中叶绿素占总色素的60%~80%[9].叶绿素是一种色价较高的镁卟啉化合物(大于500),不溶于水,易溶于乙醇、丙酮、氯仿等有机溶剂,微量即可呈现明显的绿色.为了降低叶绿素对小球藻蛋白的感官影响,得到纯度和品质较高的小球藻蛋白,需将小球藻叶绿素进行有效脱除.目前常见脱除色素的方法主要有有机溶剂浸提法、超声波辅助提取法和吸附树脂法.Kong等[10]利用超声辅助提取法脱除小球藻叶绿素,发现在最佳条件下叶绿素的脱除率可达88.9%.李灿良等[11]利用有机溶剂浸提法脱除小球藻叶绿素,脱除率可达53.69 mg/g(藻干物质).杜莹莹[12]利用改性后的高岭土脱除藻类叶绿素a,最大去除率可达95%.
本实验以小球藻粉为原料,通过单因素和正交试验优化小球藻叶绿素脱除工艺,并在此基础上提取纯度较高的小球藻蛋白.
1 材料与方法
本实验从料液比、脱色液比例、反应温度、反应时间4个因素对小球藻叶绿素脱除率的影响进行实验.在单因素试验的基础上,采用四因素三水平的正交试验法确定小球藻叶绿素的最佳脱除工艺.在此基础上,利用热碱法进一步提取小球藻蛋白.
1.1 实验材料和仪器
1.1.1 材料和试剂
小球藻(购自上海光语生物科技有限公司),无水乙醇(天津市富宇精细化工有限公司),氢氧化钠、氢氧化钾(天津市大茂化学试剂厂),溴甲酚绿、硼酸(天津市凯信化学工业有限公司),甲基红(天津市科密欧化学试剂有限公司),无水碳酸钠(天津市恒兴化学试剂有限公司),浓盐酸(开封中信中贸化工有限公司),浓硫酸(上海三鹰化学试剂有限公司),石英砂(天津市科密欧化学试剂有限公司),碳酸钙(天津市百世化工有限公司).
1.1.2 仪器和设备
HH-S4A型电热恒温水浴锅(北京科伟永兴仪器有限公司),DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),GL21M型高速冷冻离心机(赛默飞世尔科技(中国)有限公司),AR224CN型电子天平(奥豪斯仪器(常州)有限公司),L9型可见分光光度计(上海仪电分析仪器有限公司),FOSS scrubber 2501福斯蛋白质消化仪(福斯中国有限公司),LGJ-20F型真空冷冻干燥机(北京松源华兴科技发展有限公司).
1.2 小球藻粉叶绿素含量的测定
1.2.1 叶绿素的脱除
分别称取小球藻粉0.4 g、0.6 g、0.8 g、1.0 g、1.2 g于研钵中,加入少量二氧化硅(石英砂)和碳酸钙粉末及2~3 mL 95%乙醇,冰浴中研磨成小球藻泥,再加入10 mL95%乙醇,暗处静置10 min.将提取液过滤并用95%乙醇反复冲洗研钵、研棒和残渣至无色.最后用95%乙醇定容至50 mL棕色容量瓶中,摇匀后保存在暗处备用.
1.2.2 叶绿素的测定
将上述叶绿素去除液注入光径1 cm的比色皿中,以95%乙醇作为空白对照,利用可见-分光光度计分别在波长665 nm和649 nm下测定吸光度.当测得的吸光度值大于0.8或小于0.2时,叶绿素提取液应做适当的倍数稀释或浓缩,再对其进行测定.
根据下列计算公式,分别计算出叶绿素a、b的浓度及其总叶绿素浓度(mg·L-1)[13].
95%乙醇去除液中叶绿素浓度的计算公式:
Ca(叶绿素a) =13.95A665-6.88A649
(1)
Cb(叶绿素b) =24.96A649-7.32A665
(2)
CT(叶绿素) =Ca+Cb=18.08A649+6.63A665
(3)
式中:Ca、Cb和CT分别为叶绿素a、叶绿素b和总叶绿素的浓度,单位为毫克每升(mg·L-1);A665和A649为叶绿素提取液在波长665 nm和649 nm下的吸光度.
按下式计算小球藻粉中叶绿素的含量(mg·g-1).
(4)
(5)
1.3 小球藻粉蛋白含量的测定
本实验中小球藻蛋白含量利用凯氏定氮法[13]测定.
小球藻蛋白的提取[11]:称取3 g小球藻粉溶于120 mL质量分数为3%的KOH溶液中, 80 ℃处理2 h后,5 000 r/min离心2 min,弃去上清液,40 mL去离子水洗涤3次后,进行冷冻干燥.
蛋白提取率计算公式:

(6)
1.4 单因素试验
1.4.1 料液比对小球藻粉叶绿素脱除率的影响
称取小球藻粉0.4 g、0.6 g、0.8 g、1.0 g、1.2 g溶于40 mL的脱色液(无水乙醇︰2%NaOH溶液=1︰4),70 ℃处理2 h后,4 000 r/min离心10 min,弃去上清液,用等量的去离子水洗涤藻泥,重复4次,进行冷冻干燥.利用1.3的方法测定小球藻粉叶绿素的含量并计算其脱除率.
1.4.2 脱色液比例对小球藻粉叶绿素脱除率的影响
分别量取不同比例的脱色液(无水乙醇︰2%NaOH溶液=1︰3、1︰4、1︰5、1︰6、1︰7)40 mL溶解0.6 g的小球藻粉,70 ℃处理2 h后,4 000 r/min离心10 min,弃去上清液,用等量的去离子水洗涤藻泥,重复4次,进行冷冻干燥.利用1.3的方法测定小球藻粉叶绿素的含量并计算其脱除率.
1.4.3 反应时间对小球藻粉叶绿素脱除率的影响
取0.6 g小球藻粉溶于40 mL的脱色液(无水乙醇︰2%NaOH溶液=1︰4),70 ℃下处理不同时间(0.5 h、1.0 h、1.5 h、2 h、2.5 h)后,4 000 r/min离心10 min,弃去上清液,用等量的去离子水洗涤藻泥,重复4次,进行冷冻干燥.利用1.3的方法测定小球藻粉叶绿素的含量并计算其脱除率.
1.4.4 反应温度对小球藻粉叶绿素脱除率的影响
取0.6 g小球藻粉溶于40 mL的脱色液(无水乙醇︰2%NaOH溶液=1︰4 ),在不同温度(45 ℃、50 ℃、55 ℃、60 ℃、65 ℃)下处理2 h后,4 000 r/min离心10 min,弃去上清液,用等量的去离子水洗涤藻泥,重复4次,进行冷冻干燥.利用1.3的方法测定小球藻粉叶绿素的含量并计算其脱除率.
1.5 正交试验
根据单因素试验结果,选择料液比、脱色液比例、反应温度、反应时间作为试验因素,以小球藻叶绿素脱除率为指标设计正交试验,采用L9(34)的正交试验表,试验因素水平见表1.
记录实验结果,利用SPSS和Origin2016软件对实验数据进行分析.

表1 正交试验因素水平表
2 结果与分析
2.1 单因素实验
2.1.1 料液比对小球藻粉叶绿素脱除率的影响
如图1所示,随着料液比的增加,叶绿素的脱除率逐渐增大.料液比为1.5︰100时叶绿素脱除率为92.73%,此后降低.叶绿素与蛋白质结合紧密,加入过多的小球藻粉降低了溶液的含水量,叶绿素分子中的亲水基团很难从叶绿体中游离出来[14].
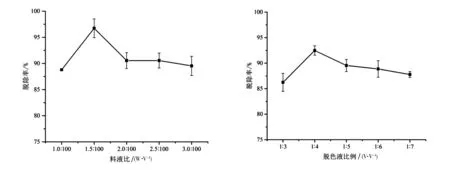
图1 料液比对叶绿素提取率的影响 图2 脱色液比例对叶绿素提取率的影响
2.1.2 脱色液比例对小球藻粉叶绿素脱除率的影响
如图2所示,当脱色液比例从1︰3增大到1︰4时,叶绿素的脱除率明显提高,由86.24%提高至92.48%,此时小球藻中大部分叶绿素已经溶出;当脱色液比例超过1︰4后,叶绿素的脱除率开始缓慢降低,原因可能是叶绿素是脂溶性叶绿素,叶绿素的脱除效率受脱色液极性的影响[7].
2.1.3 反应时间对小球藻粉叶绿素脱除率的影响
如图3所示,随着反应时间的延长,叶绿素脱除率呈先上升后下降的趋势.当反应时间达到1.5 h时,叶绿素的脱除率为94.73%.叶绿素通过自由扩散的作用由高浓度的细胞内侧通过质膜扩散到低浓度的细胞外侧.当时间为1.5 h时,细胞膜两侧的浓度相差不大,此时叶绿素的溶解度已经达到最大.当时间超过1.5 h后,细胞外侧的浓度高于内侧的浓度,叶绿素由细胞外侧向内侧扩散,脱除率下降,说明最适反应时间为1.5 h.

图3反应时间对叶绿素提取率的影响 图4反应温度对叶绿素提取率的影响
2.1.4 反应温度对小球藻粉叶绿素脱除率的影响
如图4所示,在45 ℃的温度下小球藻叶绿素脱除率较低,在45~60 ℃之间,叶绿素脱除率逐步提高,60 ℃时脱除率为95.50%,此后,叶绿素脱除率有下降的趋势.叶绿素易溶于乙醇、丙酮等有机溶剂,不溶于水.本实验所采用的脱色液(无水乙醇︰2%NaOH溶液=1︰4)中,无水乙醇作为萃取剂将水相中的叶绿素萃取至有机相,从而达到脱色的目的.但高温会加速萃取剂的挥发,使得有机相含量降低,叶绿素被大量滞留在水相中,降低叶绿素的脱除率.因此,本实验采用60 ℃为适宜温度.
2.2 正交试验
依据单因素试验结果,采用L9(34)的正交试验表,选取料液比、反应时间、反应温度、脱色液比例四个因素,每个因素选择三个水平进行正交试验,试验结果见表2.

表2 正交试验结果
由表2中的R值分析可知,对于叶绿素的提取,A、B、C、D因素对小球藻叶绿素脱除率的影响次序是A>C>B>D.料液比是重要因素,反应温度是一般因素,反应时间和脱色液比例是次要因素,较优组合为A1B2C2D3,即料液比1.5︰100(w/v)、反应时间1.5 h、反应温度60 ℃、脱色液比例1︰6(v/v).选择该自由组合条件进行3次验证试验,得出在该条件下小球藻叶绿素脱除率为96.89%(1±0.0035).与正交试验中提取率最高的一组进行比较,可知小球藻叶绿素较佳脱除条件为A1B2C2D3,即料液比1.5︰100(w/v)、反应时间1.5 h、反应温度60 ℃、脱色液比例1︰6(v/v).此条件下小球藻叶绿素的脱除率可达96.89%.对实验结果进行方差分析,结果见表3.
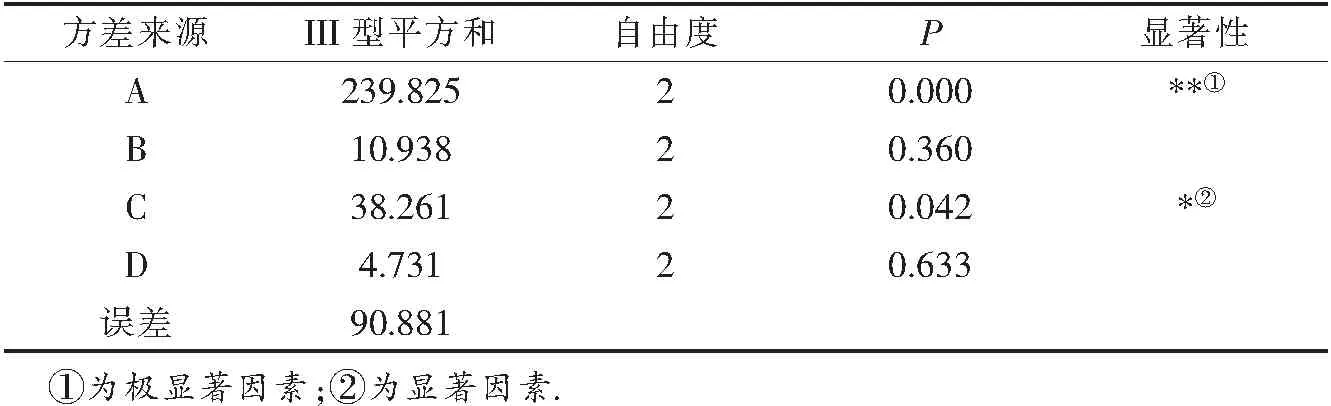
表3 方差分析表
由表3方差分析可以看出,反应温度因素的P=0.042<0.05,为显著因素,料液比因素的P=0.000<0.01为极显著因素,而提取时间和脱色液比例影响不显著.
2.3 蛋白提取
在对小球藻蛋白质提取进行前,采用凯氏定氮法测得小球藻蛋白的含量占58.60%(1±0.0057),在脱除小球藻叶绿素的基础上,利用热碱法进一步提取小球藻蛋白,小球藻蛋白的提取率为39.81%(1±0.0021).
3 结论
实验表明,影响小球藻叶绿素脱除率的各因素主次顺序为:料液比>反应温度>反应时间>脱色液比例.较佳提取工艺条件为料液比1.5︰100(w/v)、反应时间1.5 h、反应温度60 ℃、脱色液比例1︰6(v/v).在此条件下,测得叶绿素的实际脱除率为96.89%,与理论脱除率(96.73%)无显著性差异.由此可知,通过正交实验可以较好地预测试验结果.在此基础上,利用热碱法提取小球藻蛋白,小球藻蛋白的提取率为39.81%.

