急性腔隙性脑梗死与脑白质高信号偏侧性的相关分析
卞益同,孙亲利,高璐,杨健
脑小血管疾病指累及半卵圆中心、侧脑室旁及基底节区的髓质深穿支小动脉病变,这些血管只有内皮和少量平滑肌,没有外膜,易发生缺血改变,当小动脉完全闭塞时将导致腔隙性脑梗死,不完全闭塞会引起脑白质高信号(white matter hyperintensities,WMHs)[1-2]。WMHs主要表现为脑室周围及半卵圆中心区对称或不对称斑点状或斑片状高信号影,能够增加患急性脑梗死的风险,目前尚无有效可靠的治疗手段,因此对WMHs早期风险预防及病情评估尤为重要。WMHs一般在双侧半球呈对称表现,WMHs偏侧性很少被提到,本研究拟探讨WMHs偏侧性与急性腔隙性脑梗死(acute lacunar infarction,ALI)位置的关系。
1 材料和方法
1.1 研究对象
连续性纳入2019年1月至2020年1月我院神经内科住院患者61例,所有患者均被诊断为急性脑梗死,梗死灶位于幕上。本研究获得西安交通大学第一附属医院伦理委员会批准,所有受试者均签署知情同意书。纳入标准:①符合《中国急性缺血性卒中诊治指南2018》制定的急性缺血性脑卒中诊断标准;②急性发作,发病时间小于7 d;③首次发病或非首次发病但此次发病前未有神经功能缺失症状;④一侧半球单发病灶,扩散加权成像(diffusion weighted imaging,DWI)图呈高信号,ADC图为低信号;⑤液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)图存在WMHs。排除标准:①心房颤动或合并其他血管性疾病、脑肿瘤或脑炎等疾病;②腔梗灶最大直径>2 cm;③磁共振血管成像(magnetic resonance angiography,MRA)显示颅内外血管>50%狭窄患者;④临床或影像数据不全者。
1.2 仪器及方法
1.2.1 临床资料采集
包括患者年龄、性别、身体质量指数(body mass index,BMI)、高血压史、糖尿病史、吸烟史、卒中史、血浆同型半胱氨酸(homocysteine,Hcy)、入院时神经功能缺损评分(National institute of Health Stroke Scale,NIHSS)及发病时间(h)等。
1.2.2 MRI检查
所有患者均采用超导型磁共振扫描仪器GE 750W 3.0 T、8通道头线圈扫描,专用耳塞和配套的头线圈软垫用于降低噪音并减小头动,数据采集期间嘱受试者仰卧、放松、闭目,并保持清醒状态。扫描序列及参数如下:① T1WI:TR 2541.8 ms,TE 24 ms,FOV 240 mm×192 mm,矩阵320×224,层厚5 mm,层数22,时长54 s;② T2WI:TR 5044 ms,TE 116.48 ms,FOV 240 mm×192 mm,矩阵256×256,层厚5 mm,层数22,时长1 min 1 s;③ FLAIR:TR 8500 ms,TE 140 ms,TI 2202 ms,FOV 240 mm×192 mm,矩阵288×224,层厚5 mm,层数22,时长1 min 51 s;④ DWI:TR 4351 ms,TE 76.9 ms,FOV 240 mm×240 mm,矩阵128×140,层厚5 mm,层数22,时长35 s,b值0、1000 s/mm2;⑤ MRA:TR 18 ms,TE 2.5 ms,FOV 240 mm×180 mm,矩阵320×192,反转角15°,层厚1.4 mm,时长3 min 5 s。
1.3 WMHs评估
WMHs评估:由两位经验丰富的MRI诊断医师(评定者1:主治医师,工作年限13年;评定者2:住院医师,工作年限5年)在双盲实验下,分别利用PACS工作站对受试者FLAIR图像进行WMHs评估,对于图像有伪影或存在结构异常的影像数据不纳入本研究。WMHs信号特点:T2WI及FLAIR呈高信号,T1WI呈等或低信号;为保证本研究良好的一致性,评分前对部位划分使用统一模板,两名医师在本研究开始前统一评定步骤和方法,通过协商确定白质评分。本研究采用改良Scheltens量表[3]分别对双侧大脑半球WMHs大小、部位及数目进行评估。Scheltens量表标准:脑室旁高信号(0~6分)评分如下:①枕叶帽状高信号:0~2 分;②额叶帽状高信号:0~2 分;③侧脑室带状高信号:0~2 分。其中:0分,无病变;1分,病变<5 mm;2分,病变在6~10 mm。深部白质高信号评分如下:①额叶:0~6分;②顶叶:0~6分;③枕叶:0~6分;④颞叶:0~6分。其中:0分,无异常;1分,病变范围≤3 mm,数量≤5;2分,病变范围≤3 mm,数量≥6;3分,病变范围在3~10 mm,数量≤5;4分,病变范围在3~10 mm,数量≥6;5分,病变范围>10 mm,数量≥1;6分:病变融合。本研究选取半球WMHs评分相差3分及以上为WMHs偏侧,否则为WMHs对称[4]。
1.4 统计学方法
评定者间信度检验用采用Kappa检验,以Kappa值≥0.75为一致性较好,0.4≤Kappa值<0.75为一致性一般,Kappa值<0.4为一致性较差。采用SPSS 23.0进行数据处理,对于计数资料用率表示,组间比较采用χ2检验;对于计量资料,经检验符合正态分布者用均值±标准差表示,组间比较采用两独立样本t检验,若不符合正态分布,数据采用中位数及四分位数[M (Q25,Q75)]表示,组间比较采用Mann-Whitney U秩和检验。统计学显著性水平定为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 WMHs对称组和偏侧组的临床资料比较
共纳入ALI合并WMHs患者61例,其中男41例,女20例,年龄32~87岁,平均(65.7±12.6)岁。本研究两位评定者结果具有较好的一致性(Kappa=0.83,P<0.05);根据WMHs评分差值大小分为WMHs对称组33例,WMHs偏侧组28例(表1),两组间年龄、性别、BMI、高血压史、糖尿病史、吸烟史、卒中史、Hcy及发病时间差异无统计学意义(P>0.05),两组间入院NIHSS评分差异有统计学意义(P<0.05)(表2)。
2.2 WMHs偏侧性与ALI位置比较分析
61例患者中,WMHs对称33例,WMHs左偏13例(图1A),WMHs右偏15例(图1B);侧脑室旁及半卵圆中心的36例ALI中,26例(72%)与WMHs相邻或部分与WMHs重叠(图1C)。左侧大脑半球ALI 34例,右侧大脑半球ALI 27例,ALI病灶位于半卵圆中心7例(图1D),内囊3例(图1E),侧脑室旁29例(图1F),基底节区5例,丘脑12例,额叶3例,顶叶2例。WMHs对称组中,左侧大脑半球腔梗和右侧大脑半球腔梗病例数量差异无统计学意义(P>0.05);WMHs左偏中,左侧大脑半球腔梗数明显多于右侧大脑半球(92.3% vs 7.7%),而WMHs右偏中,右半球腔梗数明显多于左侧大脑半球(86.7% vs 13.2%),组间差异均有统计学意义(P<0.05)(表3,图2)。
表1 左右大脑半球WMHs分组资料(±s)Tab. 1 WMHs grouping data of left and right cerebral hemispheres (±s)
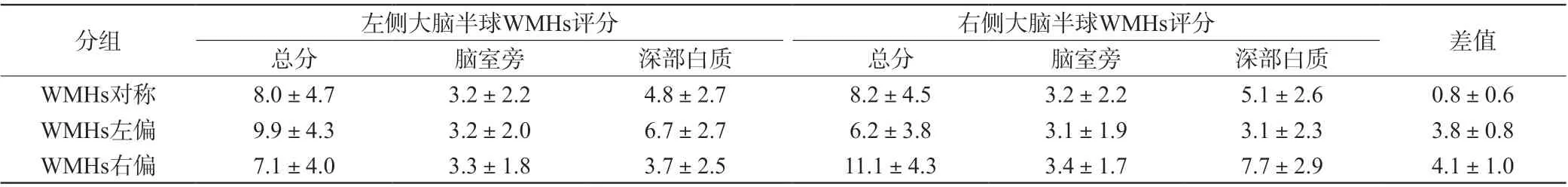
表1 左右大脑半球WMHs分组资料(±s)Tab. 1 WMHs grouping data of left and right cerebral hemispheres (±s)
分组左侧大脑半球WMHs评分右侧大脑半球WMHs评分差值总分脑室旁深部白质总分脑室旁深部白质WMHs对称8.0±4.73.2±2.24.8±2.78.2±4.53.2±2.25.1±2.60.8±0.6 WMHs左偏9.9±4.33.2±2.06.7±2.76.2±3.83.1±1.93.1±2.33.8±0.8 WMHs右偏7.1±4.03.3±1.83.7±2.511.1±4.33.4±1.77.7±2.94.1±1.0

表2 脑白质高信号对称组与偏侧组的临床资料比较Tab. 2 Comparison of clinical data between symmetrical WMHs and asymmetric WMHs groups

表3 脑白质高信号偏侧性与腔梗灶部位的比较Tab. 3 Comparison between the asymmetry of WMHs and the location of lacunar lesions
3 讨论
脑小血管疾病是由于各种原因引起脑内毛细血管、微动静脉病变的一组疾病,占脑梗死比例25%~30%,临床常表现头痛、头晕、步态不稳、执行功能障碍以及信息处理速度下降等,影像表现包括腔隙性脑梗死、WMHs、微出血及扩大的周围血管腔隙等,病变的发生主要与微动脉粥样硬化、脂质透明样变及纤维素样坏死有关[5]。腔隙性脑梗死是指脑内小穿通动脉血管壁发生病变,导致管腔闭塞,形成小的梗死灶,占全部脑梗死的1/5,一般位于脑实质深部,急性发作时可引起患者轻偏瘫或偏身感觉障碍等临床症状。WMHs是一种亚临床脑损伤,随着年龄的增长,脑内血管密度减少、扭曲,加速了髓鞘、轴突与少突胶质细胞的缺失以及星形胶质细胞增生,导致微动脉粥样硬化、血管壁平滑肌层退化以及管壁纤维玻璃样变性及胶原蛋白沉积,进而引起脑实质慢性缺氧与反复低灌注[6],影像学上表现为脑白质区高信号影,分布于侧脑室周围及深部脑白质区。
双侧大脑半球在功能上有一定的分工,存在不对称性,不同脑区受损时临床症状表现不一,如左侧大脑半球Broca区受损时会出现运动性失语症,而右侧大脑半球前额叶受损时患者表现出空间操作任务能力减低,因此,急性脑梗死的发生位置与患者的功能及预后密切相关。WMHs在双侧大脑半球常表现为对称性,也可以表现为不对称性,主要与左右半球偏侧化突触网络及微结构白质束受损程度有关[7-8],因此,探索这种损伤与腔隙性脑梗死的发生位置非常重要,可以指导临床进行早期干预。双侧大脑半球存在不同的神经传递通路,左侧大脑半球受多巴胺依赖较多,右侧大脑半球受去甲肾上腺素依赖较多。Low等[9]在研究AD的WMHs中发现,左侧半球WMHs受累较右侧半球多,原因在于AD患者的多巴胺能神经通路受损导致依赖多巴胺的左半球出现更大的血管损伤。在脑小血管病的研究中,Ryu等[4]发现WMHs的半球优势与同一侧陈旧腔梗及新鲜腔梗密切相关,而与脑内微出血无关。本研究发现WMHs左偏的患者92.3%的ALI位于左侧大脑半球,而WMHs右偏的患者86.7%的ALI位于右侧大脑半球,与上述文献结论一致,提示脑白质高信号严重的大脑半球白质的神经网络缺失、脱髓鞘改变及星形胶质细胞增生更加严重,脑组织缺血缺氧,进而加重脑细胞坏死,导致急性梗死发生。既往研究[10-11]发现,WMHs是新发腔隙性脑梗死的独立危险因素,WMHs周围同时存在结构半暗带和血流半暗带,其损伤严重程度较WMHs低,并且可能转化为WMHs。Duering等[12]在研究新发腔梗与WMHs位置关系时发现90%的新发腔梗灶位于WMHs边缘或与WMHs部分重叠,10%的病灶远离WMHs或位于WMHs内部。本研究也发现位于半卵圆中心及侧脑室旁白质区梗死灶中72%位于WMHs边缘或部分重叠,进一步验证了WMHs边缘容易受到缺血缺氧攻击,出现新发脑梗死,因此,明确WMHs半暗带的发生机制,有可能成为延缓WMHs进展的关键靶点。
入院时NIHSS评分是反映患者入院时神经系统功能的量表,评分越高,患者的神经功能缺损越严重,脑组织缺血缺氧程度越重。本研究中,相对于WMHs对称组,WMHs偏侧组NIHSS评分低,说明白质受损差异可能影响患者意识水平、运动感觉等神经功能评分[7],这需要进一步探索研究。另外,在本研究中,两组患者同型半胱氨酸均高于正常参考范围,说明高同型半胱氨酸能够加速动脉粥样硬化,是脑卒中的独立危险因素,因此控制同型半胱氨酸水平对于预防脑卒中有重要的意义[13]。
本研究中还存在一些不足。(1) WMHs按照Scheltens评分相差3分作为WMHs对称或偏侧的分界,存在主观偏倚,需要进一步扩大样本量或者调整分界值进行验证。(2)本研究采用视觉评估WMHs存在一定局限性,无法反映白质微结构改变以及细微的脑白质损伤,后期将进一步通过扩散张量成像(diffusion tensor imaging,DTI)研究白质损伤及神经网络重组,文献报道[14]脑白质的完整性可以预测卒中后早期神经功能,那么对于WMHs偏侧性的患者,卒中预后情况值得下一步探索研究。
综上所述,本研究发现在WMHs偏侧的患者中,白质损伤严重的大脑半球更容易发生急性缺血,且缺血灶多位于WMHs边缘。
利益冲突:无。

