超微血管成像和超声造影对乳腺癌病灶内微血流及超微血管的评价及其联合诊断价值
丁敏侠,严 婷
(1. 西安交通大学医学院附属三二〇一医院 超声医学科,陕西 汉中 723000;2.西安交通大学附属红会医院 超声科,陕西 西安 710054)
乳腺癌是女性常见恶性肿瘤,发病率近年来逐渐增高,是女性的重要死因之一[1]。研究病灶血流、血管情况有助于乳腺癌早期诊断,对治疗方案的制定、疗效评价均有重要意义。超声造影(CEUS)通过利用造影剂的声散射特性可实时动态观察病灶血流灌注过程,客观反映肿瘤血液供应特征[2]。超微血管成像(SMI)是一项新型多普勒成像技术,无需造影剂即可清晰显示微小血管中低速血流信号,进而了解病灶微血管情况,是乳腺癌术前评估的重要手段[3]。本研究选取2017年6月至2019年3月我院收治的经手术病理证实的乳腺癌患者106例(106个肿块)作为研究对象,联合应用SMI和CEUS,对乳腺癌病灶内微血管及血流供应情况进行观察,探讨二者联合检查在乳腺癌诊断中的临床应用价值。
1 资料与方法
1.1 一般资料
选取2017年6月~2019年3月我院收治的经手术病理证实的乳腺癌患者106例(106个肿块),均为女性,年龄36~71岁,平均(51.62±10.57)岁。所有患者术前均完成彩色多普勒血流显像(CDFI)、CEUS、SMI检查,检查前未接受任何抗肿瘤治疗,病理资料及影像资料完整。
1.2 方法
1.2.1检查方法
采用飞利浦IU-Elite及EPIQ5彩色多普勒超声诊断仪,高频线阵探头,探头频率5~12 MHz,配备CDFI、CEUS及SMI显像内置软件。检查时,患者取仰卧位,嘱其上举双臂以尽可能显露双侧乳房,先行高频彩超检查,了解肿块形态学特征,包括肿块位置、大小、内部回声等,然后再行彩色多普勒超声检查,选取血流最丰富切面,启动SMI技术,选取适当大小取样框(一般为2~3倍肿块大小),在SMI模式下,对肿块内部及周边血管情况进行观察并记录,之后切换至CEUS模式。经肘静脉注入造影剂声诺维(瑞士Bracco International B.V.)4.8 mL,固定探头,维持观察切面不变,进行造影剂灌注情况的动态观察,持续3 min,记录动态影像以备分析。
1.2.2图像分析
所有图像分析均由2名高年资超声医师进行。根据Adler法[4]进行血流信号分级:肿块内部及周边无血流信号,为0级;发现1~2个点状或呈短棒状的血流信号,即少量血流信号,为Ⅰ级;发现3~4个点状血流信号或1个较为清晰的长棒状血流信号(长度与肿块半径相当或超过肿块半径),即中量血流信号,为Ⅱ级;≥5个点状血流信号或>2个较长的血流信号,即多量血流信号,为Ⅲ级。其中0级或I级表示血流不丰富,Ⅱ级或Ⅲ级表示血流丰富。以1个切面上血管长度大于1/3的肿块最大径,同时频谱多普勒可探测到稳定动脉频谱作为穿支血管判断标准。
1.3 统计学分析
使用SPSS 20.0进行数据分析。定性资料对比用χ2检验;采用加权Kappa一致性检验分析SMI与CEUS,判断乳腺癌血流信号的一致性,Kappa值=1表示两种判断方法完全一致,Kappa值≥0.75表示一致性较好,Kappa值<0.4表示一致性较差,kappa值=-1表示完全不一致;采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌患者病理组织学分类
106例乳腺癌中,浸润性导管癌90例、导管内癌10例、黏液癌4例、浸润性导管癌合并导管原位癌2例。
2.2 SMI和CEUS对乳腺癌的诊断准确率
106例乳腺癌中,SMI和CEUS对乳腺癌的诊断准确率分别为79.25%(84/106)、83.96% (89/106),两者比较差异无统计学意义(χ2=0.554,P>0.05);SMI联合CEUS检查对乳腺癌的诊断准确率为96.23%(102/106),明显高于单一SMI或CEUS的诊断准确率,差异均有统计学意义(χ2=8.229、4.968,P<0.05)。
2.3 SMI和CEUS对乳腺癌病灶内血流信号和穿支血管的显示
106例乳腺癌(106个肿块)中,在血流信号显示上,SMI检出不丰富血流信号、丰富血流信号分别为64个、42个;CEUS表现为低增强42个、等增强及高增强为64个;SMI和CEUS评价乳腺癌病灶内微血管及血流供应情况具有较好的一致性(Kappa值=0.712,P<0.05),见表1和图1。在穿支血管显示上,SMI检出44个,CDFI检出34个,SMI能够清晰检出CDFI不能检出的穿支血管10个。
3 讨论
乳腺癌是威胁女性生命健康的常见恶性肿瘤,病情进展迅速,预后较差[5]。临床怀疑乳腺存在肿块时,需行超声检查以明确肿块部位、性质[6]。CEUS弥补了常规彩超在不典型肿块和肿块中低血流量血管显示能力不足的缺点,可清晰呈现肿瘤微血管情况,成为乳腺癌早期无创诊断的重要技术[7]。
准确判断乳腺肿块性质可为治疗方案制定及预后评估提供重要依据,故寻找高敏感度及特异度的检查方法成为影像医学研究的热点。随着超声造影剂的诞生及应用,CEUS在乳腺肿块定性上表现出明显优势,能够正确判断常规彩超无法定性的肿块,经肘静脉注入造影剂能够清晰显示乳腺肿瘤微血管情况[8]。CEUS于静脉注入造影剂,造影剂微泡能够增强多普勒血流信号,进而提高组织血流对比度,使低速血流信号得以检出[9]。造影剂声诺维的直径非常小,通过其微泡声散射特性,提高肿块与正常组织的声阻抗差异,从而清晰呈现一些常规彩超无法显示的异常血流灌注情况,提高诊断的准确度[10]。SMI是一项新型血流成像技术,通过自适应算法来识别血流及组织运动产生的噪声,并利用独特滤波技术来呈现真正血流信息,有着较高空间分辨力、帧频成像,较少运动伪影,可清晰显示微小血管中低速血流信号,对于乳腺肿块表现巨大诊断作用[11]。本研究结果显示,SMI和CEUS对乳腺癌的诊断准确率分别为79.25%、83.96%,而SMI联合CEUS检查对乳腺癌的诊断准确率高达96.23%,表明SMI和CEUS诊断乳腺癌均有较高的准确率,而SMI和CEUS联合检查有助于进一步提高乳腺癌的诊断准确率。

表1 SMI和CEUS对乳腺癌病灶内血流信号的评价[n(%)]
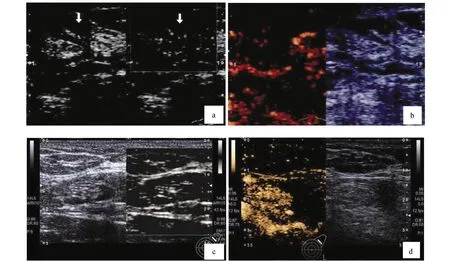
图1 SMI和CEUS对乳腺癌病灶内血流信号的评价a和b为同一患者,SMI显示病灶内血流信号不丰富(a),CEUS显示低增强(b);c和d为同一患者,SMI显示病灶内血流信号比较丰富(c),CEUS显示为等增强(d)
肿瘤的发生、发展与血管新生密切相关,而常规CDFI技术仅可呈现较大血管,在新生微血管显示上能力不足[12]。SMI技术可有效规避组织运动引起的噪音,排除低速血流信号混叠现象,可较好呈现低速血流和微血管情况,利用侧动探头能够动态呈现肿瘤整体血管网结构和穿支血管,较为客观地反映肿瘤血流灌注状况[13]。在SMI检查中,左侧乳腺肿块易为心脏搏动所影响而出现干扰伪影,故对检测操作有着更高的要求,检查时务必稳固探头,缓缓进行切面的更换,耐心观察并获取最佳切面图像以待分析[14]。CEUS可动态观察病灶血流灌注过程,CEUS表现出等、高增强,提示肿块内部填充着较多造影剂、存在较多血管、有着较为丰富的血流供应;表现为低增强,提示肿块填充着较少造影剂、存在较少血管、血流供应较少[15]。造影剂声诺维在低机械指数超声下可产生微泡谐振而不会致使气泡破裂,是临床常用的声学造影剂,通过对肿块内部造影剂灌注状况进行观察,可获取更丰富的肿瘤血供信息[16]。本研究结果显示,SMI和CEUS评价乳腺癌病灶内微血管及血流供应情况具有较好的一致性,且SMI对乳腺癌病灶内穿支血管的显示有一定优势。
综上所示,SMI和CEUS评价乳腺癌病灶内微血管及血流供应情况具有较好的一致性,对乳腺癌均有较高的诊断价值,二者联合检查可进一步提高乳腺癌的诊断准确率。但本研究病例数较少,需进一步扩大样本量分析验证,此外,肿块微血管评价的金标准是应用免疫组化法测定微血管密度,但由于条件限制,未能进行与微血管密度的相关性分析。

