内镜下乳头括约肌切开术后严重并发症的外科治疗策略
胡 刚,孙宏伟,黄 镇,贾志超,杨建武,李成林,崔 彦 (.战略支援部队特色医学中心普通外科,北京 000;.民航总医院普通外科,北京 003)
经内镜下乳头括约肌切开术(endoscopic sphincterotomy,EST)已广泛应用于临床并取代了部分传统外科开腹手术,是一种较安全的手术方式。但是受患者解剖结构异常、疾病状态以及内镜医生操作水平等因素的影响,EST及其相关操作后有部分患者出现胰腺炎、胆管炎、出血及穿孔等并发症[1-2]。大部分并发症能通过保守治疗治愈,但也有极少数患者会出现严重并发症,如消化道大出血、穿孔导致的急性弥漫性腹膜炎、胰周坏死伴感染等,保守治疗预后不佳,需要及时进行外科手术治疗。既往的研究并未对EST后严重并发症外科干预的适应证及手术要点进行系统描述,更无指南可循。故本研究回顾性分析28例EST后出现严重并发症并经手术治疗的患者临床资料,以期对此类手术的规范化处理经验进行初步归纳总结,现报告如下。
1 资料与方法
1.1 临床资料
战略支援部队特色医学中心和民航总医院普通外科2012年1月至2019年12月收治的EST后出现严重并发症的患者共28例,其中男13例,女15例;年龄36~70岁,平均52.6岁(表1),均进行外科手术治疗。所有患者均按《中国ERCP指南(2018版)》[3]进行操作,操作时间为1.8~2.5 h,平均2.35 h。
纳入标准:①消化道大出血速度快,短期内发生休克;②短时间内(6~8 h)需要输注大量血液(800 mL以上)才能维持血压和Hct;③保守治疗期间反复出血而内镜止血无效;④出现十二指肠穿孔,腹部CT检查提示腹腔内有较多游离气体,甚至出现腹膜炎体征;⑤重症胰腺炎导致胰周坏死伴感染、胰周脓肿形成,腹部增强CT提示胰周及后腹膜不规则液化区域或伴有气体影,患者长期反复发热、腹痛。排除标准:①消化道出血能通过保守治疗控制;②EST后高淀粉酶血症或胰腺炎,经过保守治疗病情无进展。本研究通过战略支援部队特色医学中心和民航总医院医学伦理委员会审核。
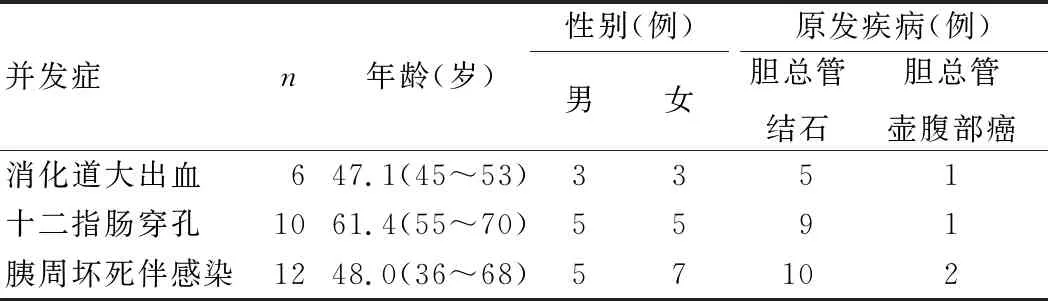
表1 EST后严重并发症行外科手术患者资料
1.2 EST术后严重并发症手术方法
所有患者术前均完善相关检查及化验,常规备血,术前30 min或者开始手术后1 h内给予广谱抗生素静脉滴注。
本研究6例消化道大出血患者中,4例患者无呕血,但EST后持续心率快,当日复查血常规提示术前血红蛋白含量平均为123.5 g/L,给予红细胞悬液输注,次日复查提示血红蛋白含量继续进行性下降至99.4 g/L;另2例患者EST前心率为60~70次/分钟,而EST后3~6 h心率升至130~140次/分钟,收缩压为70~80 mmHg,出现休克表现。6例患者均经右上腹腹直肌切口进腹,充分游离十二指肠降部,打开前壁或者外侧壁,清除肠管积血后,显露十二指肠乳头切开部位,找到出血点,4-0 prolene线缝扎彻底止血,注意避免缝闭胰管及胆管,以免导致胰管及胆管狭窄。随后关闭肠壁开口,必要时行十二指肠造瘘并放置空肠营养管。
发生十二指肠穿孔的10例患者中,7例为EST过程中切开乳头后壁过深,怀疑穿孔,返回病房当日复查腹部CT提示少量造影剂外溢至腹膜,给予保守治疗1~2 d后,腹部症状持续加重,并出现腹膜炎体征(图1);另外3例为乳头部位憩室较大,影响操作,不慎切开位于乳头侧壁的十二指肠肠壁,当即复查腹部CT,可见造影剂进入腹腔,出现腹痛及腹膜炎体征,当日即行开腹手术。10例患者均经上腹正中切口进腹,打开kocher切口向左至腹主动脉右侧缘,充分显露胰头后方,找到位于后壁或者侧壁的穿孔。本组中2例患者穿孔较局限,给予4-0 prolene线全层缝合;另8例患者穿孔部位涉及胆总管及乳头侧,炎症较重,缝合不满意,给予旷置后充分引流,并行近端十二指肠造瘘。随后10例患者均行穿孔部位近端胃肠减压、空肠营养、T管引流,十二指肠穿孔部位及腹膜后均予以充分引流。
12例患者由于EST后局部炎症加重,导致胰周坏死伴感染,患者EST后1~2周反复发热、血象高、消化功能差,复查上腹部增强CT提示胰腺局部坏死,周围广泛形成脓肿。本组中10例患者腹膜后广泛积液积脓,取上腹正中切口进腹,行坏死及脓肿部位切开引流,充分清除感染及坏死病灶;2例患者感染波及腰大肌前方(图2),行侧腹膜广泛切开,彻底清除积脓后,根据感染所在部位放置双套管引流。本组12例患者均放置空肠造瘘管或者三腔营养管以便早期行肠内营养支持。

a:十二指肠水平部后方可见游离气体及造影剂外溢;b:十二指肠降部外侧可见游离气体及造影剂外溢
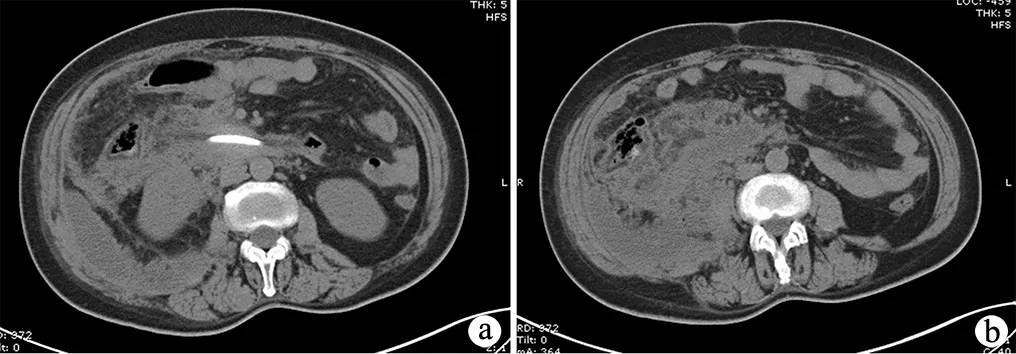
a:右侧结肠旁沟可见液体积聚;b:腹膜后及右侧结肠旁沟可见广泛炎性渗出并混杂含气影
1.3 观察指标
归纳总结患者术中引流、营养管放置情况和术后恢复情况。
2 结果
2.1 术中引流放置情况
本研究中28例患者手术过程均顺利,手术时间3~5.5 h,失血量50~500 mL。除4例患者确切缝扎止血外,其他患者均放置空肠营养管或三腔营养管以便空肠营养,所有患者均放置胃肠减压,根据术中情况行十二指肠造瘘及放置T管引流(表2)。
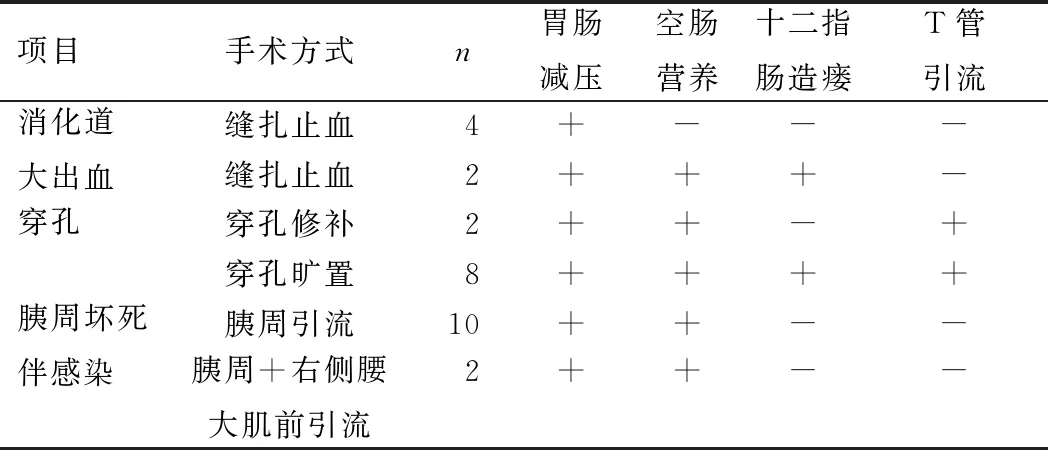
表2 患者减压及营养管情况
2.2 术后恢复情况
所有患者术后均转入ICU,生命体征平稳后转回普通病房,均给予抗炎补液、营养支持、抑酸等治疗,保证引流通畅。待肠功能恢复后,尽早开始鼻饲营养或者空肠营养。消化道大出血患者血红蛋白含量从术前的99.4 g/L逐渐回升至术后7 d的113.4 g/L;穿孔患者术前的平均白细胞计数为19.3×109/L,平均C-反应蛋白为124.5 mg/L,术后4 d平均白细胞计数降至14.4×109/L,平均C-反应蛋白降至103.5 mg/L,术后2周基本恢复正常;胰周坏死伴感染患者术前平均C-反应蛋白为198.2 mg/L,术后1 d即出现明显下降,平均162.5 mg/L,术前平均白细胞计数为18.3×109/L,术后4 d降低至14.15×109/L,并逐步恢复至正常水平(图3)。术后待引流液清亮、量少后拔除腹腔引流管,术后1个月拔除T管,经口进食正常后择期拔除空肠营养管或者三腔营养管。
本组患者术后住院时间为8~36 d,其中27例患者恢复顺利,无严重术后并发症;1例胆管癌老年患者行胆道支架植入后出现重症胰腺炎,因胰周坏死及脓肿形成行感染病灶清除,虽腹腔感染好转明显,但术后10 d左右开始出现肺部感染并逐渐加重,于术后39 d死亡。
3 讨论
上世纪80年代开始,EST在胆胰疾病的微创治疗中逐步开展,其技术也日益成熟。但作为一项有一定风险的侵入性操作,EST及其相关操作的并发症并不少见,根据《中国ERCP指南(2018版)》统计,EST总体并发症发生率约7.92%,重症并发症发生率为0.37%,病死率为0.26%[3]。常见的并发症包括术后胆胰管结石复发、高淀粉酶血症、胰腺炎,而较少见的严重并发症包括消化道大出血、十二指肠穿孔及重症胰腺炎等。严重并发症不宜保守治疗或者保守治疗效果欠佳的患者需要及时手术处理。
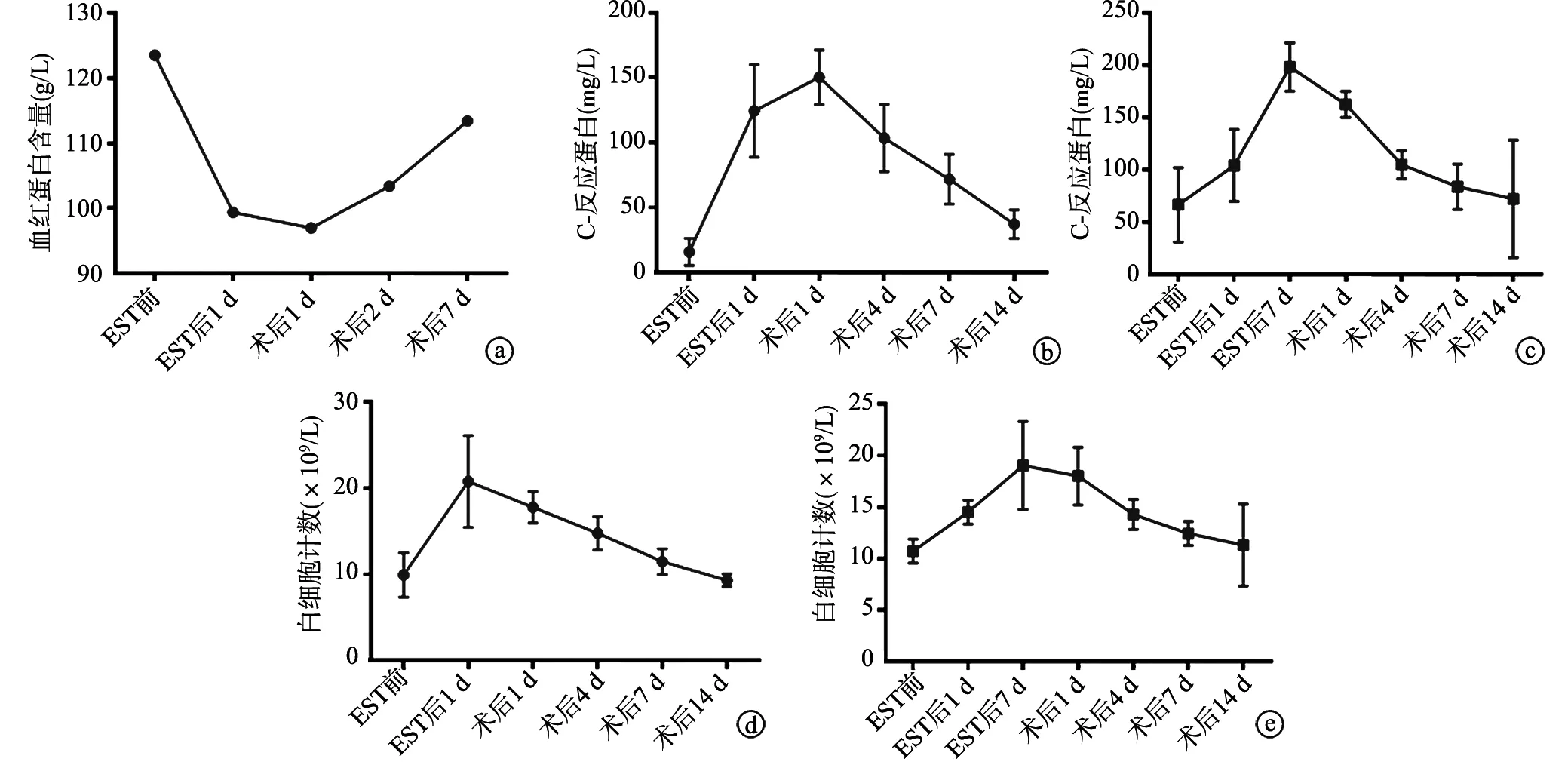
a:消化道大出血患者血红蛋白含量变化趋势;b:穿孔患者C-反应蛋白变化趋势;c:胰周坏死伴感染患者C-反应蛋白变化趋势;d:穿孔患者白细胞计数变化趋势;e:胰周坏死伴感染患者白细胞计数变化趋势
EST及其相关操作引起消化道出血的概率为0.3%~2%,出血的原因主要是行乳头切开时损伤十二指肠乳头部位的血管[2]。供应胆总管下段及十二指肠乳头的血管为十二指肠后动脉及其分支,该动脉距离乳头开口小于1.0 cm的概率高达15%,易在EST过程中受损[4]。轻度的出血可以通过内镜下电凝止血[5]。但在胆总管结石较大,尤其在直径大于1.0 cm的结石嵌顿时,乳头切开可能会超过1.0 cm,若伤及十二指肠后动脉及分支,容易引起大出血。出血凶猛时,视野迅速被污染,内镜下采用止血夹止血往往十分困难,甚至会导致二次损伤,加重出血,造成严重的后果[6]。预防EST后消化道大出血首先需要在EST过程中精细轻柔地操作,避免括约肌切开过大;其次,对过大的胆总管结石进行反复操作也容易引起出血,部分患者给予止血及输血等保守治疗后可逐步控制出血,但是若保守治疗效果欠佳,在有手术指征的情况下应积极行急诊手术。
本研究手术处理的6例EST后消化道大出血患者,1例为壶腹部恶性肿瘤,术前胆道梗阻时间长,肝功能损伤,凝血机能下降,EST操作中括约肌切开较困难,操作过程中出现管壁大出血;另5例患者胆总管内结石直径超过1.0 cm,因多次反复操作而出现管壁破损,出血迅速充满内镜下视野,内镜下止血夹无法准确钳夹止血,而且出血部位距离乳头开口小于1.0 cm,极有可能伤及其中的十二指肠后动脉。临床实践表明,这种情况下只有积极的手术止血才能挽救患者的生命。少数有经验的内镜中心会尝试介入手术,进行动脉栓塞治疗[6],但由于十二指肠后动脉来源于胃十二指肠和肠系膜上动脉的交汇支,栓塞治疗成功率低,大多数内镜中心目前仍然选择开腹手术治疗[7]。外科手术处理此类出血时需要对十二指肠降部充分游离显露,因为出血部位有可能位于乳头部位的侧壁,甚至后壁;必须要全层缝合以确切止血,注意胆胰开口的位置,特别是胰管开口,以免引起胆胰管出口狭窄。同时,本研究建议术中放置胃肠减压和空肠营养管或者三腔营养管,尽早开始肠内营养支持,以促进患者恢复。
EST后出现穿孔的主要原因包括乳头旁憩室、壶腹部插管困难、切开刀插入过深、乳头切口过大和切开方向偏离等[8-11]。本组穿孔患者均存在壶腹部憩室,1例患者为巨大憩室,直径约3.0 cm,压迫壶腹括约肌,导致导丝放置及乳头切开操作困难。壶腹部周围的穿孔按部位可以分为Ⅰ~Ⅳ型,Ⅱ~Ⅳ型均需要手术治疗[12]。穿孔后患者出现腹痛及腰痛等症状,查腹部CT可见腹腔内游离气体及造影剂外溢,保守治疗无效的患者病情会继续加重,出现腹膜炎体征,需要外科手术治疗。术前腹部CT发现局部肠壁增厚或缺损对定位穿孔部位有较高的推测价值,有助于术中寻找穿孔部位[13]。陶杰等[14]的研究报道,十二指肠穿孔的早期诊断以及早期开腹手术对促进患者恢复、减少严重并发症、改善预后有重要作用。朱学锋等[15]的研究表明,壶腹周围及腹膜后的充分引流是手术的关键。本研究发现,手术过程中行穿孔部位的充分游离有利于找到穿孔部位,缝合确切时可尝试简单缝合,无法缝合时则不建议勉强缝合,而应改行穿孔部位充分引流,同时行胆总管切开T管引流,放置空肠营养管或者三腔营养管,修补欠满意者需要行十二指肠造瘘,避免穿孔部位愈合不良。
根据文献报道,EST后胰腺炎的发生率为1.5%~17%,乳头括约肌被破坏、壶腹压力增高都是导致胰腺炎发生的因素[16-18]。其诊断标准为术后48 h内出现的持续性腹痛、血清淀粉酶数值超过其正常值3倍以上、腹部影像学提示胰腺炎改变,以上3条中满足2条即可诊断为胰腺炎。临床上,绝大部分EST后胰腺炎为急性水肿性胰腺炎,经过积极药物治疗及液体复苏能逐渐恢复;但是少数会恶化,发展成为重症胰腺炎,甚至出现胰周坏死伴感染及脓肿形成,经久不愈。胰周坏死伴感染及脓肿形成的患者主要表现为持续且严重的腹背部疼痛及反复发热,部分患者出现多脏器功能障碍,此类患者需要及时手术治疗[19-20]。
EST后胰周坏死伴感染及脓肿形成的手术适应证与单纯重症胰腺炎发展而来的胰周坏死伴感染及脓肿形成的手术适应证基本一致。手术操作为开腹手术,原则为充分清除坏死感染组织,对感染部位进行充分引流。早期的肠内营养对肠道通透性、氧化应激及器官功能方面有改善作用[21]。本研究中12例EST后出现重症胰腺炎患者均迁延不愈,持续发热,血淀粉酶正常或者高于正常值,白细胞计数及C-反应蛋白计数持续升高,腹部增强CT提示胰周坏死组织形成,合并双侧腰大肌前方感染病灶。12例患者均行手术治疗,术中轻柔操作,以避免损伤腹膜后的大血管引起大出血;胆总管引流不畅者放置T管引流,并放置空肠营养管或者三腔营养管,尽早开始肠内营养。
EST后严重并发症应引起高度重视,若有明确的手术适应证,需及时进行外科手术干预以避免病情恶化,加速患者康复,挽救患者生命。手术适应证的合理选择、术中充分显露、合理的手术方式、充分的引流及尽早开始肠内营养支持是手术治疗的关键点。