外周血嗜酸性粒细胞计数、触珠蛋白及淀粉样蛋白A、降钙素原在COPD 合并肺部感染者的临床诊断价值分析
曹 焱,刘 爽,毛 勇
(六安市中医院检验科,六安 237006)
慢性阻塞型肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的慢性肺疾病,患者常表现为慢性咳嗽、咳痰、呼吸困难等症状,以中老年人为多发人群[1,2],现研究证实合并肺部感染可加重患者COPD 疾病进展,因此肺部感染的早期诊断和治疗成为重要目标[3]。触珠蛋白(Haptoglobin,HPT)是一种新型的感染相关疾病的蛋白质[4],但目前其与COPD 合并肺部感染患者关系研究较少,故设立本次研究以挖掘新的诊断依据,现报道如下。
1 资料与方法
1.1 资料来源选取2017 年4 月~2019 年4 月间我院肺病科收治的271 例COPD 患者,所有患者均符合中华医学会呼吸病学分会对COPD 的相关诊断[5]。排除合并支气管哮喘或支气管扩张的患者,因精神疾病或其他原因不能依从配合的患者,正在使用激素类药物的患者。根据患指是否合并肺部感染分为感染组和未感染组,分别95 例和176 例。感染组患者男性54 例,女性41 例;年龄58~78 岁,平均年龄(69.49±6.43)岁;病程6~12 年,平均病程(9.23±2.41)年。未感染组患者男性97 例,女性79 例;年龄60~77 岁,平均年龄为(68.63±7.21)岁;病程6~13 年,平均病程(9.86±2.68)年。两组患者性别、年龄、病程等一般资料差异均无统计学差异,具有可比性(P>0.05)。本研究经患者或家属知情同意,且获得医院伦理委员会审核批准。
1.2 研究方法
1.2.1 病原培养由专业医务人员采取无菌操作对环境状态下患者进行深部痰标本采集,吸取痰液标本后立即放置于无菌培养杯,标本于1 h 内送至检验科采用PhoenixTM100 细菌鉴定仪进行病原菌分离培养。
1.2.2 血生化检测采集患者清晨空腹外周血6 mL,嗜酸性粒细胞(Eosinophils,EOS)计数使用SYSMEX XN 系列血球分析仪进行测定,采用免疫比浊法检测HPT、淀粉样蛋白A(Amyloid protein A,SAA)、降钙素原(Procalcitonin,PCT)水平(试剂盒由宁波美康生物科技技术有限公司提供)。
1.3 统计分析使用SPSS 20.0 软件进行统计学分析。其中,计数资料使用频数表示,卡方检验进行比较;计量资料使用均数±标准差表示,独立样本t 检验进行比较;敏感度以特异度的比较使用McNemar 检验。P<0.05,表示差异具有统计学意义。
2 结果
2.1 感染病原菌分布特征感染组95 例病例培养分离各类细菌及真菌共132 株,其中革兰氏阴性菌居首,共89 株,占比67.42%,以铜绿假单胞菌、肺炎克雷伯菌为主要病原菌(22.73%、18.94%);其次为革兰氏阳性菌,共32 株,占比24.24%,以金黄色葡萄球菌为主要病原菌(12.88%);真菌共11 株,占比8.33%,以白念珠菌为主要病原菌(5.30%),见表1。
2.2 血生化指标比较经独立样本t 检验,感染组患者HPT、SAA、PCT 水平均高于对照组,EOS 计数水平低于对照组,差异均具有统计学意义(P<0.05),见表2 。
2.3 各指标及联合诊断价值比较经McNemar 检验,各指标的敏感度均低于联合诊断的敏感度(P<0.05),见表3。
3 讨论
在周敏等人的调查中报道,由于患者长期咳嗽无力及排痰不畅导致肺功能进行性恶化,纤毛气道自身清洁能力降低,细菌易在支气管内大量增殖和聚集,发生肺部感染,诱发COPD 病情急性加重[6]。本次研究发现感染组患者HPT、SAA、PCT 水平均高于对照组,EOS计数水平低于对照组。在王艳[7]、叶青[8]等人的研究中报道肺部感染能够促进体内炎性因子的产生,而炎症因子能够通过机体生化反应促进HPT、SAA、PCT 等反应蛋白水平的升高,其中HPT 是一种由肝脏分泌α2球蛋白[9],SAA 是由肝脏及肺脏等炎性组织产生[10],PCT是由神经内分泌细胞和甲状腺滤泡旁细胞分泌[11],三者均为机体发生感染时反映炎性水平的观察指标,且COPD 的本质也是一种炎症反应疾病[12],因此对照组患者HPT、SAA、PCT 较正常范围高,观察组患者水平较对照组高。EOS 是由人体骨髓的造血干细胞产生的免疫细胞[13],在既往研究中报道C 反应蛋白(C reactive protein,CRP)水平与EOS 水平呈负性相关,即在COPD合并肺部感染的患者血清中CRP 的水平升高时,EOS水平降低[14,15];COPD 合并肺部感染的患者急性肺损伤引起机体免疫应激状态,通过神经体液调节刺激“下丘脑-垂体-肾上腺皮质轴”,促进皮质醇水平的升高以帮助减少炎症,但皮质醇水平的升高抑制了EOS 释放,造成EOS 水平降低[16,17]。
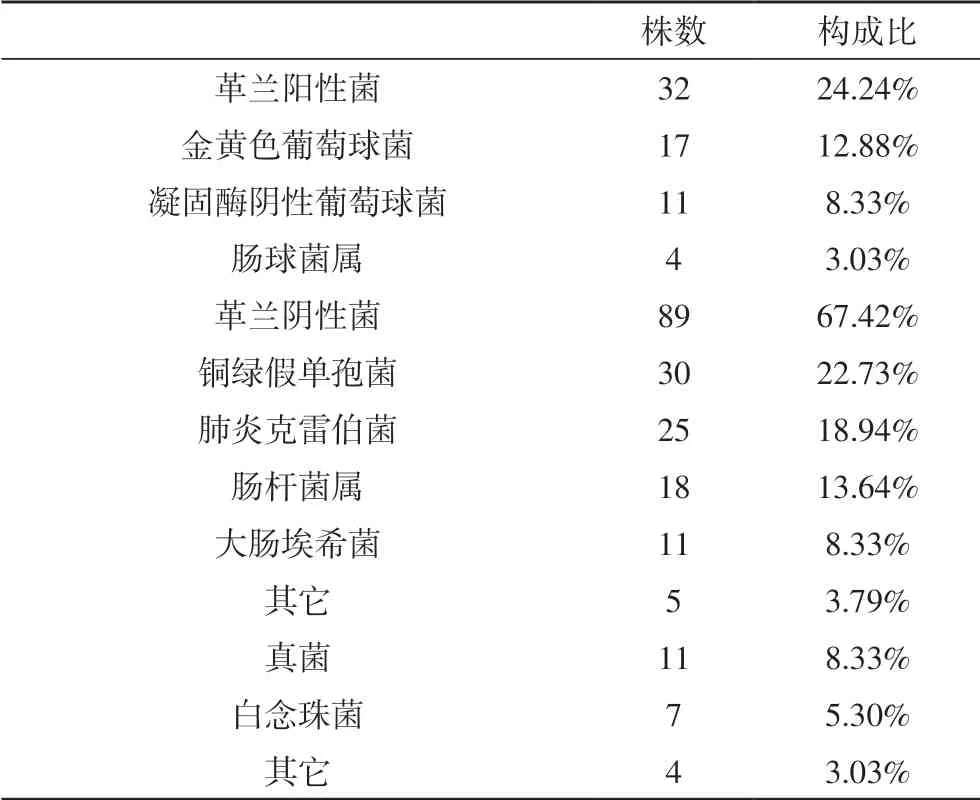
表1 感染病原菌分布及构成比

表2 两组患者外周血EOS计数、HPT及SAA、PCT比较
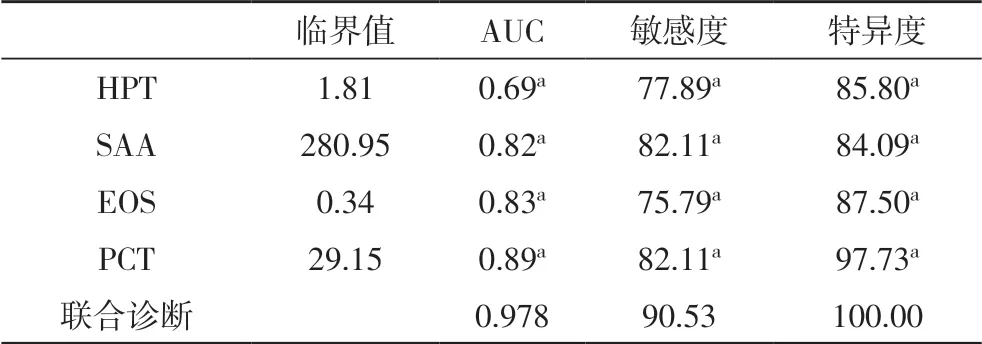
表3 各指标及联合诊断价值比较
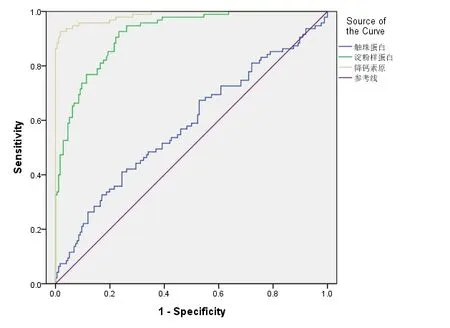
图1 HPT、SAA和PCT的ROC曲线图
同时本次研究对上述各指标对COPD 合并肺部感染患者的诊断价值分析中表示,四项指标联合诊断的敏感度及特异度均高于各指标的敏感度及特异度。创伤、风湿、肿瘤均可引起HIP 水平的升高[18];SAA 是机体急性相的敏感指标,小范围的炎症反应时也会显著升高;EOS 的降低也见于长期应用肾上腺皮质激素的治疗的患者;在既往研究中报道PCT 在病毒感染及非特异性炎症的中水平变化不显著[19],上述四项指标分别对COPD 合并肺部感染的诊断均具有局限性,因此将HPT、SAA、PCT、EOS 四项指标联合以提高COPD 合并肺部感染患者的诊断效能。
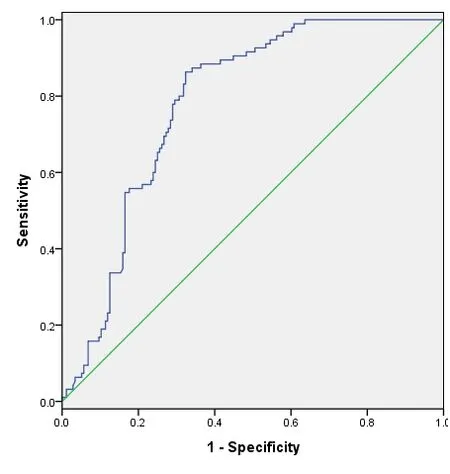
图2 EOS的ROC曲线图

图3 联合诊断ROC曲线图
对肺部感染患者痰液标本进行培养是目前临床主要的病因检测方式,本次研究通过养分离痰标本中的病原体,得到细菌及真菌共132 株,其中革兰氏阴性菌居首,共89 株,占比67.42%;其次为革兰氏阳性菌,共32 株,占比24.24%;真菌共11 株,占比8.33%,与李晖等人对脑卒中并发肺部感染患者病原培养所得结果一致[20]。革兰氏阴性菌与阳性菌主要鉴别特点是阴性菌具有双层细胞壁,其外膜能够抵挡人体自身免疫细胞破坏其生命结构,较阳性菌“生命力更顽强”,因此阴性菌较阳性菌更易在人体内生存繁殖[21]。阴性菌中又以铜绿假单胞菌、肺炎克雷伯菌为主要病原菌,铜绿假单胞菌广泛分布于人体皮肤、胃肠道,对于患者长期缺氧和营养不良引起机体免疫抵抗能力不足,造成铜绿假单胞菌的侵袭[22];而肺炎克雷伯菌不仅能够保护自身不被白细胞吞噬,还能有选择性的粘附于目标细胞表面,达到致病作用[23]。阳性菌以金黄色葡萄球菌为主要病原菌,金黄色葡萄球菌在人体内菌群平衡失调、自身免疫能力下降时,分泌毒素,导致免疫细胞的死亡从而大量繁殖达到致病作用[24]。真菌中以白念珠菌为主要病原菌,分泌念珠菌毒素,这种毒素有抑制人体免疫功能,与细菌协同作战,互相助长,破坏人体内菌群平衡,能够加重人体加重感染[25]。临床治疗需明确致病菌,正确合理使用抗菌药物。
综上所述,COPD 合并肺部感染主要致病菌是铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、白念珠菌,以革兰氏阴性菌为主;血生化指标分析COPD 合并肺部感染的患者HPT、SAA、PCT 呈高水平,EOS 呈低水平,且联合检测四项指标能进一步提供对COPD 合并肺部感染的诊断效能。

