前循环脑梗死伴TIA 人群临床预后及潜在影响机制探讨
王 磊,方云亮,谢 磊
(淮南东方医院集团肿瘤医院神经内科,淮南 232000)
END 是指急性脑梗死在发病早期即出现病情显著恶化及持续性进展,该类人群比例约为15%~30%;伴END 患者临床预后往往更差,继发后遗神经病变及死亡风险较其他人群更高[1]。相关基础实验研究证实[2],中枢神经系统炎症反应水平异常升高是导致急性脑梗死患者END 发生重要原因;而中枢神经系统在轻微、短期缺血性刺激下可激活脑部内源性保护机制形成,增强自身缺血缺氧耐受能力。颅内血管急性短暂性缺血性病变以TIA 最为常见,患者症状体征多在发生1h 内明显缓解或消失,且多无后遗神经病变风险,故此类人群应具有更高中枢神经系统缺血缺氧耐受程度[3];另有报道提示,急性脑梗死模型动物如在发病前出现TIA 则病变范围较未出现更小,神经功能损伤程度亦更轻[4]。本次研究旨在探讨前循环脑梗死伴TIA 人群临床预后及潜在影响机制,为后续临床防治工作提供更多参考,现报道如下。
1 资料与方法
1.1 临床资料纳入前循环脑梗死患者共74 例中伴TIA 共25 例,未伴TIA 共49 例;未伴TIA 者患者中男性29 例,女性20 例,平均年龄为(63.76±5.85)岁;病变类型:大动脉粥样硬化型26 例,小动脉闭塞型16 例,心源性栓塞型2 例,不明原因型5 例;合并基础疾病类型:原发性高血压10 例,2 型糖尿病13 例,冠心病20例,高脂血症18 例,房颤3 例;伴TIA 者患者中男性14例,女性11 例,平均年龄为(63.29±5.75)岁:病变类型:大动脉粥样硬化型13 例,小动脉闭塞型7 例,心源性栓塞型1 例,不明原因型4 例;合并基础疾病类型:原发性高血压6 例,2 型糖尿病7 例,冠心病9 例,高脂血症10 例,房颤2 例;伴和未伴TIA 者一般资料比较差异无显著性(P>0.05)。患者或家属签署知情同意书,且方案方案经本院伦理委员会批准。
1.2 纳入排除标准
1.2.1 纳入标准①符合《中国急性缺血性脑卒中诊治指南2014》诊断标准[5],且颅脑CT/MRI 检查确认前循环梗死灶存在;②首次发病;③TIA 判定标准为因缺血所致神经功能急性缺失,并在1h 内缓解,且无脑梗死证据;④未伴TIA 者发病48 h 内入院且未见前循环外受累区域;⑤伴TIA 者脑则在梗死发生前存在同侧TIA。
1.2.2 排除标准①既往卒中病史;②病变累及后循环;③TIA 与后续脑梗死并非同一供血系统;④伴急性脑出血;⑤隐匿性脑梗死;⑥严重全身系统性疾病。
1.3 观察指标①神经功能损伤程度评价采用NIHSS量表[6],分别在患者入院和出院时计分;②脑梗死预后评价采用mRS 量表[6],在发病后3 个月内计分;③梗死病灶体积计算公式为最大梗死面横直径×纵直径×总梗死层面高度[6];④hs-CRP 水平检测采用贝克曼AU3000 型全自动生化分析仪,于入院后第2 天检测;⑤END 评价方法为患者入院3 天内再次评价NIHSS 评分,评价由同一神经内科医师完成,如再次评价较初次评价增加2 分及以上则判定为END[6];⑥NF-κB 表达水平检测采用Western Blotting,一抗(p65 单抗)和二抗(HRP 标记山羊抗鼠IgG)均由Santa Cruz 公司提供;蛋白提取自PBMCs,分别于发病后1 天、3 天、7d 及12d各采集空腹静脉血4~5mL。
1.4 统计学方法选择SPSS 20.0 软件分析数据;符合正态分布计量资料比较采用t 检验,以mean±SD 表示;不符合正态分布计量资料比较则采用Wilcoxon 秩和检验,以[M(Q1,Q3)]表示;计数资料比较采用Fisher 确切概率法,以%表示;检验水准为α=0.05。
2 结果
2.1 伴和未伴TIA 者NIHSS 评分比较伴和未伴TIA 者入院时NIHSS 评分比较差异无显著性(P>0.05);伴TIA 者出院时NIHSS 评分显著低于未伴TIA 者(P<0.05),见表1。

表1 治疗前后NIHSS评分比较
2.2 伴和未伴TIA 者梗死病灶体积、mRS 评分及hs-CRP 水平比较伴TIA 者梗死病灶体积、mRS 评分及入院后第2 天hs-CRP 水平均显著低于未伴TIA 者(P<0.05),见表2。
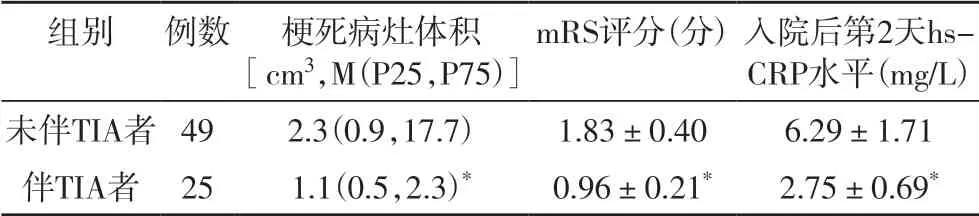
表2 伴和未伴TIA者梗死病灶体积、mRS评分及hs-CRP水平比较
2.3 伴和未伴TIA 者END 发生率比较伴和未伴TIA 者END 发生率分别为26.53%(13/49),8.00%(2/25);伴TIA 者END 发生率显著低于未伴TIA 者(P<0.05)。
2.4 不同时间点NF-κB 表达水平分析伴TIA 者发病后1 天、3 天、7 天及14 天NF-κB 表达水平均显著低于未伴TIA 者(p<0.05);同时未伴TIA 者和伴TIA 者发病后1 天、3 天NF-κB 表达水平均显著高于体检健康者(P<0.05),见表3。

表3 不同时间点NF-κB表达水平分析
3 讨论
急性脑梗死伴END 患者具有致死致残率高、远期预后差等特点;近年来相关研究证实,END 与急性脑梗死术非神经系统后遗损伤加重及存活率下降密切相关;而异常炎症细胞因子释放继发局部免疫炎性损伤加重在疾病发生发展过程中发挥着关键作用,可能是END发生重要始动因素之一[7]。
正常人体内血脑屏障能够有效减轻或消除中枢神经系统炎性损伤,但在急性脑梗死患者中因脑部处于明显缺血缺氧状态,多种促炎细胞因子大量合成分泌,进而持续损伤血管及神经细胞,同时加重血脑屏障损伤,白细胞通过血脑屏障进入缺血脑组织内浸润;同时免疫炎性损伤还可异常激活小胶质细胞和星形胶质细胞,加快炎性相关细胞因子释放入血进程;此外星形胶质细胞、小胶质细胞与白细胞相互作用还可进一步激活促炎细胞因子释放,形成恶性循环,最终引起梗死范围扩大及END 发生[8]。国外学者研究证实,中枢神经系统中白细胞大量浸润能够激活血小板聚集黏附,降低局部微循环灌注量,从而造成脑部缺血性损伤加重[9]。
本次研究结果中,伴TIA 者出院时NIHSS 评分、梗死病灶体积及mRS 评分均显著低于未伴TIA 者,表明急性脑梗死伴TIA 者患者临床预后优于未伴TIA 者;同时伴TIA 者END 发生率和入院后第2 天 hs-CRP 水平均显著低于未伴TIA 者,则进一步提示急性脑梗死伴TIA 者患者发生END 风险明显降低,而这一现象可能与急性脑梗死发病前TIA 出现能够提前刺激中枢神经系统,提高组织缺血缺氧耐受性及抑制炎症反应水平有关。急性脑梗死早期hs-CRP 水平已被证实可用于中枢神经系统炎性损伤程度评价及远期预后评估[10]。
NF-κB 是人体内关键炎症反应信号转导调控因子之一,其能够调节炎症相关基因极早期转录水平,上调炎症递质合成释放水平[11]。已有研究显示[12-13],真核细胞内NF-κB 在正常状态下多游离存在于细胞质内,在组织缺血缺氧损伤发生后NF-κB 被激活并移位至胞核,调控多种炎症相关基因转录,趋化白细胞和血小板黏附于微循环血管内皮细胞内,诱导白细胞浸润,最终加重微循环缺血缺氧状态。本次研究结果中,伴TIA者发病后1 天、3 天、7 天及14 天 NF-κB 表达水平均显著低于未伴TIA 者,证实急性脑梗死伴TIA 患者NFκB 表达水平更低;笔者推测这一现象TIA 能够通过降低外周PBMCs 中NF-κB 表达,拮抗白细胞激活、趋化及中枢神经系统浸润,使得血脑屏障损伤减轻有关;而这还可同时改善脑组织微循环血流灌注,降低或避免END 发生。已有研究结果显示[14],TIA 模型大鼠继发脑梗死后神经组织中炎性细胞因子水平较单纯脑梗死模型大鼠更低,进一步支持笔者以上推测。
需要注意纳入患者中伴原发性高血压比例不足20%,较以往报道更低,笔者认为这可能与研究中将隐匿性脑梗死排除有关;有学者研究证实[15],隐匿性脑梗死人群合并原发性高血压比例更高;与症状性脑梗死相比,隐匿性脑梗死患者多存在长时间脑部缺血缺氧状态,故机体对于此类损伤耐受性更佳,故发病后神经功能缺损程度反而更轻微,而这一现象可能对研究结果产生影响,故本次研究排除隐匿性脑梗死人群。
研究局限点:①纳入样本量较少、单中心及回顾性设计使得所得结论存在偏倚可能;②因患者数制约,未分析其他类型TIA 对继发脑梗死病变的影响;③TIA所具有保护效应具体分子机制仍未彻底阐明,仍需后续动物实验研究进一步证实。
综上所述,前循环脑梗死伴TIA 人群END 发生风险下降、总体预后优于未伴TIA 人群;而这一现象发生可能与TIA 能有效降低NF-κB 表达水平,抑制后续炎症反应有关。

