肉苁蓉水提物体外抗氧化及对小鼠肠道菌群紊乱的作用
何梦梦,游林,包晓玮,*,魏晨业,肖子轩,李泽霖,曾兰君,王慧君,赵玉婷
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052;2.和田帝辰医药生物科技有限公司,新疆和田848000)
肠道微生态由肠道菌群菌种、肠道菌群代谢物和黏膜屏障构成,可以通过肠道神经系统、神经内分泌系统及神经免疫系统调节等参与机体生理活动[1-2]。肠道是机体炎症发生的最初部位,在人体代谢过程中,自由基损伤是炎症病理损伤的重要组成部分,机体未能及时清除自由基使其在机体蓄积,最终在肠道组织内产生,过量的自由基导致肠道组织结构破坏,病原菌与有害物质与肠道上皮细胞充分接触引发炎症,引起肠道菌群紊乱等[3-4]。研究表明,肠道菌群的组成和数量与机体健康有一定联系。抗生素在合理的剂量下,能够有效抑制并杀灭病原体,在治疗疾病中发挥着重要作用[5]。近年来,抗生素的滥用导致植物源及动物源食品抗生素超标从而导致肠道菌群紊乱引发肠道黏膜系统受损导致内部环境紊乱,不利于微生物定植,增加肠道疾病的风险[6-7]。天然植物调节抗生素引起的肠道微生态失衡已成为研究热点[8]。
管花肉苁蓉[Cistanche tubulosa( Schrenk)Wight],别名大芸,主要寄生于柽柳属植物根部[9]。近年来,肉苁蓉以广泛的药理活性及保健功效在治疗疾病、保障健康中发挥着重要的作用,市场前景乐观[10]。国内外学者对肉苁蓉的化学成分及药理活性等进行深入的研究,药理活性的研究主要集中在激素调节、润肠通便、免疫调节、抗氧化及预防老年痴呆、神经保护、改善微循环、影响肠道菌群等药理作用[11-12]。目前,肉苁蓉调节肠道菌群紊乱的研究较少,本研究主要以还原力、DPPH自由基、ABTS+自由基、O2-自由基清除能力考察肉苁蓉水提物体外抗氧化能力。通过计算肠道菌群、肠道定植能力(B/E值),组织染色法观察结肠形态结构,结肠绒毛长度、隐窝深度、结肠绒毛高度/隐窝深度(V/C)综合考察肉苁蓉水提物对小鼠肠道菌群紊乱的影响,以期为肉苁蓉调节肠道菌群紊乱提供理论依据。
1 材料与方法
1.1 材料与试剂
管花肉苁蓉干片:和田帝辰医药生物科技有限公司;抗坏血酸(VC):国药集团化学试剂有限公司;羟甲基氨基甲烷(Tris):美国 Amresco公司;MRS培养基:杭州生物试剂有限公司;BBL培养基:杭州百思生物技术有限公司;Pfizer肠球菌选择性琼脂、伊红美蓝琼脂:青岛高科技工业园海博生物技术有限公司;SPF级雄性C57BL/6小鼠:新疆医科大学实验动物中心24只,体质量(20±2)g。
1.2 仪器与设备
AL204-4C电子天平:梅特勒-托利多仪器有限公司;XL-02A粉碎机:烨昌机械有限公司;HH-S数显恒温水浴锅、DHP-9052恒温培养箱:江苏省金坛市医疗仪器厂;TU-1810紫外可见分光光度计、JQ000453无菌操作台:苏净集团安泰公司;SX-500高压灭菌锅:日本TOMY公司;ECLIPS CI显微镜:尼康映像仪器销售(中国)有限公司
1.3 试验方法
1.3.1 肉苁蓉水提物的制备
参照葛继红等[13]提取方法,并稍作改动。由于水的张力较大,如用粒径小于40目的肉苁蓉颗粒提取,较难过滤,故将肉苁蓉干片粉碎,取粒径在20目~40目间的肉苁蓉颗粒,按料液比1∶10(g/mL),提取时间5 h,沸水浴条件下回流提取两次,过100目滤网,抽滤,过0.45 μm滤膜,浓缩成浸膏备用。
1.3.2 肉苁蓉水提物体外抗氧化作用
1.3.2.1 肉苁蓉水提物DPPH自由基清除率的测定
参照杨冰鑫等[14]方法,稍作改进。配置不同浓度的肉苁蓉水提物溶液,517 nm处测定吸光度,VC为阳性对照,计算其清除率。
清除率/%=[A0-(A1-A2)]/A0×100
式中:A0为蒸馏水加DPPH溶液的吸光度;A1为待测样加DPPH溶液的吸光度;A2为待测样加蒸馏水的吸光度。
1.3.2.2 肉苁蓉水提物还原能力的测定
参照Omage[15]方法,稍作改动。配置不同浓度的肉苁蓉水提物溶液取,700nm处测定吸光度,Vc为阳性对照。
1.3.2.3 肉苁蓉水提物ABTS+·清除试验
参照蒲成伟等[16]方法,稍作改动。配置不同浓度的肉苁蓉水提物溶液取,734 nm处测定吸光度,VC为阳性对照,计算其清除率。
清除率/%=(1-A1/A0)×100
式中:A1为4 mLABTS+溶液加1 mL样液的吸光度;A0为4 mL ABTS+溶液加1 mL蒸馏水的吸光度。
1.3.2.4 肉苁蓉水提物中O2-自由基清除率的测定
参照Luo等[17]方法,稍作改动。配置不同浓度的肉苁蓉水提物溶液,325 nm处测定吸光度,VC为阳性对照,计算其清除率。
清除率/%=[1-(A1-A2)/A3]×100
式中:A1为 4 mLTris-HCl加 20 μL 邻苯三酚和1 mL 样液的吸光度;A2为 4 mLTris-HCl加 20 μL 蒸馏水和1 mL样液的吸光度;A3为4 mLTris-HCl加20 μL邻苯三酚和1 mL蒸馏水的吸光度。
1.3.3 肉苁蓉水提物对肠道菌群紊乱的作用
1.3.3.1 动物分组与样品采集处理
参照史瑛等[18]方法,稍有改动。小鼠适应1周后随机分为4组,每组6只,分别为空白对照组、头孢克肟诱导肠道菌群紊乱模型组、肉苁蓉水提物低剂量组(1 mg/g)、高剂量组(2 mg/g)。肠道菌群紊乱模型组头孢克肟给药剂量为30 mg/kg为成人剂量的10倍每天,第1、3次灌服头孢克肟,第2次灌服生理盐水。肉苁蓉水提物低(高)剂量第1、3次灌服头孢克肟,第2次灌服低剂量肉苁蓉水提物。空白组每天灌服3次相同剂量生理盐水。
每隔 3 d~4 d 测定体重,灌胃第 0、7、14 天,在无菌操作台下用灭菌管采集老鼠粪便,放入-20℃冰箱保存,最后一天灌胃结束后,颈椎脱臼处死小鼠,取心脏、胸腺、脾、肝脏、肺、肾、脑称量脏器质量计算脏器系数。并留取结肠组织样本于在10%的福尔马林中。
脏器系数=小鼠脏器(g)/小鼠体重(g)
1.3.3.2 肠道菌群定量检测
参照王琳等[19]方法,稍作改动。按表1肠道菌群培养条件将粪便稀释后,在相应的浓度下接种于不同的选择型培养基中,采用活菌计数公式计数,结果以每克粪便湿重中菌落形成的对数值形式表示以计算菌落总数(lgCFU/g)。并计算B/E值。
每克粪便菌落数=lg(菌落总数×稀释倍数×每次稀释取样体积)/(接种体积×样品质量)
B/E值=双歧杆菌菌落总数/大肠杆菌菌落总数
1.3.3.3 小鼠结肠组织病理学观察
小鼠处死后,立即取出新鲜的结肠,用生理盐水冲去肠内容物,置于10%中性福尔马林中固定。按常规方法脱水、透明、石蜡包埋,连续横断切片,切片厚5 μm,HE染色。使用光学显微镜拍照观察并比较结肠黏膜形态变化,测量结肠绒毛长度、隐窝深度、计算绒毛长度/隐窝深度比值(V/C 值)[20]。

表1 肠道菌群培养条件Table 1 Culture conditions of intestinal flora
1.4 数据统计分析
2 结果与分析
2.1 肉苁蓉水提物体外抗氧化作用
ABTS+自由基、DPPH自由基、O2-自由基清除率及还原力是体外抗氧化能力的检测指标,ABTS+自由基、DPPH自由基清除率的原理是通过提供H原子或质子清除自由基[21]。O2-自由基清除率是通过结合O2-自由基,阻止H2O2、单重态氧等的形成。还原力则是通过破坏自由基链,给出H原子并发挥抗氧化作用[22]。图1为肉苁蓉水提物的体外抗氧化作用。
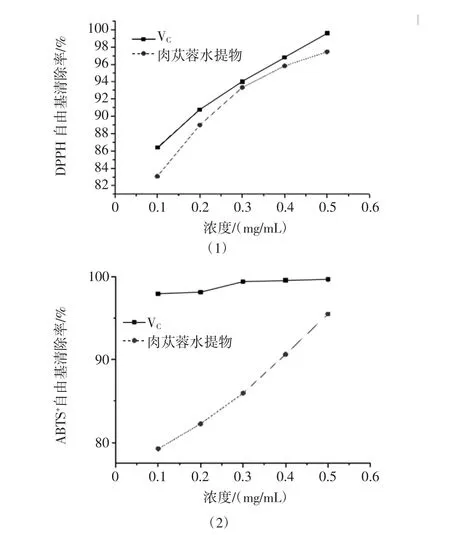

图1 肉苁蓉水提物体外抗氧化作用Fig.1 Antioxidant effect of Cistanche deserticola in vitro
由图1(1)可知肉苁蓉水提物DPPH自由基清除率随浓度的增大而增加,0.3 mg/mL时肉苁蓉水提物DPPH自由基清除率最接近同浓度VC,0.3 mg/mL后肉苁蓉水提物DPPH自由基清除率增加速率减小。
图1(2)可知肉苁蓉水提物对ABTS+自由基具有一定清除率,且与其浓度呈正相关,0.5 mg/mL时肉苁蓉水提物ABTS+自由基清除率最高为95.49%。VC的ABTS+自由基清除率始终维持在97%左右。
图1(3)可知肉苁蓉水提物超氧阴离子自由基清除率明显低于VC,0.3 mg/mL后超氧阴离子自由基清除率增长缓慢,0.5 mg/mL时肉苁蓉水提物超氧阴离子自由基清除率最高为32.69%。
图1(4)可知肉苁蓉水提物及VC的还原力均具有浓度依赖性,同浓度VC还原力与肉苁蓉水提物相比增加速率较大。结果表明,肉苁蓉水提物具有良好的体外抗氧化作用,其DPPH自由基、ABTS+自由基、O2-自由基的 IC50值依次为 0.225、1.819、12.53 mg/mL。肉苁蓉水提物具有良好的抗氧化能力可能由于其主要活性成分苯乙醇苷类化合物的苯环上具有多对邻酚羟基,这是使化合物具有清除自由基活性的关键结构[23]。
2.2 肉苁蓉水提物对肠道菌群紊乱小鼠的影响
2.2.1 肉苁蓉水提物对肠道菌群紊乱小鼠体质量的影响
小鼠体质量会随机体生理变化发生改变,4组小鼠在不同灌胃天数下的体重变化情况见表2。
由表2可知,灌胃第3天每组小鼠体重出现明显降低,后缓慢升高,可能由于开始灌胃后引起小鼠应激反应使得体重下降。第9天前每组小鼠体重变化与空白组无显著性差异,第9天时与空白组相比其他3组体重有显著性差异(P<0.05),第12天时模型组与空白组相比体重降低(P<0.01),肉苁蓉低剂量组与空白组体重降低(P<0.05),肉苁蓉高剂量组体重变化与空白组相近(P>0.05),第14天时模型组与空白组有显著性差异,肉苁蓉水提物低剂量与高剂量组无显著性差异,结果表明肉苁蓉水提物在一定浓度下能够控制由抗生素导致的体质量下降。

表2 小鼠体质量变化Table 2 Changes in body weight of mice g
2.2.2 肉苁蓉水提物对肠道菌群紊乱小鼠脏器指数的影响
脏器指数能间接反映营养物质在机体中的有效沉积、吸收和利用[24]。4组小鼠脏器指数变化见表3。
由表3可知,4组小鼠心脏、脾、肝脏、肺、肾、脑指数差异不显著(P>0.05),而与空白组相比,模型组、肉苁蓉低剂量组和高剂量组胸腺指数存在显著性差异(P<0.05),其中肉苁蓉水提物低剂量组胸腺脏器指数与空白组存在极显著差异(P<0.01),模型组与空白组相比胸腺指数显著降低,表明长期灌服头孢克肟对小鼠胸腺的生长发育可能具有抑制作用,引起免疫抑制。与模型组相比肉苁蓉水提物高剂量胸腺指数显著提高(P<0.05),肉苁蓉水提物低剂量组小鼠胸腺指数降低(P<0.05)。胸腺作为中枢免疫器官一定程度上反应了机体的免疫功能,可能由于肉苁蓉水提物中的肉苁蓉多糖促进机体中免疫系统产生的IL-2,促进免疫细胞增殖,促进胸腺成熟细胞的释放,缓解应激功能,使免疫功能趋于稳定,减轻抗生素引起对小鼠免疫器官的生长抑制[25]。
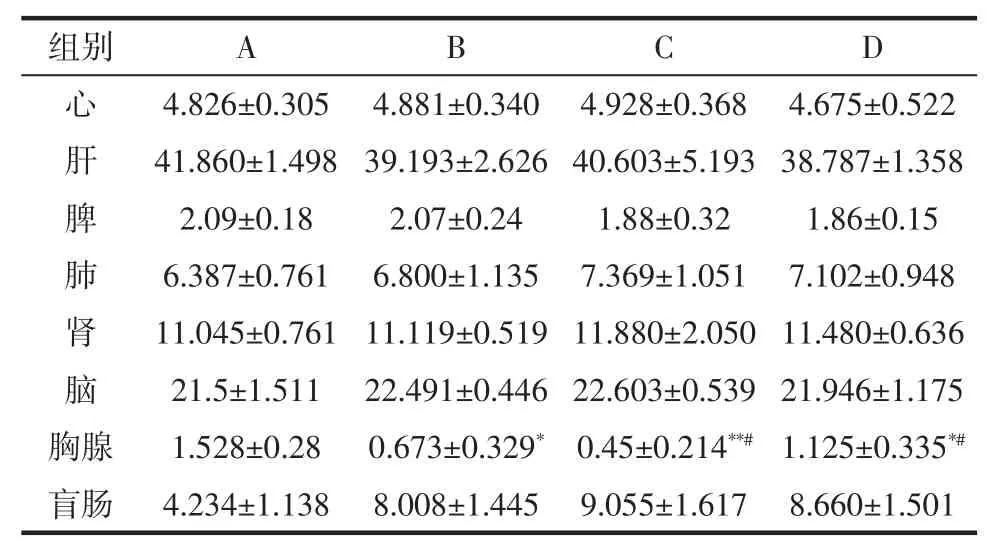
表3 肉苁蓉水提物对肠道菌群紊乱小鼠脏器指数的影响Table 3 Effect of Cistanche deserticola water extract on organ index of mice with intestinal flora disorder mg/g
2.2.3 肉苁蓉水提物对肠道紊乱小鼠肠道菌群的影响
按对机体健康的影响,肠道菌群可分为:益生菌、有害菌和调节致病菌,共同调节肠道微生态平衡。双歧杆菌、乳酸菌作为肠道中典型的益生菌,能够改善肠道功能,刺激机体免疫功能,促进抗炎因子的分泌,缓解炎症反应等。条件致病菌在菌群平衡时不致病,但一旦处于生态失调的状态下,这类细菌可成为致病菌,如大肠杆菌、肠球菌[26]。肠道菌群特定微生物比例失调会影响肠道菌群平衡,B/E值(双歧杆菌/大肠杆菌)可反映肠道内正常菌群对致病菌群定植的抵抗力,肠道环境良好时B/E值≥1[27]。图2为肉苁蓉水提物对肠道紊乱小鼠肠道菌群数量变化情况。

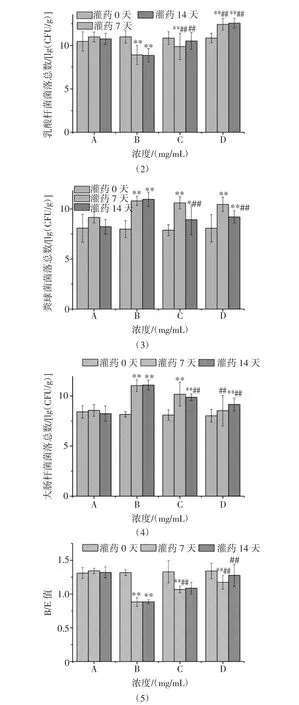
图2 肉苁蓉水提物对肠道紊乱小鼠肠道菌群的影响Fig.2 Effect of Cistanche deserticola water extract on intestinal flora in mice with intestinal disorders
图2(1)可看出灌胃7 d时,与空白组相比模型组小鼠粪便中双岐杆菌含量降低(P<0.01),肉苁蓉水提物低剂量组及高剂量组与空白及模型组相比双岐杆菌数量升高(P<0.01),14 d时模型组及低剂量组与空白组相比双岐杆菌显著降低(P<0.01),高剂量组与模型组相比升高(P<0.01)。图 2(2)可知,灌胃 7 d 时,模型组及低剂量与空白组相比组小鼠乳酸菌数量降低(P<0.01),高剂量组乳酸菌含量升高(P<0.01)。14 d时低剂量组及高剂量组与模型组相比乳酸菌含量升高(P<0.01)。图2(3)可知,灌胃7 d时模型组、低剂量组、高剂量组肠球菌与对照组比显著升高(P<0.01)14 d后低剂量组、高剂量组肠球菌与模型组比显著降低(P<0.01)。图 2(4)可知,灌胃 7 d 时模型组、低剂量组、高剂量组大肠杆菌菌与对照组比显著升高(P<0.01)14 d后低剂量组、高剂量组大肠菌与模型组比显著降低(P<0.01)。图2(5)可知,灌胃7 d时模型组、低剂量组、高剂量组B/E值与对照组比显著降低(P<0.01),且模型组B/E值<1,低剂量组、高剂量组B/E值>1,表明低剂量组、高剂量组肠道环境比模型组好。14 d后组模型组B/E值显著低于对照组(P<0.01),高浓度组与对照组B/E值差异不显著(P>0.05)。试验表明肉苁蓉能显著提高肠道菌群紊乱小鼠粪便中双岐杆菌、乳酸菌含量B/E值,对肠球菌及大肠杆菌生长有一定抑制作用。肉苁蓉对肠道菌群紊乱的调节作用,可能由于其在机体内参与糖代谢从而维持机体内代谢稳态,改善机体内环境,从而降低抗生素对肠道菌群紊乱的影响[28]。
2.2.4 肉苁蓉水提物对小鼠肠道菌群紊乱结肠形态结构的影响
肠道形态结构的改变对机体生长发育、消化吸收、免疫调节、肠道损伤修复具有一定影响。肠绒毛能够增大肠道黏膜表面积以及与营养物质的接触面积,增强肠道的消化吸收功能。隐窝细胞向绒毛顶端迁移分化后形成绒毛细胞,补充绒毛上皮细胞脱落。绒腺比(V/C值)能综合反映肠道消化状况,与肠道消化吸收能力成正比。肠绒毛、隐窝、V/C值代表肠道黏膜完整性的重要指标[29]。肉苁蓉水提物对小鼠肠道菌群紊乱结肠形态结构的影响见图3和表4。
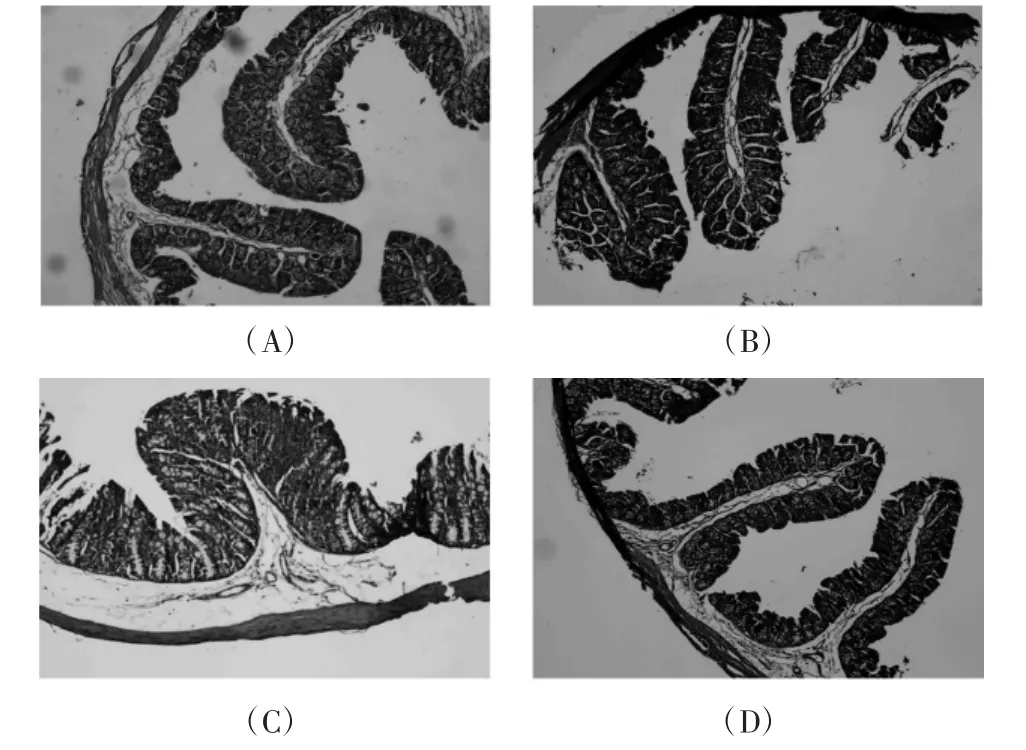
图3 肉苁蓉水提物对肠道菌群紊乱结肠结构的影响Fig.3 The effect of Cistanche deserticola water extract on the colonic structure of intestinal flora disorder
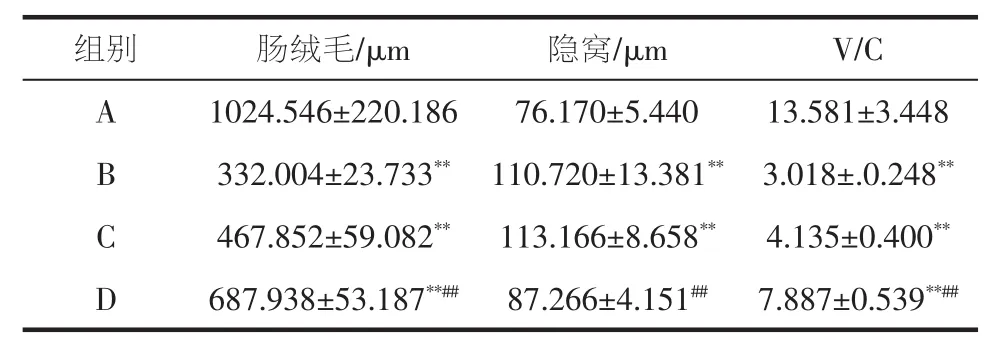
表4 肉苁蓉水提物对肠道菌群紊乱结肠结构的影响Table 4 The effect of Cistanche deserticola water extract on the colonic structure of intestinal flora disorder
由图3和表4可知,不同试验组结肠绒毛形态有一定的差异。对照组及肉苁蓉水提物高剂量组结肠绒毛较长,呈指状,肠道菌群紊乱模型组及肉苁蓉水提物低剂量组肠绒毛较短,模型组肠绒毛顶端断裂。肉苁蓉水提物高剂量组能够极显著提高肠道菌群紊乱小鼠结肠绒毛高度及V/C值(P<0.01)。与对照组相比其他3组肠绒毛及V/C值减小存在极显著性差异(P<0.01),模型组与低剂量组与对照组相比隐窝变深存在极显著差异(P<0.01),高剂量组与空白组隐窝深度无显著性差异(P>0.05),隐窝深度增加会降低营养物质吸收。绒毛长度大小顺序为:对照组>高剂量组>低剂量组>模型组;隐窝深度大小依次为:模型组>低剂量组>高剂量组>对照组;V/C值大小为:对照组>高剂量组>低剂量组>模型组,故肉苁蓉水提物可调节肠道菌群紊乱小鼠诱发的肠绒毛变短、隐窝深度增加的现象。这可能由于抗生素诱导肠道菌群紊乱,而使肠黏膜屏障促炎症信号上调,诱发炎症细胞传导,引发肠道炎症疾病,影响机体代谢。肉苁蓉水提物通过提高抗炎因子的释放,降低促炎因子的分泌减缓肠道粘膜的炎性损伤,进而调节肠道菌群紊乱引发的肠道形态结构的改变[28]。
3 结论
肉苁蓉水提物具有良好的抗氧化作用,DPPH自由基、ABTS+自由基、O2-自由基的IC50值依次为0.225、1.819、12.53 mg/mL。肉苁蓉水提物在一定浓度下能够缓解抗生素对小鼠体质量下降及对胸腺的生长抑制,能显著提高肠道菌群紊乱小鼠粪便中双岐杆菌、乳酸菌的数量,对肠球菌及大肠杆菌生长有一定抑制作用,调节肠道内正常菌群对致病菌群定植的抵抗力。改善肠道菌群紊乱小鼠诱发的肠绒毛变短、隐窝深度增加现象。由此看出,肉苁蓉水提物具有一定的抗氧化能力及调节肠道菌群紊乱的作用,为肉苁蓉开发产品及其应用提供一定理论依据。