miR-145介导TGF-β/Smad信号通路对乳腺癌患者治疗及预后的影响
杨 斌 汪嫣嫣 甘家兵
乳腺癌在女性中具有较高的发病率以及病死率[1],发病机制与遗传、环境、病毒等因素有关[2],主要通过根治术进行治疗[3],但由于肿瘤的转移能力,此病极易复发[4]。miRNA是非编码小分子RNA中的一员,具有高度的保守性、特异性以及差异性,对细胞的生长增殖凋亡具有一定的调控作用[5-6]。而TGF-β/Smad信号通路对于肿瘤的发生进展也有一定的调节作用[7]。本研究通过检测miR-145以及TGF-β/Smad信号通路中的相关蛋白,并探讨其对乳腺癌治疗及预后的影响。
1 材料与方法
1.1 一般资料
将我院2016年6月至2019年10月治疗的114例乳腺癌患者纳入研究,患者平均年龄在(49.29±6.16)岁。TNM分期:Ⅰ期患者35例,Ⅱ~Ⅲ期49例,Ⅳ期30例。导管癌有51例,小叶癌有31例,湿疹样癌有32例。各分期患者年龄、性别等基本资料之间没有统计学差异(P>0.05)。纳入标准:①病理学检查确定其为乳腺癌;②符合WHO乳腺癌分类标准;③无肿瘤病史者;④获得患者及其亲属的认同。排除标准:①严重脏器功能不全患者;②有其他恶性肿瘤并发患者;③已治疗患者;④无完整临床资料者。本研究经我院的伦理委员会审核通过。所有患者均行乳腺癌根治术治疗,手术中留取癌组织,手术后根据患者治疗情况适当进行放化疗。
1.2 RT-PCR检测miR-145的表达
检测手术中留存的癌组织以及癌旁组织标本,依照试剂盒(北京原平皓生物,HF104-01)说明书通过Trizol的方法对总RNA进行提取、定量,依循逆转录试剂盒(Qiagen,205111)步骤合成cDNA,后依RT-PCR试剂盒(Transcriptor cDNA Synth.Kit 2,上海臻诺生物科技)指导检测miR-145的表达,以U6为内参,最后通过2-△△Ct公式获得结果。
1.3 Western blot检测TGF-β/Smad信号通路相关蛋白的表达
消化、离心获得的能够稳定表达miR-145的癌组织,SDS-PAGE电泳获得相关蛋白,冷冻保存,加入PBST稀释的一抗,泡入PVDF膜后于4 ℃条件下孵育12 h,转膜后加入二抗,室温下孵育2 h,洗脱,显色,成像,Image J软件分析,从而获得相关蛋白的表达情况。
1.4 随访
对患者按照前两年三个月一次,后一年六个月一次的时间段进行随访,方式分为电话、门诊等,对患者的术后症状、治疗、生存情况等进行记录,随访结束点为日期截止或患者失访、死亡。
1.5 统计学方法
2 结果
2.1 miR-145的表达情况
对患者miR-145的表达进行检测,癌旁组织、Ⅰ期乳腺癌组织、Ⅱ~Ⅲ期乳腺癌组织及Ⅳ期乳腺癌组织的相对表达量分别为(5.28±1.03)、(4.91±0.71)、(4.02±0.65)及(3.19±0.33),差异具有统计学意义(F=16.273,P<0.05)。与癌旁组织相比,治疗前Ⅰ期、Ⅱ~Ⅲ期以及Ⅳ期乳腺癌组织中miR-145的表达降低,并且其表达水平随着TNM分期的上升而有所下降(P<0.05)。
2.2 TGF-β/Smad信号通路相关蛋白的表达
将治疗前后各组织中的相关蛋白进行对比,与癌旁组织相比,Ⅰ期、Ⅱ~Ⅲ期以及Ⅳ期乳腺癌组织中TGF-β1、Smad3、Gli2以及Vimentin的表达均有所上升(P<0.05),且随着TNM分期的上升而上升(P<0.05)。结果见图1、表1。
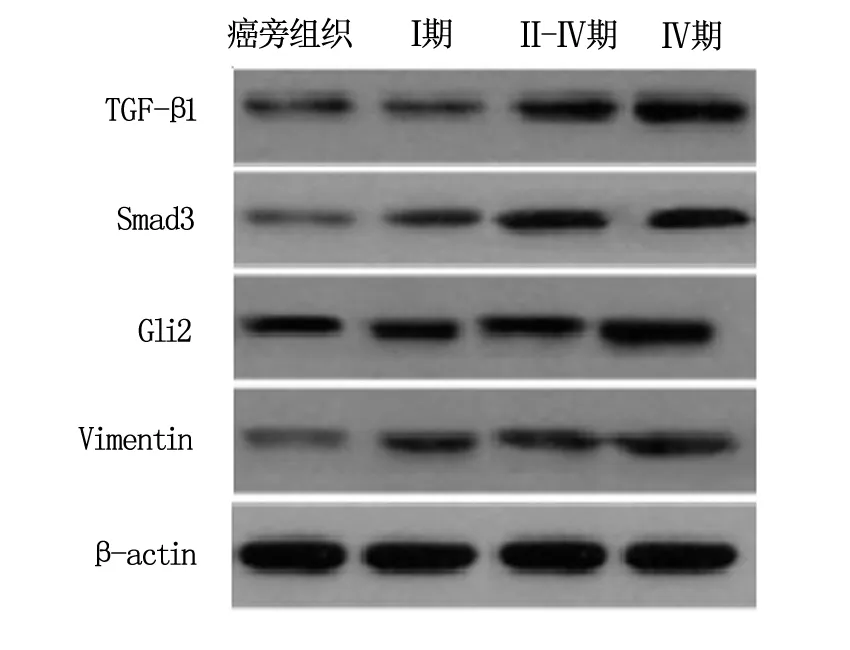
图1 TGF-β/Smad信号通路相关蛋白的表达
2.3 miR-145与TGF-β/Smad信号通路的关系
将miR-145与TGF-β/Smad信号通路的相关蛋白行相关性分析,miR-145与TGF-β1、Smad3、Gli2、Vimentin呈负相关(P<0.05)。结果见表2。
2.4 miR-145的水平与乳腺癌患者临床病理特征的关系
如表3所示,miR-145的水平与淋巴结转移、TNM分期以及增殖指数有关(P<0.05),而与年龄、绝经、病理类型、肿瘤大小、ER、PR以及HER-2无关(P>0.05)。
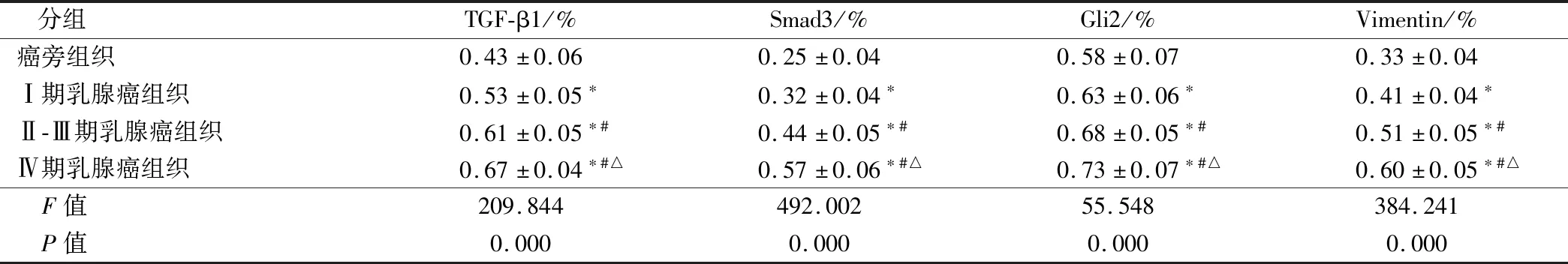
表1 TGF-β/Smad信号通路相关蛋白的表达

表2 miR-145与TGF-β/Smad信号通路的关系
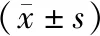
表3 miR-145的水平与乳腺癌患者临床病理特征的关系
2.5 乳腺癌患者生存影响因素的COX回归分析
如表4所示,通过回归分析,得出淋巴结转移、TNM分期、miR-145、TGF-β1、Smad3、Gli2以及Vimentin是乳腺癌患者生存的独立危险因素。
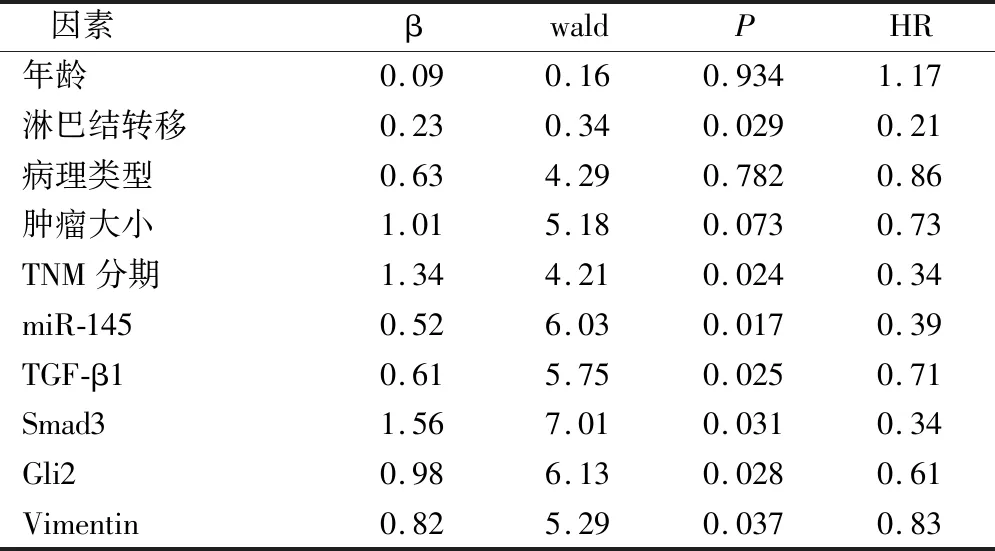
表4 乳腺癌的生存因素分析
2.6 miR-145及TGF-β/Smad信号通路相关蛋白与预后的关系
以乳腺癌患者miR-145、TGF-β1、Smad3中位数为界分为miR-145高表达、miR-145低表达与TGF-β1高表达、TGF-β1低表达及Smad3高表达、Smad3低表达。Kaplan-Meier法行生存率分析发现,miR-145高表达组的总生存率要高于低表达组的生存率(P<0.05),TGF-β1、Smad3低表达的总生存率比高表达组的生存率高(P<0.05)。见图2。
3 讨论
作为女性中常见的恶性肿瘤,乳腺癌发病率逐步上升[8],原位乳腺癌虽不致命,但随着乳腺癌细胞在重要器官中的转移,会对患者的正常组织有所破坏,从而威胁患者生命[9-10]。临床上多使用根治性手术联合化学治疗[11],但由于其复发以及转移,此疾病通常具有不良的预后效果[12],因而对其相关机制以及影响因素进行探讨至关重要。
有研究显示,乳腺癌与遗传、病毒等因素有关[13],因而越来越多的研究者对miRNA在肿瘤中的作用进行研究。miRNA是1种极小的非编码RNA,极度保守、特异[14],可以通过对靶mRNA的转录后翻译过程进行降解和抑制,来对有关基因的表达进行调控,发挥有关生物学功能,参与机体的病理生理过程[15]。余杰等[16]对已有一定了解的miR-31-5p进行研究,探究其在乳腺癌细胞中的有关机制,他们通过对该细胞的培养、转染,检测其中miR-31-5p的表达,检测细胞的增殖、凋亡以及相关蛋白的表达情况,最终得出miR-31-5p可调控乳腺癌的放化疗情况,其过表达对乳腺癌的放化疗具有促进作用;又如任晖等[17]通过检测miR-124的表达,细胞侵袭、增殖的情况以及双荧光素酶鉴定miR-124与SP1的关系,了解到miR-124的过表达可通过调控SP1来抑制乳腺癌的进展。除此之外,miR-367、miR-130a-3p、miR-221等对乳腺癌也均有一定的调控作用。

图2 乳腺癌患者的生存率比较
本研究对我院2016年6月至2019年10月治疗的114例乳腺癌患者进行研究,对所有患者手术化疗治疗前后的癌组织、癌旁组织标本进行检测。miR-145处于染色体9q31上,对于肿瘤进展具有抑制作用[18],RT-PCR检测miR-145的表达发现,治疗前Ⅰ期、Ⅱ~Ⅲ期以及Ⅳ期乳腺癌组织中miR-145的表达与癌旁组织相比均降低,并且随着TNM分期的上升其表达水平有所下降(P<0.05),这一结果提示乳腺癌中miR-145呈现低表达的趋势,miR-145的水平可能预示着乳腺癌患者的病情程度。有研究表明,TGF-β/Smad信号通路与机体的生长发育、人体肿瘤的发生进展具有息息相关的作用,TGF-β1是人体内TGF-β的主要存在形式,对于Smad以及癌基因突变具有一定的诱导作用,从而促进肿瘤细胞的侵袭迁移[19]。进而经WB检测TGF-β/Smad信号通路相关蛋白的表达后发现,Ⅰ期、Ⅱ~Ⅲ期以及Ⅳ期乳腺癌组织中TGF-β1、Smad3、Gli2以及Vimentin的表达与癌旁组织相比均有所上升(P<0.05),且随着TNM分期的上升而上升,提示着TGF-β/Smad通路对乳腺癌的增殖具有一定的促进诱导作用。相关性分析发现,miR-145与TGF-β1、Smad3、Gli2、Vimentin呈负相关(P<0.05),提示miR-145可能下调TGF-β/Smad信号通路。而将miR-145的水平与乳腺癌患者临床病理特征施以相关性分析发现,miR-145的水平与淋巴结转移、TNM分期以及增值指数有关(P<0.05)。进一步使用COX回归分析以及Kaplan-Meier法行生存率分析得出,淋巴结转移、TNM分期、miR-145、TGF-β1、Smad3、Gli2以及Vimentin是乳腺癌患者生存的独立危险因素。miR-145高表达组的总生存率要比低表达组的生存率高(P<0.05),TGF-β1、Smad3低表达的总生存率要比高表达组的生存率高(P<0.05)。表明高表达的miR-145及低表达的TGF-β1、Smad3对患者具有较好的预后效果。
综上,miR-145在乳腺癌患者中呈低表达,TGF-β/Smad信号通路则呈高表达。临床可能通过下调TGF-β/Smad信号通路使患者预后效果达到较佳。

