新辅助化疗对乳腺癌ER PR HER-2及Ki-67表达影响的研究进展
何洋 赵伟鹏 综述 佟仲生 审校
随着癌症的发病率和死亡率增加,乳腺癌已占女性恶性肿瘤发病率第一位[1],其发病、转归及预后常与生物标志物密切相关。雌激素受体(estrogen re⁃ceptor,ER)、孕激素受体(progesterone receptor,PR)广泛存于乳腺上皮细胞内,对乳腺细胞的增殖分化起关键作用。临床上激素依赖型乳腺癌约占75%[2],而人表皮生长因子受体-2(human epidermal growth fac⁃tor receptor-2,HER-2)阳性乳腺癌侵袭性强,易早期复发转移,Ki-67指数越高生存率越差。因此国内外指南均将ER、PR、HER-2、Ki-67作为重要预后指标。
乳腺癌新辅助化疗(neoadjuvant chemotherapy,NAC)不仅可降低临床分期,使不能手术的患者转为可手术,还显著改善HER-2 阳性和三阴性乳腺癌(triple negative breast cancer,TNBC)的预后[3]。但在NAC前后,却存在ER、PR、HER-2、Ki-67表达不一致现象,并且在晚期乳腺癌原发病灶与转移病灶之间也有同样现象,33%患者出现激素受体(hormone re⁃ceptor,HR)的改变,15%患者出现HER-2 状态的改变[4]。因此,美国病理学协会(college of American pa⁃thologists,CAP)建议对乳腺癌复发转移部位重新进行检测,但在NAC 阶段尚未提出类似建议。由于NAC后生物标志物的差异变化对后续治疗及生存可能产生深远影响,本文将就NAC 对乳腺癌ER、PR、HER-2及Ki-67表达影响的研究进展进行综述。
1 NAC前后ER、PR、HER-2表达变化的机制
1.1 NAC导致ER、PR变化机制
近年来,空芯针穿刺活检(core needle biopsy,CNB)和乳腺肿物切除活检(excisional biopsy,EB)已成为主要的诊断方式。研究发现,NAC后HR表达的变化,可能是因CNB和EB检测存在差异。Dekker等[5]研究提示,在CNB和EB中,ER、HER-2状态具有高度一致性,但PR却存在15%不一致率,尤其在ER阴性肿瘤中PR较少表达,因此对CNB检测的PR状态应慎重对待。Li等[6]采用Mate分析显示,使用CNB和EB检测ER、PR具有一致性。目前CNB和EB检测具有较高的符合率,而造成HR状态差异的主要原因,可能是CNB取材不全导致无法完全确定肿瘤性质,以及免疫组织化学法的检测技术等问题[7]。
除了检测技术导致假阳性或假阴性外,NAC后HR状态可能存在机制上的变化。肿瘤细胞在治疗过程中存在对化疗敏感性的不同,因HR阴性细胞对化疗更敏感,但在化疗后HR阳性细胞可继续存留[8]。另外,化疗可能抑制绝经前女性卵巢功能,使体内循环激素水平降低,导致肿瘤ER和(或)PR下调引起激素非依赖性生长[9]。以上研究被认为是NAC后HR状态由阳性转为阴性的最主要原因。而HR由阴性转为阳性,可能是由于细胞最初来源于分化良好的HR阳性乳腺癌细胞,在化疗影响下回到原始状态。Nie等[10]通过CDK2或EZH2抑制剂将TNBC转化为Luminal型乳腺癌,使ERα再表达,从而可进行内分泌治疗。其他观点如化疗可上调肿瘤细胞核中一些有利于HR表达或再表达的蛋白,最终导致HR改变[11]。
1.2 NAC导致HER-2表达变化机制
15%~20%乳腺癌患者存在HER-2 扩增或过表达[12],国内、外指南对于HER-2检测均推荐采用免疫组织化学法(immunohistochemistry,IHC)和荧光原位杂交(fluorescencein situhybridization,FISH)技术。虽然采用IHC和FISH的结果一致性较高,但FISH比IHC更易出现重复[13]。
NAC前、后的不同治疗方案(单独化疗、抗HER-2治疗+化疗)对HER-2 缺失率的影响研究甚少,结果也不同。Guarneri 等[14]研究显示,单独化疗组导致HER-2 缺失率远高于抗HER-2 治疗+化疗组,联合抗HER-2治疗可显著降低HER-2的丢失率。Niiku⁃ra 等[15]研究发现,NAC 前后HER-2 状态不一致性仅与化疗相关,与是否行曲妥珠单抗治疗无关。而Ig⁃natov等[16]研究提示,NAC前后HER-2状态不一致性仅与抗HER-2 治疗有关,而且在曲妥珠单抗基础上增加帕妥珠单抗,HER-2 缺失率可由47.3%增至63.2%。对前瞻性研究数据库进行回顾性研究显示,紫杉醇+卡铂+曲妥珠单抗(PCH)组的HER-2丢失较紫杉醇+卡铂(PC)组更为常见[17],与日本癌症登记处真实世界数据基本一致[18]。一项HER-2阳性胃癌研究发现,以曲妥珠单抗为基础治疗后,约1/3 患者可发生HER-2缺失[19]。因此单独化疗、化疗+靶向治疗均对HER-2状态产生影响,而且HER-2状态的丢失率增加与抗HER-2 治疗呈正相关。还有研究显示,HER-2状态丢失亦与HR相关,HR阳性比HR阴性更易丢失HER-2[20]。HER-2出现缺失的原因可能与真实的生物学变化、治疗引起的克隆选择、数据分析前后的误差、取样局限性以及肿瘤异质性相关。
2 NAC前后ER、PR、HER-2表达变化的情况
多项研究指出NAC 后HR 可发生变化,ER 的改变率为1.7%~31%,PR的改变率为3.5%~35.2%,PR相较于ER 更易发生这种变化。日本一项大型回顾性研究显示[18],NAC后4.6%患者ER状态由阳性转为阴性,9.3%患者ER 由阴性转为阳性,18.7%患者PR由阳性转为阴性,9.3%患者PR由阴性转为阳性。临床研究与真实世界数据结论基本一致。HER-2作为一个有效的预后因子,NAC 后HER-2 状态由阳性转为阴性发生率为1.6%~40%,更罕见的是由阴性转为阳性为2.2%~3.4%。一项Meta 分析结果显示,NAC可显著改变ER、PR状态,但HER-2状态相对更加稳定[21]。这可能因临床上病理科首选IHC 作为检测手段,当HER-2 状态不确定才使用FISH,而FISH检测HER-2状态稳定性更高。见表1。

表1 新辅助化疗后ER、PR、HER-2变化研究
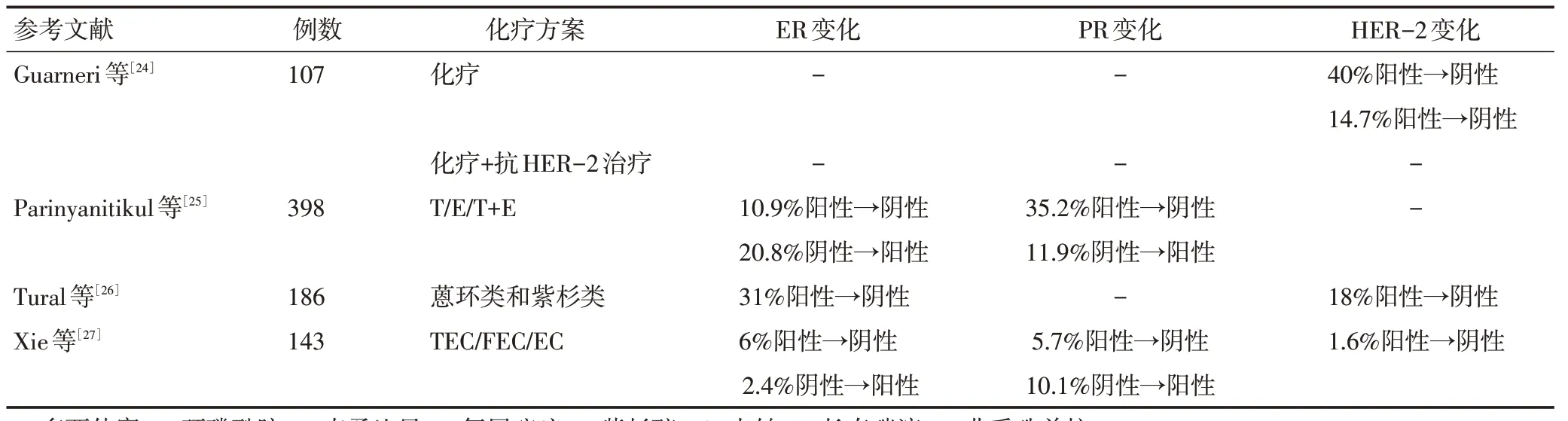
表1 新辅助化疗后ER、PR、HER-2变化研究(续表1)
3 NAC后对ER、PR、HER-2表达变化的影响
3.1 NAC后ER、PR表达对预后的影响
NAC 后HR 状态改变对预后影响不明。Li 等[28]进行荟萃分析显示,与始终HR阳性患者相比,HR阳性转为阴性患者的无病生存期(disease free survival,DFS)和总生存期(overall survival,OS)更短,HR 阴性转为阳性患者较始终阴性患者获得更长DFS 和OS。研究显示[22],任何HR状态改变而导致的预后均较稳定的HR状态差,与Yang等[23]报道结果一致。
乳腺癌内分泌辅助治疗已成为HR 阳性患者的标准治疗,NAC后HR状态改变患者是否行内分泌治疗尚存在争议。Wu 等[29]研究发现,NAC 后HR 由阳性变为阴性患者虽仍可从内分泌治疗中获益,但无显著性差异。Hirata 等[30]研究发现,根据NAC 后HR状态改变,内分泌治疗组的DFS 和OS 均优于未行内分泌治疗组,HR 状态改变似乎并不影响长期预后。因此,对于复发风险为中、高危型乳腺癌患者,NAC前后只要有一次HR阳性者建议行内分泌治疗,相对低危且HR表达偏低患者可考虑豁免内分泌治疗。
3.2 NAC后HER-2表达对预后的影响
抗HER-2 治疗已成为NAC 中重要环节,不仅可增加乳腺癌HER-2 阳性患者的病理完全缓解率,还可改善生存。目前,HER-2 状态改变的预后价值尚不清楚。Yoshida 等[20]回顾性分析发现,HER-2 状态的改变不影响患者的预后。在对数据库中的前瞻性研究进行分析显示,与HER-2状态稳定的患者相比,HER-2缺失的患者存在更高的复发风险[24]。
4 NAC对Ki-67表达的影响
Ki-67是一种细胞核蛋白,参与聚合酶Ⅰ-依赖性核糖体RNA合成的早期步骤。在细胞周期G1、S、G2和M期中均表达,而在G0期不表达,主要用于评估肿瘤增殖能力,是一个重要的预测指标[31]。目前,在乳腺癌中Ki-67表达的最佳预后阈值尚有争议,2011年乳腺癌St.Gallen共识最初将14%作为区分Luminal A型和Luminal B型的阈值,2013年更改为20%,2015年St.Gallen共识将20%~29%作为阈值。Petrelli等[32]研究发现,在乳腺癌患者中Ki-67是OS独立预后因子,Ki-67高表达时,死亡风险会增加。有研究表明,NAC后Ki-67表达会显著下降,而残留肿瘤中Ki-67 高表达的DFS、OS 均较差[33]。因此,乳腺癌患者行NAC后,Ki-67表达下降预示较好的预后。
5 结语
乳腺癌治疗已日臻完善,随着新药的不断涌现,乳腺癌的新辅助治疗更成为业界关注的焦点之一,但仍存在不足之处。在NAC 前后,建议均行免疫组织化学法检测,以便根据肿瘤生物标志物进行风险预测和精准治疗。同时,值得注意的是NAC 后HR、Ki-67状态会有明显变化,但HER-2状态相对比较稳定。目前,根据NAC 前还是NAC 后结果进行下一步治疗,还缺乏足够的数据支持,中国抗癌协会乳腺癌诊治指南建议,无论NAC 前后,只要出现一次ER、PR、HER-2阳性,就应给予相对应的内分泌治疗或抗HER-2靶向治疗。由于生物标志物变化影响到乳腺癌后续治疗,可结合患者情况权衡利弊,以达到最佳疗效。将来也期待进行多中心前瞻性研究。

