一株黄金鲫鱼源蜡状芽孢杆菌的筛选、鉴定及耐性研究
吴振超,陈玉珂,高永生,王森,雷新雨, 于梦楠,张宇柔,张东鸣、3*
(1.吉林农业大学 生命科学学院, 吉林 长春 130118;2.吉林农业大学 动物科学技术学院,动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料科学重点研究室,吉林 长春 130118; 3.通化师范学院,吉林 通化 134000)
近年来,随着水产养殖业集约化规模的不断扩大,鱼类疾病的发生也日趋严重,在养殖过程中鱼类受小瓜虫病、舌形绦虫病、鱼鳔积水症、内脏类结节病、细菌性败血病等多种疾病的困扰,一定程度上阻碍了水产养殖业的发展。在疾病防治过程中,抗生素的使用起到了良好的效果,然而其大量使用的同时也给养殖环境和水产动物肠道中有益微生物菌群的正常生长繁殖带来了一定的负面影响。抗生素在环境和水产品中的残留危害了人类的健康,也阻碍了水产品进出口贸易的数量[1]。目前,许多国家已经明令禁止和限制抗生素的使用[2-3],“无抗”养殖的大力推广使抗生素的替代研究越来越受到学者们的重视。随着对微生物学研究的深入,研究人员发现,益生菌具有促进营养物质消化吸收[4]、增强动物免疫力和调节动物体内微生态平衡等优点,其作为抗生素的替代品在养殖领域取得了良好效果[5],已成为水产饲料中最有潜力的抗生素替代品。同时,益生菌制剂具有无毒副作用、无耐药性和效果显著等特点,使得用益生菌替代抗生素成为一个切实可行的途径[6]。
目前,在中国作为饲料添加剂的益生菌中芽孢杆菌类主要有地衣芽孢杆菌Bacilluslicheniformis、凝结芽孢杆菌Bacilluscoagulans、蜡状芽孢杆菌Bacilluscereus和枯草芽孢杆菌Bacillussubtilis等[7],其主要来自畜禽的肠道或其生长环境中。然而益生菌在宿主肠道的黏附作用具有特异性,因此,非同源的益生菌在养殖生产中的应用效果并不理想[8]。所以种属特异性是筛选益生菌的首要条件,而从水产动物肠道中分离筛选益生菌成为大多数水产益生菌的主要筛选方法。本研究中,通过筛选一种安全有效的黄金鲫Carassiusauratus鱼源益生芽孢杆菌,以期为黄金鲫鱼源益生菌蜡状芽孢杆菌的益生特性分析和安全使用提供参考,也为黄金鲫益生菌制剂的研发与应用提供科学依据。
1 材料与方法
1.1 材料
供试菌株为黄金鲫肠道中分离的一株潜在益生菌。指示菌株为2018年5月从黄金鲫肠道分离的4株指示菌,分别是蜡状芽孢杆菌BacilluscereusHJJ2-5、嗜水气单胞菌AeromonashydrophilaHJJ2-7、金黄色葡萄球菌StaphylococcusaureusHJJ2-8和大肠杆菌EscherichiacoliHJJ3-1,均由吉林农业大学水产实验室保存。
供试黄金鲫于2018年6月采自吉林省梅河口市共安水产良种场。选择活泼、无外伤、体形正常的健康黄金鲫(体质量13.0 g±1.0 g),经1周驯化后进行安全性检测试验。暂养期间不投饵,连续充气,水温为(28±1)℃。
LB固体培养基,以及蛋白酶、脂肪酶和淀粉酶试验培养基按照文献[9]中的方法进行配制。
1.2 方法
1.2.1 菌株的分离与筛选
1) 细菌的分离、纯化。将黄金鲫肠道内容物原液按照10-3、10-4和10-5梯度稀释,分别取各稀释度的稀释液100 μL均匀涂布于LB培养基上(每个浓度设3个重复),37 ℃下倒置培养24 h,待培养基上均匀长出单个菌落时进行逐个划线纯化,直到平板上的菌落无杂菌出现为止。无菌条件下将筛出来的细菌菌液与体积分数为40%的甘油等体积混合于冻存管中,使甘油终体积分数为20%,于-80 ℃超低温冰箱中保存备用。
2) 细菌产酶试验。取100 μL供试菌液分别均匀涂布于淀粉酶、蛋白酶和脂肪酶筛选试验培养基上(每个试验均设3个重复)。置于恒温箱中37 ℃下培养24 h 后观察是否有水解圈出现,并计算水解圈直径与菌落直径的比值,比值越大表示产酶能力越强。
3) 体外抑菌试验。采用牛津杯法测定各个菌株的抑菌活性[10]。取200 μL浓度为106CFU/mL的指示菌菌液均匀涂布于固体LB培养基上,再将每个牛津杯中加入200 μL待测菌液, 37 ℃恒温箱培养24 h后,计算抑菌圈与菌落直径的比值(每个试验均设3个重复)。
4) 药敏试验。参照文献[11]中的方法,将筛选出的菌株接种于LB液体培养基中,于37 ℃下摇床培养16~18 h,取菌悬液100 μL 均匀涂布于LB固体培养基平板上,将药敏纸片贴于平皿培养基表面。置于恒温培养箱中37 ℃下培养24 h,并根据最后测量的抑菌圈直径大小判断菌株对抗生素的敏感性。试验结果依据《WS/T125—1999纸片法抗菌药物敏感试验标准》进行判断。
1.2.2 菌株的鉴定
1) 形态学鉴定。观察菌株纯化后的菌落形态,并进行革兰氏染色试验。
2) 生理生化鉴定。参照《常见细菌系统鉴定手册》[12],采用细菌生化微量反应管对分离菌株生化特征进行测定,并用吉林农业大学水产实验室保存的一株蜡状芽孢杆菌(HJJ2-5)作为参考菌株,进行对照试验。
3) 分子生物学鉴定。
DNA模板的制备:将菌株接种在平板上,于37 ℃下培养24 h,取单一菌落接种于LB培养液中,37 ℃下震荡培养24 h。取1 mL细菌悬浊液按照试剂盒提取DNA,备用,并作为PCR反应模板。
16S rRNA的PCR扩增、克隆与测序:采用16S rRNA的PCR扩增,通用引物为27F: AGAGTTTGATCMTGGCTCAG 和 1492R: TACGGYTACCTTGTTACGACT,由吉林省库美生物科技有限公司合成。PCR 反应体系(50 μL): 2×TransTaq®HiFi PCR SuperMixⅠ25 μL,DNA 模板3 μL,上、下游引物(10 μmol/μL)各 1 μL,双蒸水20 μL。PCR反应程序为:94 ℃下预变性5 min;95 ℃下变性10 s,55 ℃下退火20 s,72 ℃下延伸1.5 min,共进行35 个循环;最后在72 ℃下再延伸 10 min。PCR 产物纯化后送至吉林省库美生物科技有限公司进行测序。
16S rRNA序列分析及系统发育树的构建[13]:将测定的菌株HJJ-1的16S rRNA序列在GenBank中进行Blast分析,采用ClustalW法与相关菌属不同种的16S rRNA序列进行同源序列分析比对,测出目标菌株序列与已知序列的相似程度后,再用MEGA 5.0软件进行系统发育分析,以邻位结合法(Neighbor-Join)构建系统发育树,用自展法(Bootstrap)进行1000次重复,并用一致性指数(Consistency index, CI)来衡量分析结果的可靠性。
1.2.3 细菌活菌数与OD值相关曲线的建立 参考林静等[14]和李绍戊等[15]方法并进行适当修改。
1) 菌液的制备及OD 值的测定。
一级菌液的制备:挑取单个纯化后的菌落于LB液体培养基中,摇床(120 r/min,下同)37 ℃恒温培养16~18 h,即为一级菌液。
二级菌液的制备:吸取 200 μL 一级菌液加至20 mL LB液体培养基中,吹打混匀,即为二级菌液,继续放入摇床中37 ℃恒温培养。
OD值的测定:用移液器分别吸取0、2、4、6、8、10 h 时的 200 μL二级菌液,测定其 OD600 nm值(试验设3个重复)。
2) 菌落平板计数。采用稀释涂布平板计数法,将菌液进行 10-3、10-4、10-5、10-6、10-7和10-8梯度稀释,吸取各浓度菌液100 μL均匀涂布于LB固体培养基后,37 ℃恒温培养24 h,每个浓度试验设3个重复。当平板上的菌落数为 30~300 CFU时,即为合适的稀释倍数,取3次菌落数的平均值乘以其稀释倍数,即为 1 mL 菌液中的活菌数(CFU/mL)。
3) 活菌数与OD值的相关分析。通过分析数据可发现,细菌在生长对数期时菌液中的活菌数与其 OD600 nm值间存在着一定的对应关系,并得到相应的关系方程,可快速进行菌液中活菌的计数,为菌液中活菌数量的测量提供依据。
1.2.4 耐性试验
1)高温耐受性试验。由于芽孢杆菌为耐高温菌株,故本试验中选择 80 ℃为试验温度[16]。将单个菌落接种于LB液体培养基中,摇床37 ℃恒温培养16~18 h后,按照10-5、10-6和10-73个稀释倍数进行稀释,同时放入80 ℃恒温水浴锅中,分别在2、5、10、20、30 min时各取菌液100 μL,流水冷却后采用平板计数法检测活菌数并计算细菌的存活率,以室温下未经水浴的菌液作为对照(每个浓度的试验设3个重复)。
相对存活率=处理后存活的平均菌数/对照组存活的平均菌数×100%。
(1)
2)酸性耐受性试验。用37% 的 HCl 溶液将液体LB培养基的 pH调至3、4、5,高压蒸汽灭菌,对照组培养基的pH调至7.2,备用。
挑取单个纯化后的菌落于LB液体培养基中进行扩大培养,摇床37 ℃恒温培养16~18 h后,用移液器取2 mL菌液分别接种于pH为 3、4、5及对照组20 mL培养基中,37 ℃摇床培养,5 min后开始计时,分别于1、2 h时取液,按照10-5、10-6和10-73个稀释倍数进行稀释,取100 μL涂布于固体培养基上,用平板计数法检测活菌数,按式(1)计算存活率(每个浓度的试验设3个重复)。
3) 胃液耐受性试验。配制试验组和对照组液体LB培养基,高压蒸汽灭菌,备用。
胃液配制:取质量分数为10%的盐酸16.4 mL加蒸馏水稀释,按 1 mg/mL在溶液中加入胃蛋白酶,充分溶解后用0.22 μm的微孔滤膜过滤除菌。
将试验组培养基pH调至3,按0.5 mg/mL加入胃液,对照组不加胃液。将2 mL细菌接种于20 mL液体培养基中,细菌培养方法及菌液稀释梯度同“酸性耐受性试验”,只是取液时间为0.5、1、2、3、4 h时,并按式(1)计算存活率(每个浓度的试验设3个重复)。
4) 肠液耐受性试验。配制试验组和对照组液体LB培养基,高压蒸汽灭菌,备用。
人工肠液配制:取KH2PO41.36 g,加至100 mL培养基中溶解,按 10 mg/mL加入胰蛋白酶,调节pH至6.8,用0.22 μm的微孔滤膜过滤除菌,对照组培养基不加人工肠液。将2 mL细菌接种于20 mL液体培养基中,细菌培养方法及菌液稀释梯度同“酸性耐受性试验”,只是取液时间为0.5、1、2、3、4 h时,并按式(1)计算存活率(每个浓度的试验设3个重复)。
5) 胆盐耐受性试验。配制试验组和对照组液体LB培养基,高压蒸汽灭菌,备用。
在配制好的试验组培养基中按0.3 mg/mL加入胆盐,调至pH为6.8,完全溶解后混匀。对照组培养基不加胆盐,使用 0.22 μm 的滤器对培养基进行过滤除菌。取2 mL细菌接种于20 mL液体培养基中,细菌培养方法及菌液稀释梯度同“酸性耐受性试验”,只是取液时间为0.5、1、2、3、4 h时,并按式(1)计算存活率(每个浓度的试验设3个重复)。
1.2.5 黏附试验
1) 细菌培养。将纯化后的菌液在摇床中培养16~18 h后,离心收集沉淀菌体,用PBS(pH 7.2)洗涤2次,将离心收集的菌体悬浮于Hepes-Hanks溶液中,调整细菌浓度为1.0×108CFU/mL,置于4 ℃冰箱中备用。
2) 黏液蛋白制备。剖取健康黄金鲫前肠,纵向剖开肠管,参照Ouwehand等[17]的方法,用含0.01% 明胶的PBS将肠道内容物冲洗干净,然后刮取肠道内表面,得到黏液蛋白混合物,将其转移至Hepes-Hanks溶液中(10 mg/mL)离心,取上清液,并调整其质量浓度为0.5 mg/mL左右,分装后置于-20 ℃冰箱中保存备用。
3) 细菌染色。向菌悬液中加入Hoechst 33258染色液,调整其最终质量浓度为2 μg/mL,37 ℃下避光染色30 min后用PBS洗涤2次,离心收集菌体,将其悬浮于Hepes-Hanks溶液中,调整细菌浓度为1.0×108CFU/mL,置于4 ℃冰箱中备用[18]。
4) 体外黏附试验。取100 μL蛋白黏液加至96 孔黑色聚苯乙烯培养板中,4 ℃下固定24 h后,每孔加200 μL Hepes-Hanks溶液洗涤培养板后,每孔加100 μL 染色后的细菌(1.0×108CFU/mL),37 °C下孵育1 h,再次洗涤培养板后每孔加入200 μL 1% SDS-0.1 mol/L NaOH裂解液,60 ℃下孵育1 h。阴性对照,每孔加100 μL未标记的细菌(1.0×108CFU/mL);阳性对照,每孔加100 μL 标记的细菌(1.0×108CFU/mL)。使用荧光酶标仪测定荧光值,激发波长为340 nm,荧光发射波长为460 nm(每个试验设3个重复)。
黏附率=(试验组荧光强度-阴性对照荧光强度)/(阳性对照荧光强度-阴性对照荧光强度)×100%。
(2)
1.2.6 安全性检测 试验用黄金鲫经 1 周驯化后,选择适应环境、体格健壮的150 尾鱼,随机分为5组,每组30 尾,采用腹腔注射法,4个试验组每尾鱼分别注射浓度为1.0×105、1.0×106、1.0×107、1.0×108CFU/mL的菌悬液各200 μL,对照组注射200 μL无菌生理盐水。注射试验结束后将黄金鲫放回原水环境中继续饲养,每日记录死亡情况,连续观察7 d,最后进行解剖检查有无病变。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示。试验结果采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 菌株产酶能力的测定
本试验中共筛选出5株可同时产3种酶的菌株,如表1所示,其中,HJJ-1菌株产蛋白酶能力(H/D=3.99)和产淀粉酶能力(H/D=2.22)均显著高于其他菌株(P<0.05),而HJJ-3菌株产脂肪酶能力(H/D=2.64)显著高于其他菌株(P<0.05)。因此,共筛选出HJJ-1和HJJ-3两个菌株作为潜在益生菌,进行下一步筛选。
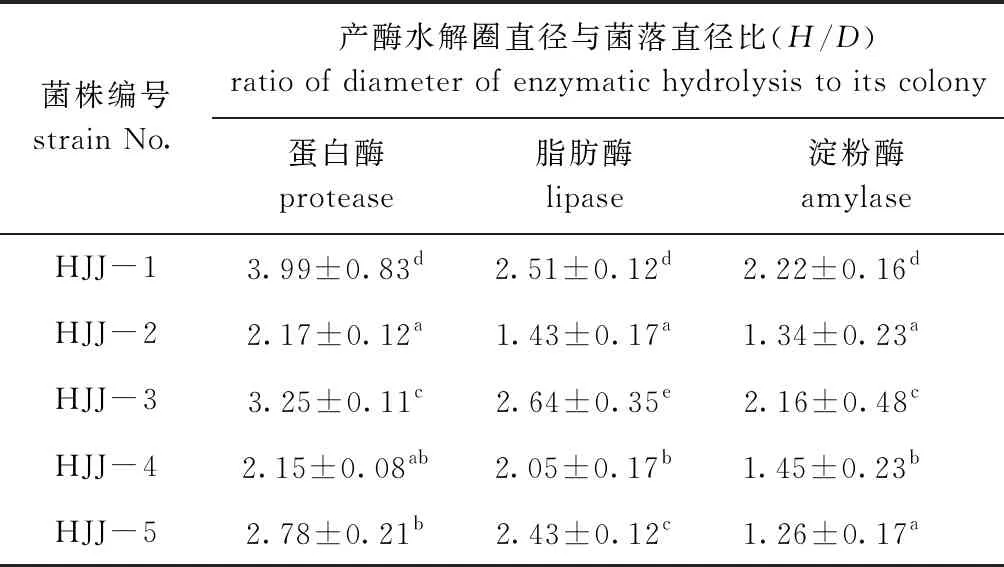
表1 分离菌株的产酶能力比较
2.2 体外抑菌试验
体外常见病原菌的拮抗试验结果如表2所示,其中,HJJ-1菌株对金黄色葡萄球菌和大肠杆菌具有较好的拮抗作用,而HJJ-3菌株仅对嗜水气单胞菌产生拮抗作用。因此,最终筛选出HJJ-1菌株进行下一步试验。

表2 常见病原菌拮抗试验Tab.2 Antagonistic test selection of bacteria
2.3 药敏试验
从表3可见:HJJ-1菌株对青霉素、磺胺异恶唑、利福平和头孢拉定等4种抗生素产生耐药性;对呋喃唑酮中度敏感;对红霉素、新霉素、卡那霉素、庆大霉素、丁胺卡那霉素、四环素、左氧沙星、环丙沙星、链霉素、诺氟沙星和妥布霉素等11种抗生素均高度敏感。
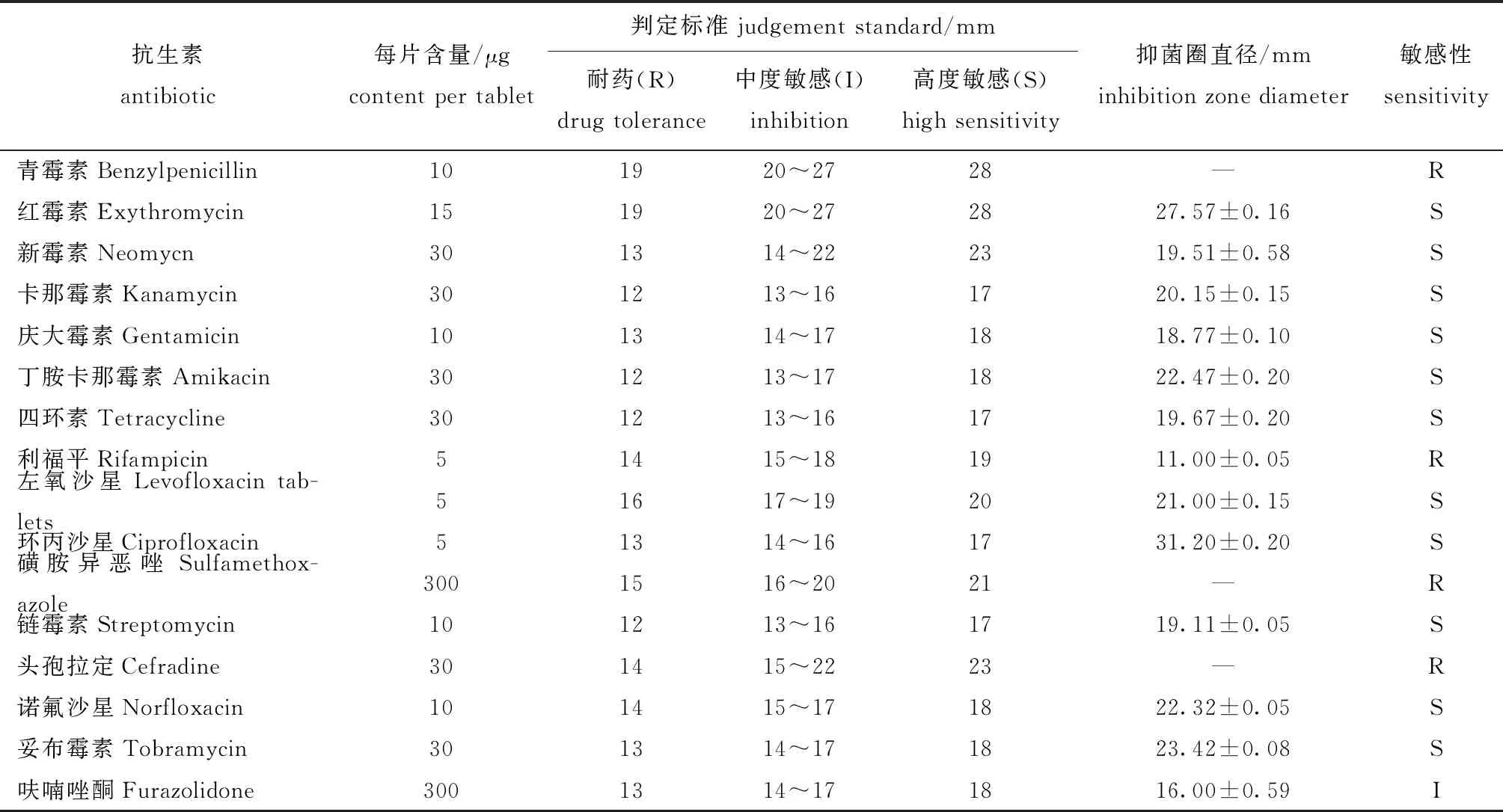
表3 HJJ-1菌株药敏试验结果Tab.3 Results of antibiotic sensitivity test of the isolated bacteria
2.4 菌株鉴定
2.4.1 菌株的形态特征 通过对黄金鲫肠道细菌的分离与纯化,经筛选后获得一株优势菌株,命名为HJJ-1,该菌株在有氧或无氧条件下均能生长。
1) 菌落形态(图1A)。将HJJ-1菌液均匀涂布于LB固体培养基平板上,经37 ℃下培养 18~24 h 后,菌落表面粗糙似毛玻璃状或融蜡状,扩展状,边缘不整齐,乳白色,不光滑,半透明或不透明,似蜡烛样颜色。
2) 个体形态(图1B)。HJJ-1经革兰氏染色试验后呈阳性,两端钝圆,细胞形态为短杆状,呈短链或长链。
3) HJJ-1菌株在液体培养基中与对照组空白液体LB培养液比较(图1C),呈均匀混浊生长,乳白色,培养24 h后形成小块状沉淀,振摇不散。
2.4.2 生理生化特征 从表4可见:常规生理生化分析试验结果表明,HJJ-1菌株有运动性,过氧化氢酶试验、接触酶试验、卵磷脂酶试验、柠檬酸盐试验、VP试验、卵黄反应试验、葡萄糖发酵试验、革兰氏染色试验、甲基红试验、L-谷氨酸试验、L-组氨酸试验、L-丝氨酸试验、L-天冬氨酸试验、1% NaCl生长试验、3% NaCl生长试验、6% NaCl生长试验、28 ℃生长试验、37 ℃生长试验、明胶液化试验及酪素水解试验均呈阳性;吲哚试验、脲酶试验、H2S产生试验、10% NaCl生长试验、10 ℃生长试验、45 ℃生长试验、鸟氨酸脱羧酶试验及赖氨酸脱羧酶试验均呈阴性;可还原硝酸盐,能分解蔗糖、果糖、麦芽糖,不能分解甘露醇、木糖、乳糖、纤维二糖、D-棉子糖、L-鼠李糖及肌醇。所分离的菌株形态和生理生化特性与本试验中所用的标准菌株蜡状芽孢杆菌HJJ2-5基本一致,初步鉴定所分离目标菌株为蜡状芽孢杆菌。

表4 菌株生化鉴定结果Tab.4 Biochemical identification results of the stains
2.4.3 分子生物学鉴定结果 将菌株HJJ-1的16S rRNA测序所得序列在NCBI中进行Blast比对,结果显示,菌株HJJ-1与蜡状芽孢杆菌16S rRNA基因一致性达到100%,这说明菌株HJJ-1与蜡状芽孢杆菌同源性最高。用MEGA 5.0软件中的邻接法(NJ)构建13个菌种的系统发育树,结果显示,菌株HJJ-1与蜡状芽孢杆菌(AY138279.1、KJ948667.1、EF100616.1、KT982242.1)聚为同一分支,说明亲缘关系较近(图2)。结合形态、生理生化特征及16S rRNA序列鉴定结果,最终将菌株HJJ-1鉴定为蜡状芽孢杆菌。
2.5 细菌浓度与 OD 值的相关性
菌株HJJ-1在各个时间点的OD600 nm值、平板计数的菌落数、稀释倍数、1 mL 菌液内的活菌数如表5所示。测定HJJ-1菌液在 0~10 h 内6个时间点的 OD600 nm值,由于10 h时间点的OD600 nm值误差过大,不利于生长曲线的拟合,故将其舍弃。以涂板计数得到的活菌数为y轴,以菌液OD600 nm值为x轴,得到活菌数与OD600 nm值的相关曲线方程为y=5.493 3e7.823 8x(R2=0.990 2)(图3)。

表5 HJJ-1菌数值汇总Tab.5 Summary of HJJ-1 bacterium
2.6 耐性试验
2.6.1 高温耐受试验 从图4(a)可见:HJJ-1菌株在不同时间点下对高温的耐受性有显著性差异(P<0.05),但在短时间的高温处理下,各菌株保持着较高的存活率;随着水浴时间的延长,菌株的存活率逐渐降低,菌株在2 min条件下的存活率显著高于30 min条件下的存活率(P<0.05)。
2.6.2 酸性耐受试验 从图4(b)可见:菌株在不同pH条件下的存活率有显著性差异(P<0.05),在pH为3~5范围内,随着pH升高,1、2 h取样组的存活率均显著升高(P<0.05),且HJJ-1菌株在不同pH条件处理下,1 h取样组存活率均高于2 h组,但无显著性差异(P>0.05),这说明HJJ-1菌株具有良好的酸性耐受能力。
2.6.3 胃液耐受试验 从图4(c)可见:HJJ-1菌株在不同时间下对胃液的耐受能力有显著性差异(P<0.05);随着时间的延长,菌株存活率显著降低(P<0.05),但在4 h时菌株的存活率仍达62.91%,这说明其具有良好的胃液耐受能力。
2.6.4 肠液耐受试验 从图4(d)可见:HJJ-1菌株在处理0.5 h和1 h间的存活率无显著性差异(P>0.05),均达到92%以上;随着处理时间的延长,存活率显著降低(P<0.05),但菌株在处理4 h时的存活率仍达到69.54%,这说明菌株HJJ-1对肠液有较好的耐受能力。
2.6.5 胆盐耐受试验 从图4(e)可见:随着时间的延长,菌株存活率显著降低(P<0.05);HJJ-1菌株在处理4 h时,存活率仍在65.43%以上,在处理0.5 h时的存活率最高,为88.5%,这说明菌株对胆盐也具有一定的耐受能力。
2.7 黏附试验
根据黏附试验结果(图4(f)),计算出菌株HJJ-1对黄金鲫肠道黏液的黏附率为18.1%。
2.8 安全性测试结果
安全性检测试验结果显示,黄金鲫注射1.0×105、1.0×106、1.0×107、1.0×108CFU/mL的菌悬液后,与对照组相比均未出现死亡,存活率均为100%,解剖发现,对照组和试验组内脏均正常无变异。这说明HJJ-1菌株对黄金鲫具有较好的安全性。
3 讨论
3.1 菌株的筛选及鉴定
本试验在筛选益生菌的过程中,以筛选出适合鱼类饲料中添加剂型的益生菌为主要目的,初步比较了细菌的产酶能力和对常见病原菌的拮抗能力,并进一步检测了细菌对抗生素的敏感性,将产酶能力和拮抗病原菌能力强、携带抗生素耐药因子少的菌株筛选出来作为潜在益生菌,进行下一步试验。
本研究中从黄金鲫肠道中筛选得到一株潜在益生菌 HJJ-1,具有产蛋白酶、淀粉酶和脂肪酶能力,将其作为益生菌添加到鱼类饲料中,可促进机体对营养成分的消化和吸收,丁贤等[19]研究发现,用含芽孢杆菌的饲料投喂南美白对虾Penaeusvannamei,可提高南美白对虾的蛋白酶、淀粉酶和脂肪酶活性。拮抗试验结果表明,HJJ-1菌株对致病性大肠杆菌和金黄色葡萄球菌具有拮抗性,提示其可用于感染大肠杆菌和金黄色葡萄球菌引发的鱼类疾病的防治,这与SA38蜡样芽孢杆菌在体外对3株病原细菌有拮抗作用[20]且能强烈抑制大肠杆菌生长[21]的研究结果一致。抗生素敏感试验结果显示,HJJ-1菌株仅对青霉素、磺胺异恶唑、利福平和头孢拉定等4种抗生素产生耐药性,携带耐药因子较少。综合革兰氏染色镜检试验、形态特征观察及生理生化试验结果,初步鉴定菌株HJJ-1是革兰氏阳性菌,生理生化特征试验结果与蜡状芽孢杆菌基本一致;对分离的 HJJ-1菌株进行16S rRNA 序列测定及构建系统发育树,结果显示,HJJ-1菌株与蜡状芽孢杆菌一致性高达100%,在系统发育树上聚为同一分支。综合以上试验结果,将HJJ-1菌株最终鉴定为蜡状芽孢杆菌。
3.2 菌株的黏附能力及耐性分析
目前,尽管益生菌的应用已十分广泛,但饲用益生菌产品至今尚无完备的评价体系,产品质量无法规范控制,导致益生菌产品的作用效果参差不齐,严重影响益生菌添加剂的实际应用。如在饲料工业上,高温、高压条件均会对细菌产生一定的影响[22]。有研究表明,乳酸菌在制粒后的死亡率高达95%以上[23],且由于动物胃肠道内的低pH、胆盐及其他多种酶类[18],导致饲用益生菌进入消化道后难以定植[24],细菌对肠道的黏附能力也是影响益生菌产品稳定性的关键因素。为此,本试验中建立饲用益生菌评价体系,通过检测菌株的耐高温能力、耐酸能力、耐胆盐能力、耐胃液能力、耐肠液能力及对肠道黏液蛋白的黏附能力,反映益生菌对宿主产生的有益作用,同时也为益生菌产品质量控制的指标提供基础数据。
本试验结果表明,HJJ-1菌株在耐高温、耐酸、耐胆盐、耐胃液和耐肠液试验中均表现出良好的耐受性,且可以黏附在黄金鲫肠道黏液蛋白上。何月英等[25]研究发现,蜡样芽孢杆菌在60~90 ℃下处理10~20 min仍能生长;张璐[18]在试验中指出,3种芽孢杆菌在模拟制粒时,蜡样芽孢杆菌耐热性最强;而 Guo等[26]在筛选芽孢杆菌时发现,6株芽孢杆菌中有5株对模拟胃液表现出良好的耐性;贺永明[27]研究发现,芽孢杆菌的芽孢衣可以维持芽孢膜的表面张力,使芽孢杆菌对胆盐表现出较强抗性。以上试验结果均说明,芽孢杆菌具有良好的耐受性,这与本研究结果一致。蜡状芽孢杆菌常处于孢子和休眠状态下,具有耐高温、耐酸碱、耐挤压等特点,因此,可在饲料中长期存在[28],且饲料中蜡状芽孢杆菌的孢子进入肠道后,能迅速在肠道上部复活,且复活率高达100%[29],在畜禽养殖业和水产养殖业的使用过程中均取得了明显的效果[30],是中国正式批准生产微生态制剂的菌种之一。作为益生菌,安全无致病性是最重要的特性之一,因此,潜在益生菌在投入实际生产和使用前,必须对菌株的安全性做出准确的评价[31]。本研究中,通过急性毒性试验检测,HJJ-1菌株对黄金鲫未显示毒性,安全性良好。可以考虑将其作为饲料添加剂替代激素、抗生素和防腐剂。
4 结论
1)本研究从黄金鲫肠道中共分离出 5 株具有产酶能力的细菌,其中菌株HJJ-1 产蛋白酶、淀粉酶和脂肪酶能力较强,体外抑菌能力良好,且对多种药物敏感,携带耐药因子较少,经鉴定HJJ-1为蜡状芽孢杆菌。
2)HJJ-1在耐高温、耐酸性、耐胃液、耐肠液、耐胆盐试验中均表现出良好的耐受性。
3)HJJ-1可黏附于黄金鲫肠道黏液蛋白上,且安全性良好,具有潜在的益生特性。本研究结果为进一步研制水产类微生态制剂提供了优良的益生菌菌种参考。

