厄贝沙坦对糖尿病大鼠心肌损伤中MAPKs信号通路及相关因子的影响
李 辉,康品方,徐庆梅,戎 李,孙 硕,张 冰,高 琴,高大胜,王洪巨
随着我国人口老龄化的到来,心脑血管疾病已经成为我国城乡居民致死的首要因素,糖尿病作为冠状动脉疾病、高血压的独立危险因素,加重了冠心病、心力衰竭等心血管疾病的发病进程。其中,糖尿病心肌病(DCM)是糖尿病病人致死的主要原因之一。目前研究发现DCM主要病理生理机制包括心肌细胞凋亡、心肌纤维化、左心室功能障碍和代谢紊乱等[1]。但具体发病机制并未完全阐明。因此,探究DCM发病机制及病理过程,被认为是治疗DCM的关键因素。MAPKs信号通路是目前发现的最主要的生长信号调节蛋白之一,广泛存在于细胞质内,对细胞的增殖、分化与凋亡过程起着重要的作用。既往研究[2]发现,MAPKs信号通路及其下游因子参与高糖诱导的心肌损伤中炎性反应、细胞凋亡等病理过程。
厄贝沙坦是一种血管紧张素Ⅱ受体抑制剂,被认为是改善心肌细胞结构及功能、降低心力衰竭远期死亡风险的临床常用药物。既往研究[3]也发现厄贝沙坦可以减轻糖尿病心肌细胞炎性反应等,达到保护心肌损伤的作用。但厄贝沙坦是否通过影响MAPKs信号通路发挥其抗糖尿病心肌损伤作用目前尚未明确。本研究拟通过复制大鼠糖尿病心肌损伤,运用Western blotting技术检测糖尿病心肌组织中 MAPKs通路下游因子的蛋白表达,明确厄贝沙坦是否通过调控MAPKs通路改善糖尿病心肌损伤,为后期探讨糖尿病心肌损伤的分子机制提供理论依据。现作报道。
1 材料与方法
1.1 材料和试剂 清洁级雄性SD大鼠50只,体质量140~160 g,购自蚌埠医学院动物实验中心。链脲佐菌素(STZ)(Sigma公司,美国);ECL发光试剂盒(Millipore 公司,美国);MKP-1、P38MAPK和P-ERK单克隆抗体(Abcam公司,英国);Masson染色试剂盒,大鼠IL-1β、IL-6和IL-1 ELISA检测试剂盒(上海朵雨生物,中国)。
1.2 分组及糖尿病大鼠模型制备 将大鼠于实验室适应性饲养1周后随机分为糖尿病4周(DM4W)组、糖尿病8周(DM8W)组、糖尿病8周+厄贝沙坦(DM8W+Ir)组、对照(Con)组、高糖高胆固醇饮食(HC)组,各10只。禁食12 h后测定各组血糖,其中DM4W、DM8W、DM8W+Ir组大鼠腹腔注射STZ 55 mg/kg,DM8W+Ir组给予厄贝沙坦50 mg·kg-1·d-1灌胃,Con组和HC组给予同等剂量0.9%氯化钠溶液灌胃,造模成功后第4周,处死DM4W组大鼠并留取心脏组织标本,其余各组继续饲喂至第8周。
1.3 大鼠空腹血糖(fasting blood glucose,FBG)、体质量(body weight,BW)、心体比(heart weight/body weight,H/B)及左心室质量指数(left ventricular mass index,LVWI)测定 DM4W组大鼠造模成功并饲喂4周、其余组大鼠饲喂至第8周处死前,清晨检测大鼠FBG及BW。处死大鼠后取出心脏组织,运用0.9%氯化钠溶液反复冲洗后滤纸吸干水分,检测全心质量,分离左心室再次称重;计算H/B、LVWI。
1.4 Masson染色观察心肌纤维化 取各组大鼠心肌组织,以4%多聚甲醛固定,经洗涤、脱水、透明、浸蜡和包埋处理后制作成约3 μm石蜡切片,Masson染色观察胶原含量,评估心肌组织纤维化。
1.5 ELISA法测定心肌细胞白细胞介素(IL)-1β、IL-6、IL-1表达水平 取各组大鼠心肌组织加入0.9%氯化钠溶液充分研磨后离心取上清液。测量时依据大鼠IL-1β、IL-6、IL-1 ELISA检测试剂盒使用说明书操作;酶标仪在450 nm 测定各样本OD值,应用Curve-Expert 1.3软件转换成浓度水平。
1.6 Western blotting法检测心肌细胞MKP-1、P38MAPK、P-ERK1/2蛋白表达 取各组大鼠心肌组织100 mg剪碎,加入裂解液,碾磨成乳糜状,4 ℃、12 000 r/min离心15 min,收集上清液;按BCA蛋白定量试剂盒说明书操作,取80 μg上清液,蛋白定量后,SDS-聚丙烯酰胺凝胶电泳,电转膜至 PVDF 膜;分别加入MKP-1、P38MAPK和P-ERK一抗,4 ℃孵育过夜。次日洗涤后加入二抗IgG孵育,ECL 试剂盒进行曝光成像,并测定条带的灰度值,计算MKP-1/β-actin、P38MAPK/β-actin和P-ERK/β-actin蛋白的相对表达量。
1.7 统计学方法 采用方差分析和q检验。
2 结果
2.1 各组大鼠FBG、BW、H/B及 LVWI比较 HC组大鼠FBG、BW、H/B、LVWI与Con组差异均无统计学意义(P>0.05);与Con、HC组比较,各糖尿病组大鼠FBG均明显升高,BW均降低,H/B及LVWI均增高(P<0.05~P<0.01);与DM4W、DM8W组比较,DM8W+Ir组H/B及LVWI均降低(P<0.05~P<0.01)(见表1)。
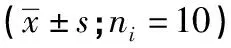
表1 各组大鼠FBG、BW、H/B及 LVWI比较
2.2 各组大鼠心肌纤维化表现 Masson染色后,显微镜下观察各组大鼠心肌组织,心肌细胞呈红色,胶原纤维呈蓝绿色,Con组和HC组心肌细胞排列规则,胶原纤维呈条索状散在分布;DM4W组、DM8W组大鼠心肌组织纤维粗大,堆积成片状,分布不均,沉积增多,DM8W+Ir组大鼠心肌组织心肌形态则有明显改善(见图1)。
2.3 各组大鼠心肌细胞IL-1β、IL-6、IL-1水平比较 HC组大鼠IL-1β、IL-6、IL-1水平与Con组差异均无统计学意义(P>0.05);与Con组和HC组比较,各糖尿病组大鼠IL-1β、IL-6和IL-1水平均升高(P<0.05);与DM4W组和DM8W组比较,DM8W+Ir组IL-1β、IL-6和IL-1水平均降低(P<0.05)(见表2)。
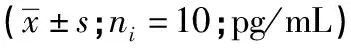
表2 各组大鼠心肌细胞IL-1β、IL-6、IL-1水平比较
2.4 各组大鼠心肌组织MKP-1、P38MAPK、P-ERK1/2蛋白表达水平比较 HC组MKP-1、P38MAPK、P-ERK1/2蛋白表达与Con组差异均无统计学意义(P>0.05);与HC组比较,各糖尿病组大鼠P38MAPK、P-ERK1/2蛋白表达明显增加,MKP-1表达降低(P<0.05);与DM8W组相比,DM8W+Ir组P38MAPK、P-ERK1/2蛋白表达均明显降低,而MKP-1表达增加(P<0.05)(见图2、表3)。
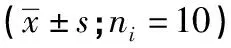
表3 各组大鼠心肌组织MKP-1、P38MAPK、P-ERK1/2蛋白表达水平比较
3 讨论
糖尿病心肌损伤是引起心力衰竭的重要因素之一,其主要对心脏结构及功能障碍产生影响[4-5]。本研究通过复制2型糖尿病大鼠模型发现,与Con组及HC组相比,DM组大鼠体质量明显减低,符合糖尿病“体质量减轻”的典型临床表现。H/B和 LVWI升高提示糖尿病大鼠心肌肥厚,Masson染色提示糖尿病大鼠心肌组织纤维杂乱无章,成网状堆积,表明高糖加重心肌组织纤维化程度,同时,给予厄贝沙坦干预后,糖尿病心肌组织在纤维化程度和反映炎症指标IL-1β、IL-6、IL-1方面均有不同程度的改善。
随着研究的深入,糖尿病心肌损伤是一种多机制综合病理结果。目前,对糖尿病心肌损伤目前还没有统一认识,其可能涉及心肌细胞内代谢障碍、细胞肥大、炎性反应、自噬及凋亡、组织基质纤维化等多个环节[6-7]。其中,炎性反应最早被认为参与糖尿病心肌损伤病理过程,高血糖可通过诱导高水平活性氧而导致机体慢性低度炎症状态。而炎性介质IL-1β和IL-1是DCM许多病理生理过程的共同起点[8]。本研究也通过ELISA法检测大鼠心肌细胞内炎症细胞因子 IL-1β、IL-6、IL-1表达水平,结果表明各糖尿病组大鼠心肌细胞内炎性反应因子表达明显增加,进一步证实了炎性反应在糖尿病心肌损伤中发挥重要作用。
MAPKs信号通路是哺乳动物细胞间传递细胞肥大和增殖的重要信息通路,其主要亚群P38MAPK 及 ERK1/2通过激活细胞核内转录因子如NF-κB和激活蛋白-1在炎症反应中的发挥重要作用。因此MAPKs信号通路成为抗炎性反应的重要靶点[9]。ERK1/2与细胞生长、分化、增殖和凋亡的调控关系最为密切,其被外界各种生长因子、离子射线、过氧化氢等作用后进而激活;随后,进入细胞核作用于 c-myc、激活蛋白-1、NF-κB 等转录因子,促进相关基因的转录与表达,与细胞的增殖密切相关,其可通过磷酸化多种底物蛋白在细胞生长、发育、分化、凋亡及恶性转化等过程中均起重要作用[10]。有研究[11]发现,甲基CPG结合蛋白2通过激发ERK1/2活性触发心脏成纤维细胞增殖,加速心肌纤维化进程。ERK1/2活性受其下游 MKP-1的调控,MKP-1使磷酸化ERK1/2去磷酸化而失去活性。由于 MKP-1对 MAPKs去磷酸化有较高的特异性,因此在 MAPKs活性调节方面起重要作用。P38MAPK信号通路与细胞对应激反应有关,如炎症和氧化应激[12]。研究[13]发现,在STZ诱导的糖尿病小鼠肾脏损伤模型中P38MAPK被活化,且表达均增加。其机制可能与糖尿病肾病激活体内炎性反应,使TNF-α、IL-1、IL-6、IL-8等炎性因子表达增多,同时这些炎性因子又可激发P38MAPK信号通路,形成恶性循环有关。
因此,有研究者猜想抑制MAPKs信号通路是否对糖尿病心肌损伤具有保护作用。近期CAO等[14]研究发现,香菇菌属多聚糖可以通过调节MAPKs信号通路降低长期暴露在高糖溶液中小鼠胰岛β细胞受到的损伤,其机制可能与香菇菌属多聚糖抑制P38MAPK的活性有关。本研究运用Western blotting法检测心肌组织MKP-1、P38MAPK、P-ERK1/2蛋白的表达,结果显示,与Con组及HC组相比,DM组大鼠心肌组织内反应MAPKs信号通路因子P38MAPK、P-ERK1/2蛋白表达明显升高、下游 MKP-1因子表达降低,说明MAPKs信号通路参与糖尿病心肌损伤病理过程。其分子机制可能是高糖的细胞外刺激通过 MAPKs 信号通路的P38MAPK、P-ERK1/2并行通路和MAPKs 通路间的“对话”共同调节糖尿病心肌细胞炎症反应及凋亡过程。因此,本研究也进一步证实了MAPKs 信号通路在糖尿病心肌损伤发生进展过程中的多种细胞病理反应起着重要的调控作用。
厄贝沙坦通过抑制机体中肾素血管紧张素系统发挥扩张血管平滑肌、改善血管微循环、抑制基质的合成,降低细胞的死亡率等作用。既往研究[15]表明厄贝沙坦对糖尿病心肌细胞有保护作用,张冠军等[15]通过厄贝沙坦干预1型糖尿病大鼠模型发现,厄贝沙坦可以通过调节MMPs信号通路及相关因子减轻糖尿病心肌组织纤维化程度。本研究中,通过给予DM8W+Ir组大鼠厄贝沙坦干预后也发现,MAPKs信号通路及相关因子的标记物及炎性指标较单纯糖尿病组大鼠有明显改善,同时心肌细胞形态和结构也有一定的恢复。同时提示厄贝沙坦可能通过抑制MAPKs 信号通路的表达,减轻了心肌损伤中的氧化应激、炎性反应等病理过程发挥心肌保护作用。

