YAP1 在结直肠腺癌中的表达
李洁,易烽明,冯龙(通信作者)
1 萍乡市第二人民医院肿瘤科 (江西萍乡 337000);2 南昌大学第二附属医院肿瘤科·江西省肿瘤临床转化重点实验室 (江西南昌 330000)
结直肠癌是一种临床较常见的恶性肿瘤,且近年来发病率呈逐渐升高的趋势。该病的病因及发病机制较复杂,尤其是分子学发病机制,但是,大多数结直肠癌仍遵循“正常黏膜-腺瘤-腺癌”的经典发展顺序。有研究证实,结直肠癌也可以其他的方式发展,如“腺瘤-癌”,且该方式主要通过Wnt/β-catenin通路激活[1]。
Hippo 信号通路起初是在果蝇细胞中发现的,参与细胞的增殖和凋亡,在哺乳动物中该激酶轴高度保守。此种信号通路的核心激酶是YAP/TAZ 蛋白,其可被激活的LATS1/2-Mob 复合物磷酸化,并与14-3-3蛋白相互作用且被阻断在细胞质中,并被泛素依赖的蛋白酶体降解,故而该信号通路可通过控制蛋白分布和蛋白酶限制YAP/TAZ 功能。而未被磷酸化的蛋白可转移至细胞核,并与转录因子TEAD 结合,促进基因表达,达到细胞增殖的目的[2]。
Hippo 信号通路已被证实参与多种癌症(肺癌、食管癌、胃癌等)的发生、发展,主要通过调控细胞凋亡,调节组织的生长,进而发挥作用。在对癌症患者进行细胞层次的研究中均发现了Hippo 信号通路失衡,然而在结直肠癌的发病机制中,关于Hippo 信号通路的研究尚少。本研究旨在探讨YAP1在结直肠腺癌中的表达情况。
1 材料与方法
1.1 标本来源
选取2013年6月至2015年12月南昌大学第二附属医院收治的88例结直肠疾病患者作为研究对象,采集其中30例结肠腺癌患者的30份标本作为A 组,30例直肠腺癌患者的30份标本作为B 组,28例良性结肠息肉患者的28份标本作为C 组。
1.2 方法
采用免疫组化ABC法检测YAP1的表达情况,具体方法为:(1)石蜡切片,脱蜡、水化;(2)采用微波法实施抗原修复,条件为0.01 mol/L柠檬酸盐缓冲液;(3)取切片,滴加过氧化物酶,室温孵育10 min,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次(3 min/次);(4)除去PBS,滴加一抗/二抗,4 ℃孵育过夜/室温孵育15 min,PBS分两批次冲洗6次(3 min/次);(5)除去PBS,滴加加强型3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)(新鲜配置)显色,反应时间为3 min,经苏木精复染,封片。结果经病理科副主任确认。
1.3 YAP1表达强度
阳性细胞百分比:0分表示<5%,10分表示5%~10%,20分表示11%~30%,40分表示31%~50%,60分表示51%~75%,80分表示>75%。染色强度:0分表示无染色,5分表示浅棕色,10分表示棕褐色,20分表示深棕色。表达强度为阳性细胞百分比评分与染色强度评分总和。
1.4 统计学处理
采用SPSS 13.0统计软件进行数据分析,结果以中位数表示(不符合正态分布),两独立样本比较采用非参数检验,检验标准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 YAP1在结直肠腺癌组织中的表达
在结直肠腺癌组织标本中,YAP1染色阳性表现为棕褐色(胞质或胞核);大部分腺泡均有染色,而周围基质细胞无阳性染色,对比度高,见图1。
2.2 YAP1在不同类型患者组织中的表达

图1 YAP1 在结直肠腺癌组织中的染色
YAP1在A、B 两组中的宽大腺体细胞及周围基质呈寡表达,表现为无染色,证实YAP1具有较高的特异性;而在C 组中全部呈现寡表达(图2)。正态分析结果显示,A 组及C 组YAP1的表达数据均不符合正态分布,经统计学软件对比分析发现,A 组的YAP1表达强度为50分,明显高于C组的0分,差异有统计学意义(P=0.003),见图3;B 组的YAP1表达强度为55分,明显高于C 组的0分,差异有统计学意义(P=0.0008),见图4。

图2 YAP1 在不同组织中的染色

图3 A 组与C 组的YAP1 散点图
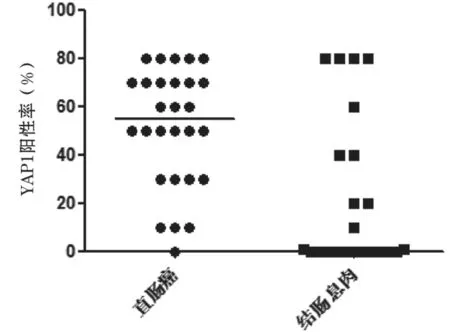
图4 B 组与C 组的YAP1 散点图
3 讨论
在我国,结直肠癌每年的发病率占全部恶性肿瘤的8%~9%[3]。其发病机制较复杂,从细胞层次来讲,以Wnt/β-catenin 为人们最为认可的通路,但同时,也对其他通路(如Hippo 信号通路)进行了深入的研究。Hippo 信号通路主要通过调节细胞增殖、凋亡来达到细胞生长平衡的目的[4]。
YAP 属Hippo 信号通路下游的转录激活因子,其过表达可导致机体组织发生肿瘤病变,如在肝肿瘤中,可通过抑制Hippo 信号通路或过表达YAP,促进肿瘤的发生、发展。YAP 的活性变化可影响肝脏的形态及生理功能,其参与肝纤维化及肝癌的发生、发展[5]。有针对体内及体外实验的研究证实,Hippo 信号通路的破坏及随后的YAP1的过度激活可以诱导浸润性宫颈癌的发生[6]。另有研究对127例行根治性手术并接受辅助放射治疗的口腔鳞癌患者的组织标本进行YAP1检测,结果显示,YAP1过表达与患者预后不良相关[7]。有研究发现,在小鼠模型中,通过激活胰腺泡细胞中的YAP1和TAZ,可增加JAK-STAT3的信号传导,后者可导致小鼠胰腺肿瘤的增长[8]。有研究通过免疫组化评估了302份胃癌标本中YAP1和P62蛋白的表达,结果显示,与正常胃黏膜比较,YAP1在中分化胃腺癌、低分化腺癌和印戒细胞癌中的表达均明显增强[9]。有针对YAP1在结直肠癌组织中表达失衡的研究显示,利用siRNA 沉默YAP1表达可显著抑制YAP 表达,YAP1过表达可导致结直肠癌细胞的增殖、侵袭和迁移[10]。一项纳入18个研究共2 941例患者的荟萃分析表明,YAP1的过表达预示着胃肠道癌的不良预后[11]。本研究结果显示,A、B组的YAP1表达强度均高于C 组,但A、B 组无明显差异,表明YAP1的过表达与结直肠腺癌的发生、发展密切相关。
综上所述,Hippo 信号通路失衡及YAP1过表达与结直肠腺癌的发生、发展密切相关,但目前越来越多的实验证据表明,YAP/TAZ 存在多个步骤的级联反应激活,且也有众多其他的信号通路可导致YAP/TAZ 的活化,使得YAP/TAZ 上游的信号网络复杂,研究YAP/TAZ 的激活可为癌症治疗提供新的靶点。

