Ce改性Ni/KIT-6催化剂上乙醇干气重整反应
隗义琛,蔡伟杰,谭凤芝,刘宪云
(1.大连工业大学轻工与化学工程学院,辽宁 大连 116034; 2.河南省煤炭绿色转化重点实验室,河南理工大学,河南 焦作 454000)
近年来温室气体二氧化碳(CO2)的有效减排、低碳经济发展引起广泛关注,目前主要包括物理封存和化学转化技术[1-3]。其中甲烷和CO2干气重整制合成气备受关注,此过程既可减少CO2的排放,又实现了CO2高值资源化利用[4-5]。然而甲烷属于传统化石能源,其大规模转化利用不符合可持续发展战略的需求。利用可再生的生物质衍生物乙醇与CO2重整制合成气成为目前绿色化学研究的热点之一[6]。
乙醇与CO2重整又称乙醇干气重整反应(CH3CH2OH+CO2→3CO+3H2),首先乙醇进行脱氢反应生成乙醛,乙醛裂解生成甲烷和一氧化碳,随后甲烷和二氧化碳发生重整生成合成气,同时也伴随着相关副反应的进行,例如乙醇可能会脱水生成乙烯,乙烯进一步聚合生成积碳,乙醇也可能会发生自身缩合生成丙酮、乙醚等。目前,反应温度、低选择性和催化剂易失活是制约乙醇干气重整制合成气大规模工业化发展的瓶颈,寻找能够降低反应温度、高效稳定的催化剂是一个突破口。
现有文献报道的适用于干气重整反应的催化剂主要分为贵金属和过渡金属催化剂2大类[7]。贵金属催化剂由于其独特的电子结构和性质,因而具有较高的催化性能[8-9]。然而由于贵金属价格高昂,难以大规模产业化应用。Ni基过渡金属催化剂具有较强的断裂C—C键活性,表现出较高的催化活性,而且价格低廉,从工业应用的角度考虑,比贵金属催化剂具有优势,因此对Ni 基催化剂的研究具有一定的现实意义[10]。但当前抑制其大规模应用的因素主要是催化剂表面积碳以及Ni金属烧结引起的失活。因此如何避免Ni基催化剂在实际反应气氛下的性能失活是一个重要的挑战。研究发现对载体进行掺杂改性不仅增强其热稳定性,助剂与载体及活性金属之间存在的结构协同效应和电子间的传递效应,使催化剂显示出更优异的性能[11-12]。
本研究重点考察了Ce助剂对Ni/KIT-6催化剂上乙醇干气重整反应性能的影响。为化学反应计量比条件下高效催化剂的设计和改进提供一定的理论和实验基础。
1 实验部分
1.1 试剂
聚醚P123(平均相对分子质量5 800,分析纯,麦克林化学试剂);六水硝酸铈[Ce(NO3)3·6H2O](分析纯,国药集团试剂);六水硝酸镍[Ni(NO3)2·6H2O](分析纯,国药集团试剂);无水乙醇(CH3CH2OH,>99.7%,国药集团试剂);盐酸、正硅酸乙酯、正丁醇、甲醇均为分析纯(天津科密欧试剂)。
1.2 催化剂制备
载体:称取3 g P123、5.9 g盐酸和108 g去离子水放于烧杯中,并将其置于35 ℃水浴锅中,连续搅拌至P123完全溶解呈透明状液体。随后加入3 g正丁醇并在35 ℃下搅拌1 h,再将6.5 g正硅酸乙酯逐滴加入其中,同时加入适量六水硝酸铈,继续搅拌24 h。然后将所得液体转移到100 mL水热反应釜中,放置在100 ℃的烘箱内处理24 h。冷却至室温后,抽滤,利用热去离子水洗涤至中性,100 ℃过夜干燥。将所得固体放置马弗炉中550 ℃焙烧5 h,即得到掺杂型10%Ce-KIT-6载体。利用同样方法制备未掺杂KIT-6载体。
Ni基催化剂:利用甲醇辅助浸渍法制备担载型Ni基催化剂。将1 g KIT-6或Ce-KIT-6载体、0.77 g Ni(NO3)2·6H2O和20 mL甲醇溶剂置于烧杯中。在室温下充分搅拌,将Ni(NO3)2·6H2O完全溶解以及载体充分分散在溶剂中,随后升温至60 ℃,继续搅拌,直至甲醇溶剂完全蒸发。将得到的固体粉末100 ℃过夜干燥,马弗炉中600 ℃煅烧6 h,得到15%Ni/Ce-KIT-6和15%Ni/KIT-6催化剂。
1.3 催化剂表征
采用PerkinElmer, Optima 8000型等离子体发射光谱分析法(ICP-OES)测定催化剂中活性金属Ni的实际担载量。
N2吸附-脱附曲线利用Micromeritics Auto ChemⅡ仪器在-196 ℃条件下测量。分析前,将样品置于氮气气氛中脱气1 h,以去除催化剂表面吸附杂质。
催化剂的XRD图谱由XRD-7000 型X射线衍射仪测定,条件:Cu_Kα靶(40 kV,30 mA),波长:0.154 nm,扫描范围:10°~70°,扫描速度5.0(°)/min。
氢气程序升温还原测试(H2-TPR)在ZXD-THX-6型程序升温仪上进行。样品置于石英管中,先用氮气(40 mL/min)在300 ℃下预处理1 h。冷却到室温后,切换成5%(体积分数,下同) H2/Ar还原气 (40 mL/min),以5 ℃/min的升温速率加热至800 ℃。氢气消耗量由配备的TCD检测器来检测。
反应前催化剂的形貌结构使用扫描电子显微镜(JSM-7800F)来分析。反应后催化剂采用透射电镜(JEM-2100)来观察。
拉曼光谱利用配备电荷耦合检测器(CCD)的RENISHAW inVia拉曼光谱仪测定。激光波长532 nm,扫描范围800~2 000 cm-1。
1.4 催化剂性能评价
利用气固相反应在线分析系统中进行乙醇干气重整反应。称取100 mg (40~60目)催化剂置于内径为8 mm的石英玻璃反应管中。反应前,利用5% H2/Ar(40 mL/min)在600 ℃下在线还原催化剂1 h。采用微量液体泵(Series III type)精确控制控制乙醇先进入210 ℃的汽化室中充分汽化,然后和CO2与N2充分混合(N2作为内标气和稀释气)。n(乙醇)∶n(CO2)∶n(N2)为1∶1∶2,反应物空速为20 000 mL·g-1·h-1。反应后出口处的混合气采用配备TCD和FID检测器的气相色谱仪在线分析。H2、CO和CO2通过HayeSep D色谱柱检测,乙醇、丙酮和甲烷通过INNOWAX色谱柱检测。
乙醇转化率:

(1)
出口气中产物i选择性:
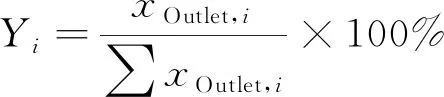
(2)
式(1)和(2)中:F表示乙醇进出口的摩尔浓度;xOutlet,i代表出口气中产物i的摩尔浓度 (i包括氢气、一氧化碳、丙酮和甲烷)。
2 结果与讨论
2.1 催化剂物理化学性质表征
2.1.1 ICP及N2吸脱附分析
经ICP-OES测试,所制备的2个Ni基催化剂的活性组分Ni实际担载量相似(约14%),接近于理论值。如表1所示,Ce改性KIT-6的比表面积、孔体积以及平均孔径均与KIT-6类似,表明Ce掺杂均匀地分布在KIT-6中,并未导致其规整结构的明显变化。但负载活性金属Ni后,催化剂比表面积显著降低,是因为部分Ni组分进入载体孔道中,导致部分孔道堵塞。这也与观察到的孔体积减少相一致。
2.1.2 XRD表征
图1是制备的Ni基催化剂的XRD谱图。

表1 催化剂物理化学性质Table 1 Physical and chemical properties of catalysts

图1 Ni/Ce-KIT-6和 Ni/KIT-6催化剂的XRD谱图Fig.1 XRD spectrum of Ni/Ce-KIT-6 and Ni/KIT-6 catalysts
由图1可见2种催化剂均可观察到NiO的特征衍射峰,分别对应于(111)、(200)和(220)晶面(PDF#71-1179)[13]。这表明大部分活性组分Ni以NiO的形式分散在载体表面。通过Scherrer公式计算Ni/KIT-6催化剂的NiO颗粒平均粒径约11 nm,而Ce改性后的Ni/Ce-KIT-6样品平均粒径为9 nm。这表明助剂Ce与Ni的协同作用抑制了活性金属Ni在焙烧过程中的团聚,使其分散度得到增加。活性组分的高分散度有利于提高催化剂的性能。Ni/Ce-KIT-6的谱图没有观察到Ce物种的衍射峰,可能由于大部分Ce组分掺杂到KIT-6的骨架中,少量Ce物种在载体表面高度分散,晶粒尺寸低于XRD检测限度。Ce掺杂后的衍射峰强度略低于未掺杂催化剂,是由于助剂Ce的引入导致KIT-6载体的有序度降低,进一步证实了Ce成功掺杂进KIT-6载体的骨架中。
2.1.3 H2-TPR表征
Ni/KIT-6和Ni/Ce-KIT-6催化剂的H2-TPR谱图见图2。

图2 Ni基催化剂的H2-TPR谱图Fig.2 H2-TPR spectrum of Ni-based catalyst
由图2可知,Ni/KIT-6催化剂在349和555 ℃处有2个明显的还原峰。其中低温区的还原峰归属为与NiO小颗粒的还原,而555 ℃处的峰对应于大颗粒的与载体相互作用较弱的体相NiO还原[14]。与Ni/KIT-6催化剂相比,Ni/Ce-KIT-6的还原峰向低温区域偏移,表明Ce助剂的掺杂,有利于提高Ni物种的还原能力。助剂Ce与Ni组分之间的相互作用,增大NiO颗粒表面的电子浓度,促进其还原,与前期文献报道相一致[15]。Ni/Ce-KIT-6的较低还原温度也与其较小的NiO颗粒粒径有关(如XRD结果讨论),团聚颗粒内部的金属氧化物还原难度较大。催化剂的低温还原性有利于在较低温度下即可获得金属活性位,避免高温还原环境下的金属组分烧结,提高其催化活性和稳定性。
2.1.4 SEM表征
Ni催化剂的SEM结果如图3所示,用来考察催化剂的形貌结构。可以看出催化剂颗粒呈现较为规整的球状形貌,粒径约为1~2 μm,这表明CeO2的掺杂没有导致KIT-6的结构坍塌。在载体KIT-6小球表面还观察到团聚的白色NiO颗粒。然而Ni/Ce-KIT-6表面的NiO颗粒明显减少,进一步证明Ce助剂可以有效提高活性金属Ni的分散度,抑制其焙烧过程中的烧结,与上述XRD讨论的结果相对应。

图3 催化剂的SEM谱图Fig.3 SEM images of catalysts
2.2 催化剂性能分析
2.2.1 温度对催化剂性能的影响
图4给出了反应温度对乙醇干气重整反应物的转化率和产物选择性的影响趋势图。

图4 反应物转化率a)和产物选择性b)和c)随反应温度的变化Fig.4 Effect of reaction temperature on reactant conversion (a) and product selectivity (b), (c)for ethanol dry reforming over Ni-based catalysts
从图4中可以看到,乙醇和CO2的转化率均随着反应温度的升高而增加。相比于Ni/KIT-6催化剂,掺杂Ce的催化剂表现出更优异的催化性能,更高的反应物转化率,在500 ℃时,乙醇达到完全转化。可能是由于助剂Ce的加入增强了活性金属Ni与载体间的相互作用,提高其分散度,有利于C—C以及C—H键的断裂,从而提高催化剂的活性[16]。同时CeO2中的氧缺陷位也有助于反应物CO2的吸附活化,产生CO和活性氧原子,有利于催化性能的提高[17-18]。对于CO2转化率,2样品在低温区均出现负值的情况,这表明在低温区间CO2的转化程度较小,即乙醇产生的CO2浓度高于CO2转化量。
Ni/Ce-KIT-6催化剂的出口尾气中,副产物甲烷的摩尔浓度较低,表明Ce的存在提高了甲烷干气重整反应(CH4+CO2→2CO+2H2),降低甲烷选择性,促进CO2的转化和合成气的生成。同时活性组分Ni与Ce的相互协同作用,提高催化剂的C—C键断裂能力,加快另一副产物丙酮的转化,减少其选择性[如图4c)所示],在450 ℃时,Ni/Ce-KIT-6催化剂的丙酮选择性为0。
2.2.2 催化剂稳定性分析
高效优异催化剂的筛选一方面要考虑其反应活性和选择性,另一方面也需着重考察其反应稳定性,这也是催化剂能否大规模工业化应用的重要指标之一。因此进一步考察了Ni基催化剂的乙醇干气重整反应稳定性。图5给出了乙醇转化率和H2、CO以及CH4在出口尾气摩尔浓度随反应时间的变化趋势。在化学计量比条件下反应30 h后,未掺杂的Ni/KIT-6催化剂的乙醇转化率开始降低,进一步反应至60 h后,乙醇转化率降至84%。同时副产物甲烷选择性也有所升高,目标产物H2和CO的选择性下降。这表明催化剂出现失活现象。在相同反应气氛下,Ni/Ce-KIT-6催化剂的乙醇转化率始终维持在100%,各主要产物的摩尔浓度也在测试时间段内无明显波动。结果表明掺杂型催化剂具有较高的反应稳定性和良好的工业应用前景。Ni/Ce-KIT-6催化剂的优异催化性能与助剂CeO2的氧存储能力和CO2分子活化能力以及载体与活性组分Ni之间的强相互作用有关。CeO2中的晶格氧可参与乙醇干气重整反应中,并且反应物CO2能够动态补充消耗的晶格氧[CO2→CO+O (lat)]。
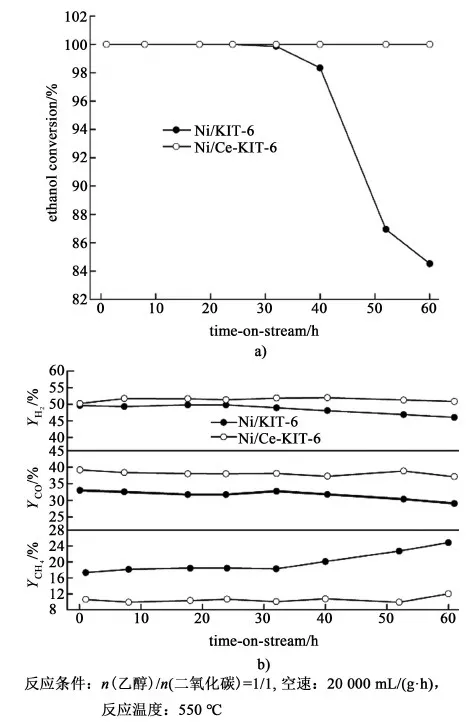
图5 反应物转化率a)和产物选择性b)随反应时间的变化Fig.5 The effect of the reaction time on reactant conversion a) and product selectivity b) for ethanol dry reforming over Ni-based catalyst
2.3 反应后催化剂表征
为了进一步研究稳定性反应后Ni基催化剂的形貌结构的变化以及催化剂表面的积碳,对反应后的催化剂进行了Raman和TEM表征,以便于探讨催化剂稳定性差异的具体原因。
2.3.1 Raman表征
拉曼光谱有助于分析催化剂表面的积碳类型。如图6所示,对于Ni/Ce-KIT-6和Ni/KIT-6催化剂,在1 349和1 590 cm-1处均有2个积碳峰。前者属于无定型碳的振动峰,称为D峰,后者是石墨碳所引起的振动峰,称为G峰[19]。其中石墨型积炭比较难以去除,对催化剂活性影响较大,易导致催化剂失活;而无定型碳易氧化去除,因此对催化剂活性中心位的毒害作用较小[20]。通常利用2峰的面积之比IG/ID来比较催化剂表面积碳的石墨化程度。计算得出Ni/KIT-6催化剂的IG/ID=0.64,而Ni/Ce-KIT-6催化剂IG/ID=0.59。这表明Ni/KIT-6催化剂表面的石墨型积碳较多,这可能是导致其失活的主要原因。另外,从图6中可以看出Ni/Ce-KIT-6催化剂的D峰与G峰强度均明显小于Ni/KIT-6催化剂,说明掺杂型催化剂表面上积碳更少。这也解释了该催化剂表现出的良好稳定性。CeO2的掺杂提高了活性组分Ni的分散度,从而增强催化剂的C—C键活化能力,以及CeO2助剂的氧存储能力是抑制Ni/Ce-KIT-6催化剂表面积碳的主要原因。

图6 稳定性反应后Ni/Ce-KIT-6和Ni/KIT-6催化剂的Raman谱图Fig.6 Raman spectrum of the spent catalysts of Ni/Ce-KIT-6 and Ni/KIT-6
2.3.2 TEM表征
图7为反应后催化剂的透射电镜图。反应后的Ni/KIT-6催化剂有明显积碳生成。不仅观察到大量的纤维状碳,而且在催化剂表面包裹一层积碳,使催化剂活性位无法与反应物接触,从而导致催化剂失活。而掺杂Ce的Ni/Ce-KIT-6催化剂在反应60 h后未观察到明显积碳的生成,活性位仍然暴露在外部催化转化反应物分子,保持催化剂的活性。这可能是因为载体与活性金属Ni物种之间的强相互作用和CeO2储氧能力有利于催化剂表面积碳的气化消除。消碳机理可能是CO2在CeO2的氧缺陷位吸附活化,产生活性氧物种,可以有效氧化反应过程中产生的积碳,从而实现积碳的动态去除;这也与SONG课题组的报道[21]相一致。XRD表征结果表明,助剂Ce的加入能够抑制活性组分Ni的烧结,从而保证载体与活性金属间的有效接触界面,有利于活化CO2分子并进一步去除积碳,保持催化剂的良好稳定性。同时Ni/Ce-KIT-6催化剂中的较小粒径Ni 物种能够增强催化剂的C—C键断裂能力,抑制含碳副产物(乙醛、丙酮)的生成,有利于降低积碳的产生。

图7 稳定性反应后催化剂的TEM图: a), b)Ni/KIT-6;c), d)Ni/Ce-KIT-6Fig.7 TEM images of spent catalysts: a), b)Ni/KIT-6;c), d)Ni/Ce-KIT-6
3 结论
利用甲醇辅助浸渍法合成的掺杂型Ni/Ce-KIT-6催化剂在乙醇干气重整反应中表现出良好的催化性能。表征结果表明助剂Ce的加入不仅能够有效抑制活性金属Ni的烧结,提高其分散度,而且增强载体与活性组分间的相互作用。在化学计量比条件下,550 ℃反应60 h后,未掺杂的Ni/KIT-6催化剂出现严重失活现象,乙醇转化率从100%降至84%,甲烷选择性升高伴随着目标产物合成气的选择性降低。而Ni/Ce-KIT-6催化剂表现出良好的稳定性,乙醇转化率及产物选择性均无明显波动,具有一定的工业应用前景。Ni/Ce-KIT-6催化剂中的较小粒径Ni组分对C—C键的有效活化作用,以及助剂CeO2的氧存储能力是抑制积碳、保持催化剂稳定性的主要原因。
——会偷偷侵蚀你的发动机!

