携载miRNA-124 纳米粒子经鼻吸入对缺血性脑卒中模型大鼠的神经保护作用
郝如彬, 王浩天, 杨丽华, 马 春, 李淑玲, 李欣欣, 李铁术
(1.长春中医药大学中医学院中医内科学教研室,吉林 长春 130117;2.吉林大学药学院生物药学系微生物与生化药学教研室,吉林 长春 130021;3.长春中医药大学附属医院老年病研究所,吉林 长春 130021;4.长春中医药大学附属医院老年病科,吉林 长春 130021)
大脑中动脉阻塞可导致大面积脑梗死和扩大性脑水肿,引起脑卒中,脑卒中是目前全球临床死亡的第二大原因[1]。发生脑梗死后,缺血半影区内的神经细胞在短暂的时间内具有功能恢复的潜在可能性[2]。微小RNA (micro RNA,miRNA) 是一种短序列的具有特异性调控功能的单链RNA[3],其中miRNA-124 是发育成熟的中枢神经系统(central nervous system, CNS) 中表达最丰富的miRNAs 之一[4],与神经元的分化、成熟和存活有密切关联。 神经系统疾病的临床研究[5]显示:miRNA-124 常用作脑卒中后神经保护和功能恢复,而且miRNA-124 在神经系统抗炎中起重要作用[6],miRNA-124 是目前报道最多的具有神经保护和恢复功能的miRNA。为了使药物顺利穿过血脑屏障到达脑部,本课题组采用了经鼻吸入给药的方式,以神经通道绕过血脑屏障,并采用聚乙二醇-聚乳酸-羟基乙酸共聚物[poly (ethyleme glycol) -poly(lactic-co-glycolic acid),PEG-PLGA] 纳米粒子包载药物防止水解,采用RVG29 修饰增强该药物的神经靶向性。目前尚无关于RVG29 修饰纳米粒子进行经鼻吸入给药的方式递送miRNA 干预脑卒中的报道。
本 研 究 采 用RVG29 修 饰 纳 米 粒 子[7]包 载miRNA,加强了其对鼻黏膜中嗅神经和三叉神经的靶向能力,使药物更易在神经组织附近富集,最终评价鼻吸入miRNA-124 对缺血性脑卒中大鼠动物模型的神经保护作用。
1 材料与方法
1.1实验动物、主要试剂和仪器90 只成年SD 大鼠, 雌 雄 各 半, 12~15 周 龄、 体 质 量 为250~300 g,购于辽宁长生生物科技有限公司,动物生产许可证号:SCXK (辽) 2015-0001。饲养于吉林大学药学院动物中心,恒温(23±2) ℃,相对湿度(54±2) %,暗/光循环12 h,可自由饮水和进食,适应性喂养1 周。
马来酰亚胺-聚乙二醇-聚乳酸羟基乙酸共聚物[(maleimide-poly (ethylene glycol) -poly (lacticco-glycolic acid),Mal-PEG-PLGA],单甲氧基聚乙二醇-聚乳酸聚乙醇酸(monomethoxypolyethylene glycol polylactic polyglycolic acid, MePEG-PLGA)和PLGA (济南岱罡生物工程有限公司),亚精胺和1,1'-双十八烷基-3,3,3,3-四 甲 基 吲 哚 三碳花菁碘化物(DiR)(美国西格玛公司),RVG29-Cyspeptide 和PEG-PLGA-maleimide (Mal-PEG-PLGA,相对分子质量为5 000~20 000)(吉林省新近纪生物科技有限公司),miRNA-124 (上海吉玛公司),局灶性大脑中动脉缺血再灌注损伤(middle cerebral artery occlusion , MCAO), 栓线(北京西浓科技有限公司),水合氯醛(天津市福晨化学试剂厂),盐酸法舒地尔注射液(天津红日药业股份有限公司),白细胞介素1β (interleukin-1β,IL-1β)、 肿 瘤 坏 死 因 子α (tumor necrosis factor-α,TNF-α)、白细胞介素6 (interleukin-1β,IL-6) 和白细胞介素4 (interleukin-4,IL-4) ELISA 试剂盒(美国Peprotech 公司)。Zetasizer 3000 (英国马尔文仪器公司),TEM H-7650 透射电子显微镜(日本日立公司),低温离心机(德国Eppendorf 公司),去离子水仪(美国PALL 公司), 高速离心机(德国Eppendorf 公司)。 本研究中实验方法经吉林大学和长春中医药大学动物伦理审查委员会批准。
1.2 RVG29修饰的PEG-PLGA纳米粒子的制备采用复乳法制备携载miRNA-124 的PEG-PLGA 纳米粒子。miRNA-124 与亚精胺在无RNase 的水中以10∶1 比例混合形成复合物。将18 mg PLGA 和2 mg 马来酰亚胺PEG-PLGA 分别溶解于2 mL 二氯甲烷(dichloromethane, DCM) 中, 然后将亚精胺和miRNA-124 形成的络合物加入上述DCM 溶液中,超声60 s 形成乳液。将乳液加入20 mL 体积比为2.5% 的PVA 水溶液中继续搅拌,旋转蒸发除去有机溶剂。采用21 000 g 离心浓缩45 min,采用去离子水洗涤3 次。利用马来酰亚胺-硫醇相互作用将RVG29 肽偶联到纳米粒子表面。 将过量RVG29 肽孵育8 h,离心(12 000 g、15 min) 去除未反应的肽。 采用同样的步骤制备不含miRNA-124 的空白纳米粒子。去除DiR 标记的纳米粒子是通过向油相中加入DiR 生成的,其余制备过程与上述相同。 采用Quant-iT ™RiboGreen kit 试剂盒测定纳米粒子的包封率,利用动态光散射(dynamic light scattering,DLS) 测量纳米粒子的粒径和zeta电位。采用透射电镜观察纳米粒子形态表现。
1.3纳米粒子经鼻吸入脑后的生物分布对比RVG29 修饰的PEG-PLGA 纳米粒子和非RVG29修饰的PEG-PLGA 纳米粒子在大鼠体内的生物分布, 向大鼠施用载有近红外染料DiR 的RVG29-PEG-PLGA 和PEG-PLGA 纳米粒子,分别通过经鼻吸入给药的方式进行大鼠滴鼻给药,左右鼻孔轮流滴入,每个鼻孔滴入5 μL。分别在给药后0.5、2.0、4.0 和6.0 h 测定大鼠脑组织中DiR 值并进行可视化处理, 其中荧光强度单位为ng (荧光物质)·g-1(脑组织)[10]。
1.4缺血性脑卒中大鼠模型的建立采用改良Zea-Longa 线栓法建立MCAO 大鼠模型。大鼠腹腔注射10% 水合氯醛麻醉后,仰卧位固定,术野局部消毒,纵切颈部右侧皮肤,暴露右侧颈总动脉(common carotid artery, CCA)、 颈 外 动 脉(external carotid artery, ECA) 和 颈 内 动 脉(internal carotid artery, ICA),暂时夹住ECA 和ICA, ECA 结扎离断, 在ECA 近心端剪血管1/4大小的切口,采用4-0 单丝尼龙拴线从ECA 插入ICA,并由ICA 腔缓慢进入颅内,栓线进入长度距ICA 和ECA 的分叉处1.8~2.0 cm,阻断大脑中动脉,缝合,维持体温直至大鼠苏醒。2 h 后,抽出MCAO 栓线进行脑缺血再灌注, 完成MCAO 造模。假手术组大鼠仅暴露ICA 和ECA 分支[8]。
1.5动物实验分组和给药方式各组动物造模前均进行药物干预。分为假手术组、模型组、法舒地尔组、miRNA-124 经鼻吸入给药组、PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEGPLGA/miRNA-124 经 鼻 吸 入 给 药 组, 每 组6 只。每组在建模前第7 天、第5 天和第3 天,法舒地尔组大鼠腹腔注射5 mg·kg-1·d-1法舒地尔,共3 次;各类经鼻吸入给药的方式为大鼠滴鼻给药,左右鼻孔轮流滴入相应药物,每个鼻孔滴入5 μL 。最后一次给药1 h 后,采用线栓法制备局灶性脑缺血再灌注大鼠模型,所有大鼠造模后24 h,麻醉取材。所有程序均符合有关动物伦理道德规范。
1.6各组大鼠神经功能障碍评分检测再灌注24 h 后,参 照Zea-Longa 5 级4 分 法[5]进 行 神 经 功能评分。评分标准:0 分,无显著神经功能缺损;1 分,提尾时,病灶对侧前肢不能完全伸展;2 分,向缺血对侧转圈;3 分,向对侧倾倒;4 分,无自主运动或意识障碍。神经功能评分1~3 分视为造模成功的大鼠模型,纳入本研究中。
1.7各组大鼠脑组织含水量测定大鼠开颅取脑组织后,生理盐水冲洗干净,滤纸吸干表面水分,准确称质量并计为湿质量,然后将脑组织置于恒温干燥箱烘干,并准确称取脑组织计为干质量,脑组织含水量= (湿质量-干质量) /湿质量×100%。
1.8 ELISA法检测各组大鼠血清中TNF- α、IL-1β、IL-4和IL-6水平各组大鼠麻醉取脑前,先采集腹主动脉血液样本[12], 室温下静置30 min,4 ℃离心,收集上清液,采用ELISA 技术测定上清液中TNF-α、IL-1β、IL-4 和IL-6 水平,操作过程严格参照ELISA 试剂盒说明书[13]进行。
1.9统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组大鼠神经功能障碍评分、脑组织含水量和血清中TNF-α、IL-1β、IL-4 及IL-6 水平均符合正态分布,以x±s表示,多组间比较采用单因素方差分析,方差检验齐性时组间比较采用LSD-t法,方差检验不齐时组间比较采用Dunnett’s T3 法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 RVG29-PEG-PLGA纳米粒子的表征RVG29-PEG-PLGA 纳米粒子的平均粒径为204 nm, 以miRNA-124 计微小RNA 的包封率为28.2%。透射电镜下可以观察到纳米粒子的整体形态均匀,偏近圆形。见图1。

图1 透射电镜观察RVG29-PEG-PLGA 纳米粒子形态表现(Bar=1 μm)Fig.1 Morphology of RVG29-PEG-PLGA nanoparticles observed with transmission electron microscope (Bar=1 μm)
2.2纳米粒子经鼻吸入脑后的生物分布鼻内给药纳米粒子后,大脑的嗅球、皮质区、纹状体、中脑、海马、小脑和脑干中纳米粒子的蓄积在时间和空间上都有很大不同:在所分析的所有脑区域中,纳米粒子给药后30 min,嗅球、皮质区、纹状体、中脑、海马、小脑和脑干中均有较强的药物蓄积。2 h 后,除皮质区外,海马、脑干和小脑等区域中RVG29 修饰的纳米粒子均显示了更强的药物蓄积和递送能力。4 和6 h 后,脑干中RVG29 修饰的纳米粒子的蓄积持续较非RVG29 修饰的纳米粒子递送能力更强。可视化数据图谱中,RVG29 修饰组所有脑区域中有效负载药物浓度高于非修饰组。核酸药物浓度在进行经鼻吸入递药后趋于降低或可大致维持4 h,RVG29 显示了较强的靶向作用,尤其是针对脑干的有效递送。见图2 (插页六)。
2.3各组大鼠神经功能评分假手术组大鼠无神经功能障碍;与假手术组比较,模型组大鼠神经学评分明显升高(P<0.05)。与模型组比较,法舒地 尔 组、 miRNA-124 经 鼻 吸 入 给 药 组 、PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠神经学评分降低(P<0.05)。与法舒地尔组比较, RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠神经学评分降低(P<0.05)。见图3。

图3 各组大鼠神经功能评分Fig.3 Neurological function scores of rats in various groups
2.4各组大鼠脑组织含水量与假手术组比较,模型组大鼠脑组织含水量明显升高(P<0.05)。与模型组比较,法舒地尔组、miRNA-124 经鼻吸入给药组、PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠脑组织含水量降低(P<0.05)。与法舒地尔组比较, RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠脑组织含水量降低(P<0.05)。见图4。

图4 各组大鼠脑组织含水量Fig.4 Water contents in brain tissue of rats in various groups
2.5各组大鼠血清中TNF-α、IL-1β、IL-6和IL-4水平与假手术组比较,模型组大鼠血清中IL-4、IL-6、 TNF-α 和IL-1β 水平明显升高(P<0.05)。与模型组比较,法舒地尔组、miRNA-124 经鼻吸入给药组、PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药 组大鼠 血清中IL-4、IL-6、TNF-α 和IL-1β 水平明显降低(P<0.05)。 与法舒地尔组比较,RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠血清中IL-4、IL-6、TNF-α 和IL-1β 水平明显降低(P<0.05)。见表1。
3 讨 论
在受到包括肠胃代谢和肝脏分解等首过效应和血脑屏障的生物学作用后,miRNA-124 保护神经的药效学作用大幅降低,使得miRNA 等药物达到受损神经元部位的效力降低。核酸药物易被蛋白酶类分解,因此本课题组结合纳米药物载体技术,将miRNA-124 进行包载以减少非靶向组织对药物的降解和破坏,并选用非侵入性的鼻内给药方式[9],提高药物的脑靶向性和减少全身的不良反应。目前常用的纳米药物载体有慢病毒载体和合成聚合物载体,考虑到病毒载体有一定的不良反应,且靶向修饰相对困难,因此本课题组选择人工合成的PEGPLGA 为 载 体, 该 载 体 合 成 简 单, 大 小 可 控[10],免疫原性低容易修饰[11]并保存,生物相容性好[12]且可重复性高[13]。如果能顺利完成miRNA-124 的脑内递送,则将有可能极大提升未来临床干预脑部疾病用药的可行性。由于血脑屏障的存在,类似于miRNA-124 的核酸药物经口服或者静脉给药来干预中枢神经系统疾病受到限制,生物利用度降低。将药物直接脑内注射操作不便,也易给患者造成心理和生理上的痛苦。经鼻吸入脑的主要路经是纳米药物通过鼻黏膜以及鼻上皮细胞,到达嗅神经和三叉神经附近,沿着神经通道,转运至脑部[15],从而解决了血脑屏障对药物递送的屏蔽作用。因此经鼻吸入给药最大的优势是具有可以绕过血脑屏障,同时兼具无创给药,药物利用度高和全身不良反应少的优势[14]。
由于鼻纤毛的清除运动,使裸露的miRNA 容易被清除,且裸露的miRNA 在黏液中不稳定容易被降解。因此,本课题组选用PEG-PLGA 这种具有较低生物毒性和良好生物相容性的纳米载药平台[16]进行药物包载,减少药物在组织传递过程中被降解,增强药物在黏膜中的转运效率。考虑到药物在鼻黏膜中对神经的靶向性弱,因此对纳米药物采用RVG29 进行修饰,RVG29 是基于狂犬病病毒糖蛋白中提取的有29 个氨基酸序列的嗜神经性病毒衍生肽,有报道[17]显示RVG29 来源于修饰静脉递送药物从而提高脑靶向性,但药物从循环系统进入 脑 需 要 经 过 血 脑 屏 障[18], 虽 然 报 道[19]显 示RVG29 修饰后均增加药物在脑组织中的蓄积,但是通过经鼻吸入给药直接避开血脑屏障的给药方式效率可能更高。因为目前尚无通过RVG29 介导经鼻吸入给药的体内药效学作用研究。所以本研究在该基础上考察了RVG29 修饰后的PEG-PLGA 纳米粒子[19]在大鼠脑组织中的生物分布和大鼠MCAO缺血性脑卒中的药效学作用,纳米粒子经鼻吸入脑组织后的生物分布结果表明:通过RVG29 修饰的纳米药物可以更多地积累在脑组织中, 证明RVG29 修饰的纳米粒子有更强的药物蓄积和递送能力。
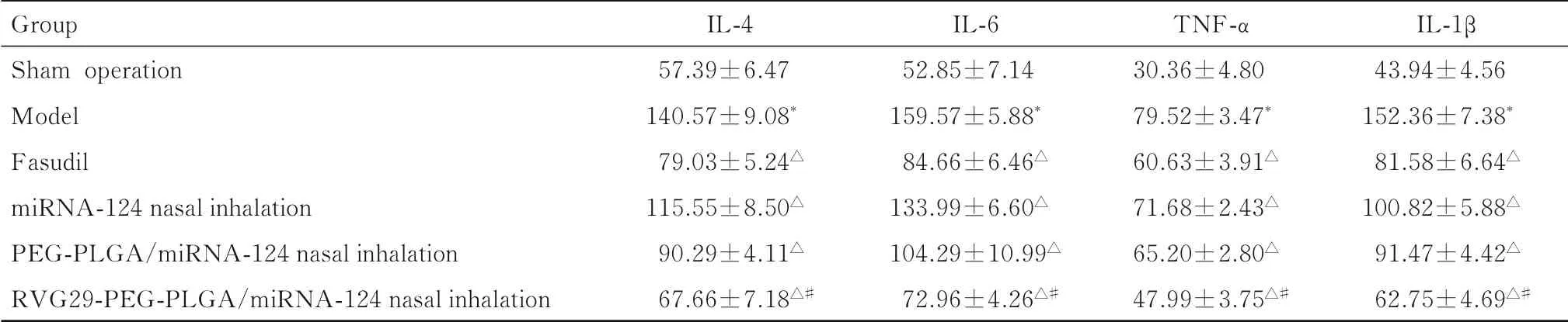
表1 各组大鼠血清中TNF-α、IL-1β、IL-6 和IL-4 水平Tab.1 Levels of serum TNF- α, IL-1, IL-6, and IL-4 of rats in various groups [n=6,x±s,ρB /(ng·L-1)]
本研究结果显示:模型组大鼠的神经功能评分明显高于假手术组,在不同时间采用药物干预的各组大鼠神经功能评分均较模型组明显降低,表明miRNA-124 在改善神经功能方面有积极作用。有无RVG29 修饰的纳米粒子在大鼠脑内的分布图可以清晰地看出RVG29 在药物靶向中的作用,RVG29 可有效地持续药物作用,使之停留并蓄积于脑干,尤其是给药后的6 h 内,RVG29 均保持了优异的经鼻吸入脑能力,未来将其开发成适宜的纳米粒子靶向物可能为临床用药提供一种全新的选择。
脑水肿是液体在脑组织中的病理性聚积,是局部脑梗死后的形态表现改变之一,脑缺血后脑组织含水量升高,脑水肿规律与神经功能缺损的严重程度一致[20],本研究结果显示:假手术组大鼠脑组织含水量高于模型组。与模型组比较,法舒地尔组、 miRNA-124 经鼻吸入给药组、 PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEGPLGA/miRNA-124 经鼻吸入给药组大鼠脑组织含水量降低, 且以RVG29-PEG-PLGA/miRNA-124经鼻吸入给药组效果最明显。
发生脑缺血后,脑组织中会出现免疫炎性反应,巨噬细胞在脑缺血再灌注损伤中发挥重要作用[21],巨噬细胞会根据不同的环境变化反应而分化为不同的类型[22],巨噬细胞释放的血清炎症因子水平可在一定程度上反映早期卒中严重度及预后[23]。其中TNF-α、IL-1β 和IL-6 与M1 型巨噬细胞活性有关联[24],IL-4 与M2 型巨噬细胞活性有关联[25]。炎症的发生会促进组织内平衡的恢复,但急性炎症也会加重缺血性损伤[26]。本研究结果显示: 与对照组比较, 模型组大鼠血清中IL-4、TNF-α、IL-1β 和IL-6 水平均明显升高;与模型组比较, 法舒地尔组、 miR-124 经鼻吸入给药组、PEG-PLGA/miRNA-124 经鼻吸入给药组和RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组大鼠血清中IL-4、TNF-α、IL-1β 和IL-6 水平降低,且以RVG29-PEG-PLGA/miRNA-124 经鼻吸入给药组效果最明显。
本研究结果显示: 脑损伤后TNF-α、 IL-1β、IL-6、IL-4 和M1 型相关的促炎因子水平升高,用药后其水平降低, 确实起到了抑制炎症的作用。IL-4 不但可以刺激活化B 细胞和T 细胞增殖,促进炎性反应,也可以诱导M2a 型巨噬细胞产生白细介素10 (interleukin-10, IL-10)、 趋化因子配体3(CCL13、) 趋化因子配体17 (CCL17) 和趋化因子配体22 (CCL22) 等抑炎及组织修复因子[27],可以保护大脑免受急性缺血性损伤,起到抗炎的作用;大鼠脑损伤后外周血中IL-4 水平升高,用药后IL-4 水平降低,IL-4 的这种表现考虑为脑损伤前期,IL-4 主要表现为与促进炎症反应有关联。
综上所述,RVG29 修饰后的纳米粒子有更好的脑内分布作用,其能更长久地蓄积核酸到脑干中,RVG29-PEG-PLGA 纳米粒子展示了较好的鼻吸入脑递送能力,其携载的miRNA-124 对大鼠缺血性脑卒中有保护作用, 并且携载递送miRNA-124 还改善了脑缺血大鼠神经功能、脑水肿情况及炎症因子TNF-α、 IL-1β、 IL-4、 IL-6 的释放,发挥对脑缺血再灌注损伤的保护作用。

