亚麻籽油对小鼠免疫功能的影响
黄 莉,闫 实,孙晓璐,曹昕汝,殷永超,董和亮,王 欢,赵 燕
(东北农业大学 食品学院,哈尔滨 150028)
亚麻籽油中α-亚麻酸含量高达40%以上,还含有丰富的营养成分如维生素E、甾醇等[1-3]。研究表明,亚麻酸在治疗心血管疾病、糖尿病等多种疾病方面具有显著的疗效[4]。动物试验表明,膳食中亚麻酸在极度或长期缺乏情况下,会出现视力障碍等一系列的症状,因此富含亚麻酸的亚麻籽油被誉为植物界的“深海鱼油”,具有很好的市场开发前景[5]。目前,一些发达国家已研制出以亚麻酸为主要原料的保健食品,我国尚处于对亚麻籽油制备工艺和营养成分研究的阶段[6-7]。
本文以小鼠为研究对象,依据《保健食品检验与评价技术规范》(卫生部2003版),采用碳廓清试验、迟发型变态反应、抗体生成细胞试验、巨噬细胞吞噬鸡红细胞试验、淋巴细胞转化试验和NK细胞活性测定等方法,研究分析亚麻籽油对小鼠免疫的影响,为全面利用和开发亚麻籽油提供科学依据,为开发功能保健食品提供借鉴。
1 材料与方法
1.1 试验材料
1.1.1 原料及动物
亚麻籽油(为浅黄色至黄色液体),山西五台山沙棘制品有限公司;一级大豆油,嘉里粮油(中国)有限公司。
清洁级ICR雌性小鼠200只(体重18~22 g,许可证号为SCXK(沪)2012-0002),上海莱斯克试验动物有限责任公司;饲料(许可证号为沪饲证(2014)04001),上海普路腾生物科技有限公司。
1.1.2 主要仪器
8 mm直径打孔器,微量血凝试验板,2-16K通用离心机,RT-6100酶标仪,96孔培养板,Co-150 CO2培养箱,UV-1800紫外可见分光光度计,OlympusIX71倒置显微镜,电子天平,显微镜。
1.1.3 主要试剂
注射用印度墨汁(75%),北京索莱宝有限公司;刀豆蛋白A(ConA),美国Sigma公司;噻唑蓝(MTT)、二硝基氟(代)苯(DNFB)、鸡红细胞(CRBC)、绵羊红细胞(SRBC),北京鼎国昌盛生物技术有限责任公司;吉姆萨染色液Giemsa(1∶9),南京森贝伽生物科技有限公司;淋巴瘤细胞(YAC-1),上海研生实业有限公司;Hanks氏病毒保存液(pH 7.2~7.4),上海博生物技术有限公司;RPMI 1640完全培养液,上海子起生物科技有限公司;碘硝基氯化四氮唑(INT),上海源叶生物科技有限公司;烟酰胺腺嘌呤二核苷酸(NAD),上海麦克林生化科技有限公司;吩嗪二甲酯硫酸盐(PMS),上海乙基化工有限公司;1%NP40裂解液,上海泽叶生物有限公司;台酚兰,普润斯生物科技有限公司; Tris-HCl缓冲液(pH 8.2)、1 mol/L盐酸、酸性异丙醇、丙酮、生理盐水、甲醇、乳酸锂,北京化工厂。
1.2 试验方法
1.2.1 受试样品的配制
称取亚麻籽油15 g,与大豆油混合均匀至100 mL,得到亚麻籽油质量浓度为0.15 g/mL的高剂量受试物;取高剂量受试物40 mL,与大豆油混合均匀至120 mL,得到亚麻籽油质量浓度为0.05 g/mL的中剂量受试物;取中剂量受试物40 mL,与大豆油混合均匀至80 mL,得到亚麻籽油质量浓度为0.025 g/mL的低剂量受试物。受试样品现用现配。
1.2.2 动物分组与给药
参照韩飞等[8]的方法,将200只小鼠随机分成5大组,再分成4小组(对照组,受试物高、中、低剂量组),每小组10只小鼠,分别进行抗体生成细胞、溶血素、脏器指数测定, NK细胞活性、淋巴细胞转化试验,迟发型变态反应(DTH)试验,小鼠碳廓清试验和小鼠腹腔巨噬细胞吞噬鸡红细胞试验。将小鼠在受控温度(20±2)℃、湿度(50±5)%、12 h光照下适应7 d,7 d 后小鼠自由摄食、摄水,每日上午10∶00按10 mL/(kg·d)连续给小鼠灌胃大豆油(对照组)和受试样品(亚麻籽油高、中、低剂量组)30 d。
1.2.3 体重及脏体比测定
按1.2.2在最后一次给药6 h后,称量小鼠体重,并取脾脏及胸腺,称重,计算胸腺指数和脾指数[9]。
1.2.4 细胞免疫功能测定
1.2.4.1 小鼠脾淋巴细胞转化试验
按1.2.2在最后一次给药6 h后,参照史顶聪等[10]的方法,颈椎脱臼法处死小鼠,无菌取脾,置于无菌的适量Hanks氏病毒保存液的小平皿中,用镊子轻轻将脾撕碎,过200目筛网,得到单细胞悬液。将上述细胞悬液经离心调整浓度为3×106个/mL。分两孔加入24孔培养板中,每孔1 mL,一孔加75 μL ConA液,另一孔为对照,不添加ConA液,培养72 h。培养68 h时,每孔吸去0.7 mL上清液,并加入同体积不含小牛血清的RPMI 1640培养液与50 μL的MTT,继续培养。培养结束后,分装于96孔培养板,3个平行孔,于570 nm处测定光密度值(OD)。
1.2.4.2 迟发型变态反应(DTH)试验
按1.2.2在最后一次给药6 h后,对小鼠腹部皮肤约3 cm×3 cm进行脱毛处理,用50 μL 1%的DNFB溶液涂抹均匀致敏,5 d后再以10 μL 1%的DNFB溶液均匀涂抹小鼠右耳,24 h后颈椎脱臼处死小鼠,剪下左右耳,用打孔器取下直径8 mm的耳片称重[11]。
1.2.5 体液免疫功能测定
1.2.5.1 抗体生成细胞检测
按1.2.2在最后一次给药6 h后,腹腔注射0.2 mL 2%的SRBC悬液。5 d后颈椎脱臼处死小鼠,取脾脏,经磨碎、过滤、离心、洗涤后悬浮于8 mL Hanks氏病毒保存液中。取25 μL脾细胞悬液、50 μL 10%SRBC、0.5 mL 0.5%的琼脂糖Hanks氏病毒保存液混合培养基迅速混匀,倾倒于6 cm已刷琼脂薄层的平皿上,于37℃ CO2培养箱中温育1.5 h,然后用SA缓冲液(1∶8)稀释补体,温育3 h后,计数溶血空斑数[12]。
1.2.5.2 血清溶血素测定
按1.2.2在最后一次给药6 h后,腹腔注射0.2 mL 2%的SRBC悬液。5 d后,将小鼠摘除眼球采血,2 000 r/min离心10 min分离血清,用生理盐水稀释不同倍数并置于微量血凝试验板内,每孔100 μL,加入同体积0.5%的SRBC悬液,混匀,37℃培养箱中温育3 h,观察血球凝集程度[13]。
1.2.6 单核-巨噬细胞功能测定
1.2.6.1 小鼠碳廓清试验
按1.2.2在最后一次给药6 h后,称小鼠体重,并静脉注入稀释的印度墨汁,2、10 min后,取内眦静脉血20 μL,并立即加入2 mL 0.1%Na2CO3溶液,以Na2CO3溶液为空白对照,在600 nm处测定光密度值(OD),将小鼠处死后,取出肝脏、脾脏后称重,计算吞噬指数[14]。
1.2.6.2 小鼠腹腔巨噬细胞吞噬鸡红细胞试验(半体内法)
按1.2.2在最后一次给药6 h后,给小鼠腹腔注射1 mL 20%鸡红细胞(CRBC)悬液。30 min后颈椎脱臼处死小鼠,固定在鼠板上剪开腹壁皮肤,经腹腔注入2 mL生理盐水,转动鼠板1 min。吸出1 mL腹腔洗液,滴于2片载玻片上,移置37℃培养箱中温育30 min。生理盐水漂洗、晾干、固定、染色、蒸馏水漂洗、晾干,在油镜下阅片计数,计算吞噬率和吞噬指数。
1.2.7 NK细胞活性测定
参照Cao等[15]的方法测定。
1.2.8 数据处理
试验数据以SPSS软件进行单因素方差分析。经方差齐性检验,方差齐的试验数据采用LSD法进行统计分析,方差不齐的试验数据采用Tamnane法进行统计分析。
2 结果与分析
2.1 亚麻籽油对小鼠体重的影响(见表1)
由表1可知,30 d灌胃试验结束后,与对照组比较,高、中、低剂量组小鼠的体重均无显著差异(P>0.05),说明亚麻籽油对小鼠体重无影响。
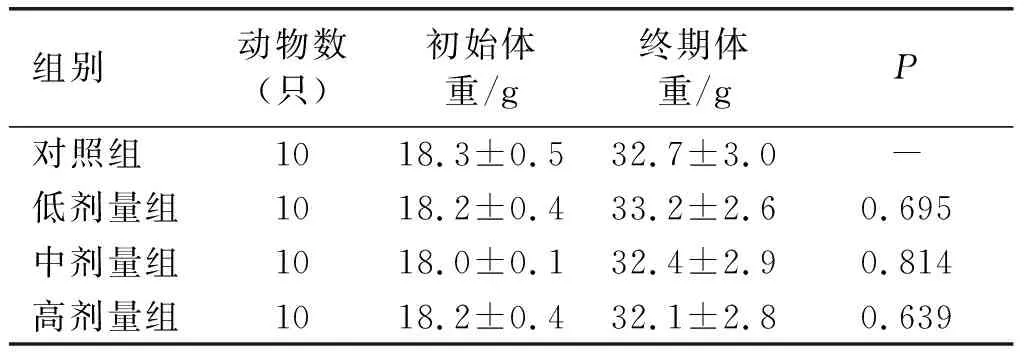
表1 亚麻籽油对小鼠体重的影响
2.2 亚麻籽油对小鼠脏体比的影响
脏体比是试验动物某脏器的质量与其体重的比值。正常时各脏器质量与体重的比值比较恒定,但当动物染毒后,受损脏器质量可能发生改变,从而引起脏体比的变化。表2为各剂量组胸腺指数、脾指数的测定结果。
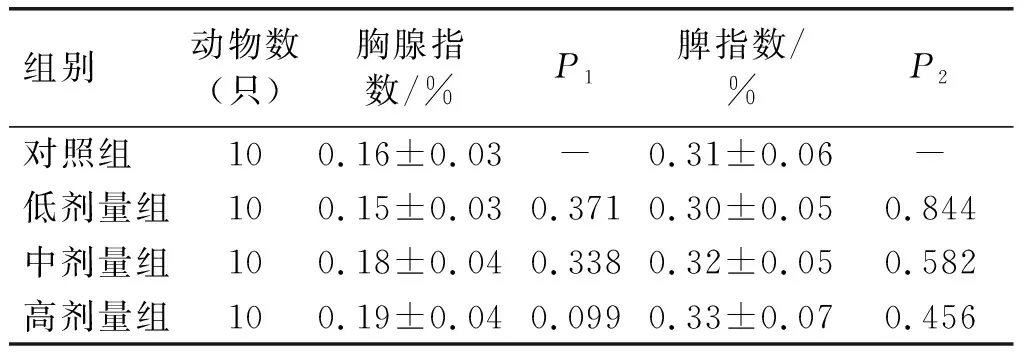
表2 亚麻籽油对小鼠胸腺指数、脾指数的影响
由表2可知,与对照组比较,高、中、低各剂量组的胸腺指数和脾指数均无显著差异(P>0.05),且波动数值均在小鼠脏体比的正常值范围内。说明亚麻籽油对小鼠的脏体比无影响。
2.3 亚麻籽油对小鼠细胞免疫功能的影响
表3为ConA诱导的小鼠淋巴细胞转化试验结果,表4为DTH试验结果。
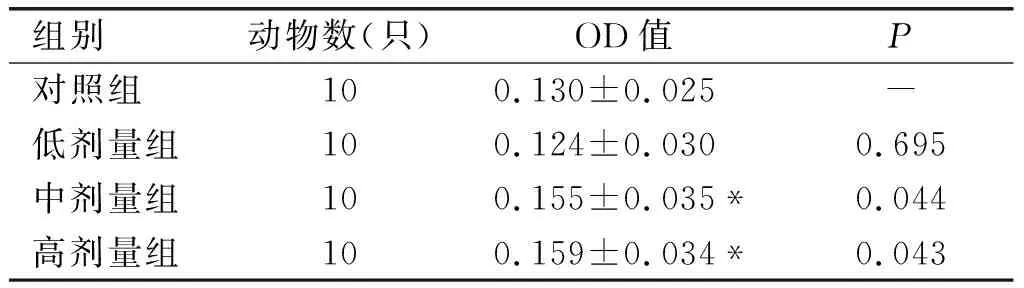
表3 ConA诱导的小鼠淋巴细胞转化试验结果
由表3可知,与对照组比较,低剂量组OD值差异不显著(P>0.05),而中剂量组与高剂量组OD值明显高于对照组,差异显著(P<0.05)。根据《保健食品检验与评价技术规范》(卫生部2003版)可知,亚麻籽油具有增强细胞免疫的功能。

表4 DTH试验结果
由表4可知,中剂量组与高剂量组小鼠左右耳质量差明显高于对照组,差异显著(P<0.05),而低剂量组与对照组相比差异不显著(P>0.05)。根据《保健食品检验与评价技术规范》(卫生部2003版)可知,亚麻籽油具有增强小鼠细胞免疫的功能。
2.4 亚麻籽油对小鼠体液免疫功能的影响
表5为血清溶血素试验结果,表6为抗体生成细胞试验结果。
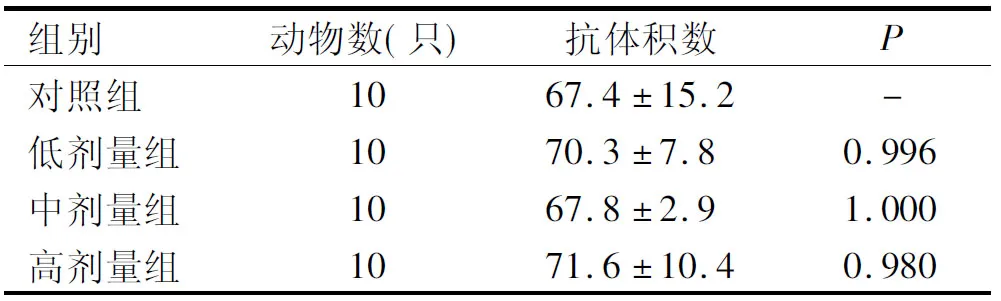
表5 血清溶血素试验结果
由表5可知,各剂量组小鼠抗体积数与对照组比较,差异均不显著(P>0.05)。
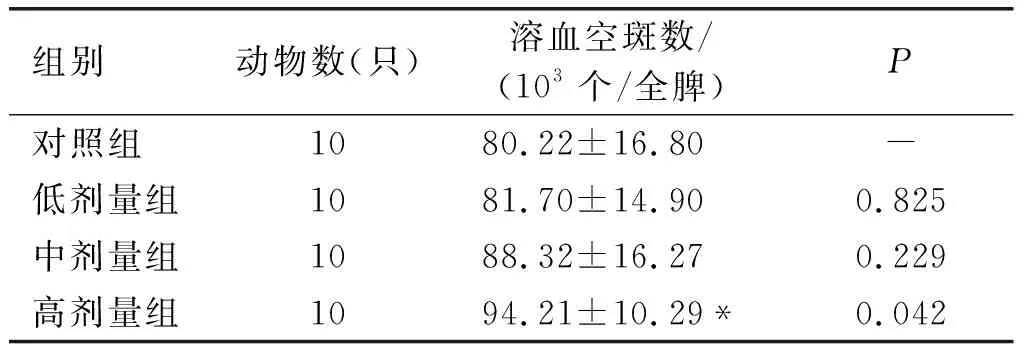
表6 抗体生成细胞试验结果
由表6可知,与对照组比较,高剂量组具有显著差异(P<0.05),中、低剂量组差异不显著(P>0.05)。根据《保健食品检验与评价技术规范》(卫生部2003版)可知,亚麻籽油不具有增强小鼠体液免疫的功能。
2.5 亚麻籽油对小鼠单核-巨噬细胞功能的影响
表7为碳廓清试验结果,表8为巨噬细胞吞噬鸡红细胞试验结果。由表7可知,高、中、低各剂量组小鼠碳廓清吞噬指数与对照组比较,差异均不显著(P>0.05)。
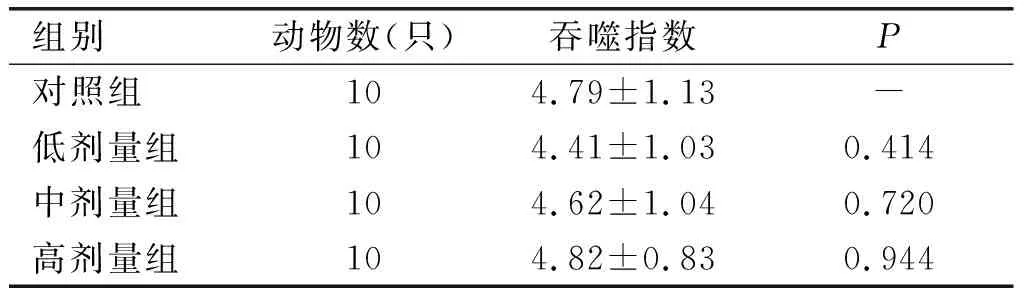
表7 碳廓清试验结果
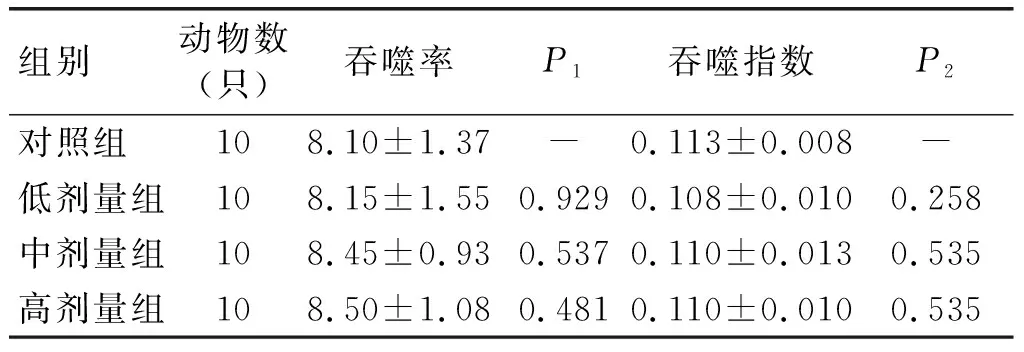
表8 巨噬细胞吞噬鸡红细胞试验结果
由表8可知,高、中、低各剂量组小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率、吞噬指数与对照组比较,差异均不显著(P>0.05)。说明亚麻籽油不能增强小鼠的单核-巨噬细胞功能。
2.6 亚麻籽油对小鼠NK细胞活性的影响(见表9)
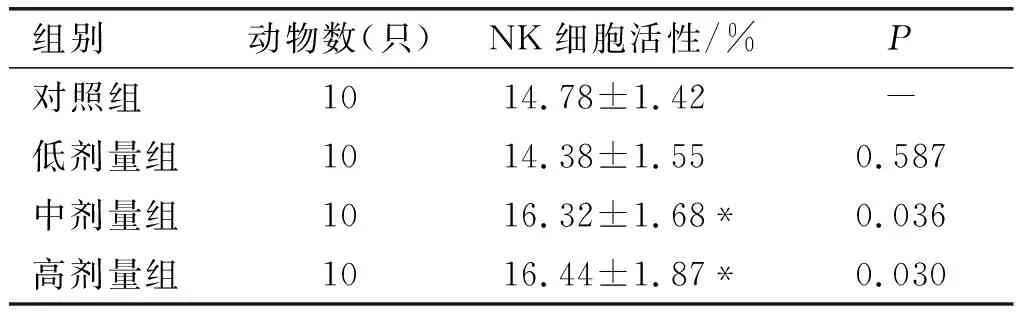
表9 NK细胞活性测定结果
由表9可知,中剂量组与高剂量组小鼠NK细胞活性显著高于对照组(P<0.05),而低剂量组与对照组比较差异不显著(P>0.05)。根据《保健食品检验与评价技术规范》(卫生部2003版)可知,亚麻籽油具有增强小鼠NK细胞活性的功能。
3 结 论
经30 d灌胃试验后,与对照组比较,亚麻籽油高、中、低各剂量组小鼠体重、胸腺指数、脾指数、小鼠血清溶血素水平、碳廓清能力、小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数均无统计学意义(P>0.05),而亚麻籽油中剂量组与高剂量组能够明显增强ConA诱导的小鼠脾淋巴细胞增殖能力和DNFB诱导的小鼠迟发型变态反应,能显著提升小鼠NK细胞活性。根据《保健食品检验与评价技术规范》(卫生部2003)的规定,说明亚麻籽油可增强小鼠的免疫功能,亚麻籽油可用于食品、保健食品提高免疫力等功能产品的开发和应用。

