一株具有抑菌活性地衣芽孢杆菌的鉴定
于秀菊 孙铮 韩小涛 李钰钰

摘 要:為了开发猪用微生态制剂,本试验对前期从吕梁黑猪肠道中筛选到的1株抑菌活性较强的菌株PB-2进行活化、抑菌活性检测、菌落形态观察和16S rDNA同源序列分析。结果显示分离纯化到的菌株PB-2对李斯特菌和金黄色葡萄球菌等革兰氏阳性菌具有显著的抑菌效果,菌株鉴定表明PB-2为地衣芽孢杆菌。
关键词:抑菌活性;地衣芽孢杆菌;16S rDNA
枯草芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌和凝结芽孢杆菌等有益芽孢杆菌是我国农业农村部认定的可直接饲喂动物的饲料级微生物添加剂。芽孢杆菌(Bacillus sp.)是一类好氧型或兼性厌氧型革兰氏阳性菌,是动植物微生态的优势菌之一,不仅种类繁多,而且来源广泛,在土壤、水体、空气及动物肠道中都存在[1-2]。芽孢杆菌也是抑菌物质的生产者,其产生的细菌素是继乳酸菌细菌素之后的又一类主要的细菌素,与乳酸菌研究最多的Nisin相比,该类细菌素在耐受性方面表现突出[3],已作为益生菌广泛应用于食品、水产养殖、医药和生物农药等领域。研究数据显示,在过去的5年中,研究人员从多种样品中筛选出有益芽孢杆菌,并分离纯化出新的细菌素。有益芽孢杆菌的开发和应用可能是解决抗生素问题的一个有效方案。
1 菌株
菌株PB-2为笔者所在研究小组在前期试验中从吕梁黑猪肠道中分离纯化得到的。大肠杆菌、沙门菌、李斯特菌、金黄色葡萄球菌、表皮葡萄球菌和藤黄微球菌保存于山西农业大学基础兽医学实验室。
牛津杯法抑菌实验所用下层板为2%琼脂。上层板用的是含有107 CFU/mL指示菌的0.75% TSA培养基(胰蛋白胨15 g,大豆蛋白胨5 g,氯化钠30 g,琼脂7.5 g,水1 000 mL)或15 mL 0.75%的BHI(脑心浸液)培养基,待上层凝固后,将一定间隔放置的牛津杯拔出,形成上层板。
2 方法
2.1 菌株的活化和抑菌活性检测
将-80 ℃保存的PB-2甘油菌活化后,按照1∶100的体积比接种于LB液体培养基中,30 ℃培养24 h,10 000 g,4 ℃下离心20 min,收集上清液,用0.22 μm滤器过滤获得无细胞的培养上清。运用牛津杯法检测其抑菌活性[4]。
2.2 PB-2菌株的鉴定
菌落形态:将菌株PB-2划线接种于LB平板上,培养12 h,观察单菌落的形态特征。
革兰氏染色:参考革兰氏染色试剂盒的说明书进行革兰氏染色,在Leica DMIRB 显微镜油镜下观察PB-2的形态。
16S rDNA法鉴定:以提取的菌体DNA作为模板,采用16S通用引物进行PCR扩增,上下游引物序列分别为:5′-AGAGTTTGATCMTGGCTCAG-3′和5′-TACGGYTACCTTGTTACGACTT-3′。用1%琼脂糖凝胶电泳鉴定PCR产物。将扩增产物送至北京六合华大基因科技有限公司进行测序。运用NCBI的BLAST进行比对,分析分离菌的同源性,鉴定其菌种归属。
3 结果
3.1 菌株PB-2的抑菌活性
菌株PB-2的发酵上清对革兰氏阳性菌具有明显的抑菌活性(表1)。
3.2 菌株PB-2的鉴定
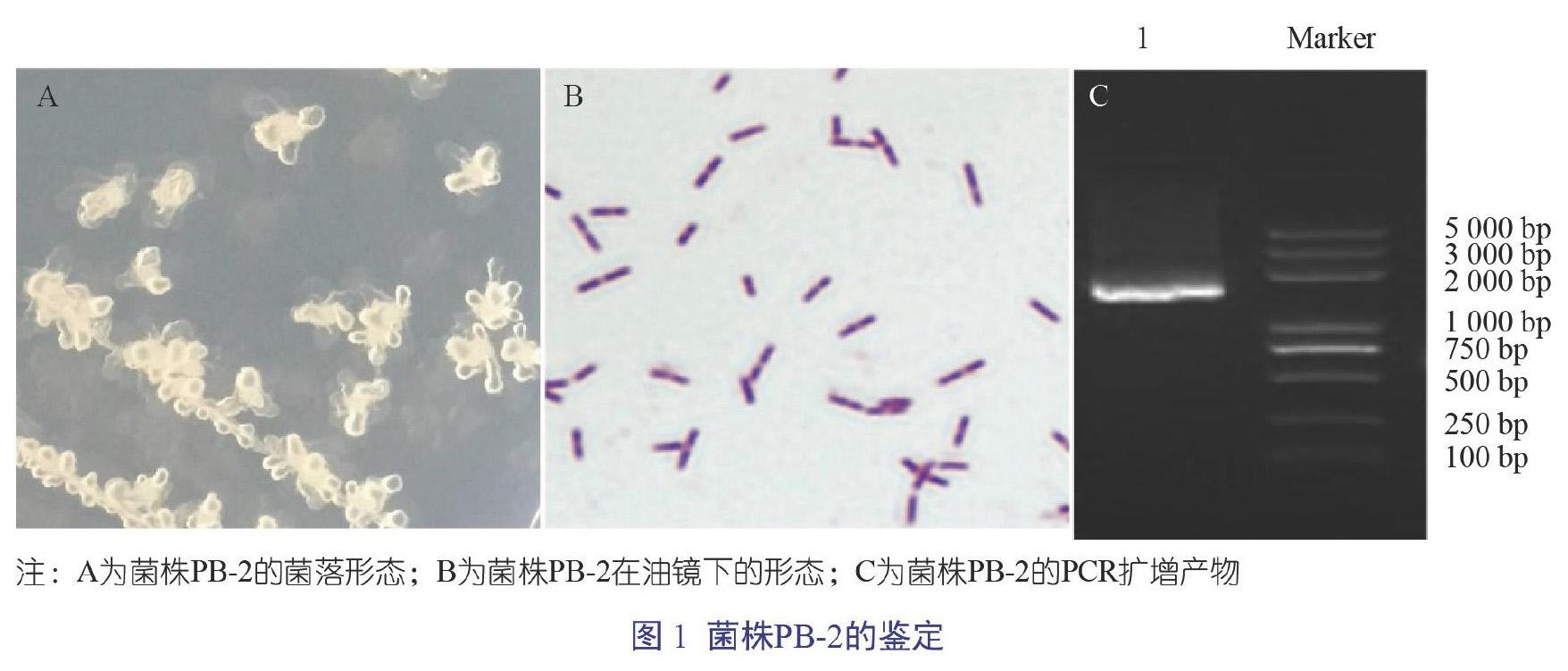
PB-2菌落呈白色略带黄色,菌落边缘不整齐,表面不光滑且不透明,形成“黏液状的花形”菌落形态(图1A);经革兰氏染色后,油镜下观察可见菌株PB-2呈紫色短杆状,细胞单个或成对存在(图1B);PB-2的PCR扩增产物大小为1 400 bp,琼脂糖电泳结果见图1C;将PB-2 16S rRNA测序结果与NCBI的BLAST进行比对,结果显示该菌株与Bacillus licheniformis 16S rRNA基因序列相似度高达99%。
4 讨论
自然界蕴藏着丰富的可维持菌群平衡的益生菌资源[5]。本文对从吕梁黑猪肠道中分离的一株细菌PB-2进行研究,发现其对革兰氏阳性菌具有明显的抑菌活性,通过细菌染色和形态学观察初步鉴定为芽孢杆菌。根据文献报道,16S rDNA序列同源性大于99%,可以认为属于同一种;同源性为95%~98%可以认为是同属不同种;同源性在95%以下可以认为属于不同属。本文根据菌株PB-2的16S rDNA鉴定结果确定该菌株为地衣芽孢杆菌。
琼脂扩散方法是分离和筛选具有拮抗作用微生物的最经典的方法[6],在分离和筛选动物、植物和环境来源的拮抗微生物方面得到了普遍的应用。Ren等利用该方法从发酵乳中分离到具有拮抗作用的乳酸菌[7];Ge等运用琼脂扩散方法从泡菜中分离到副干酪乳杆菌,并从该菌中纯化得到新型细菌素HD1-7[8]。本试验采用这种方法,对分离到的PB-2进行抑菌活性测定,结果表明该菌株对金黄色葡萄球菌、李斯特菌具有抑制效果。
参考文献:
[1] Mohammadi F, Eshaghi M, Razavi S, et al. Characterization of bacteriocin production in Lactobacillus spp. isolated from mother's milk[J]. Microb Pathog, 2018, 118: 242-246.
[2] Xin H, Ji S, Peng J, et al. Isolation and characterisation of a novel antibacterial peptide from a native swine intestinal tract-derived bacterium[J].Int J Antimicrob Agents, 2017, 49(4): 427-436.
[3] 谷笑笑,王振华,潘康成. 益生芽孢杆菌对动物免疫功能影响研究进展. 2016,43(9):2079-2085.
[4] Lü X, Hu P, Dang Y, et al. Purification and partial characterization of a novel bacteriocin produced by Lactobacillus casei TN-2 isolated from fermented camel milk (Shubat) of Xinjiang Uygur Autonomous region,China[J]. Food Control, 2014, 43(5):276-283.
[5] 韩凯会, 王非梦, 张丽, 等. 发酵饲料用具有潜在益生功能芽孢杆菌的筛选及性质研究[J]. 饲料研究, 2020, 43(2): 56-59.
[6] 国家药典委员会. 中国药典[M].北京: 中国医药科技出版社, 2015
[7] Ren D, Zhu J, Gong S, et al. Antimicrobial Characteristics of Lactic Acid Bacteria Isolated from Homemade Fermented Foods[J]. Biomed Res Int, 2018, 2018: 5416725.
[8] Ge J, Sun Y, Xin L, et al. Purification and Partial Characterization of a Novel Bacteriocin Synthesized by Lactobacillus paracasei HD1-7 Isolated from Chinese Sauerkraut Juice[J]. Sci Rep, 2016, 14(6): 19366.

