MPPED2通过PI3K/AKT信号通路对结直肠癌的增殖、迁移与凋亡的影响
海 睿,杨 茜,谢林浚,游 千,周静逸,雷兴伟,周翔宇
(1.西南医科大学附属医院 甲状腺外科,四川 泸州 646000;2.西南医科大学 临床医学院,四川 泸州 646000)
结直肠癌是消化道常见的恶性肿瘤之一,全球每年确诊结直肠癌136万例,死亡病例近60万例,尽管近几十年来在早期发现和干预方面取得了技术进步,但结直肠癌患者的预后仍然不容乐观[1]。目前结直肠癌的治疗方法主要是通过手术切除后行放化疗[2]。早期结直肠癌患者术后通常有良好的预后,但由于肿瘤的侵袭和转移,大多数晚期患者的预后较差[3]。随着科学与技术的快速发展以及对肿瘤细胞分子水平相关致病机制的深入研究,靶向治疗在临床上的应用给结直肠癌患者带来了新的治疗希望,但转移性结直肠癌的5年生存率仍然很低,约为14%[4]。因此对结直肠癌的分子机制进行更详细的探索,开发更有效的结直肠癌治疗靶点具有重要临床意义。
MPPED2基因位于人类染色体11p13上,该区域主要与肾母细胞瘤、无虹膜、泌尿生殖系统异常和智力低下(WAGR综合征)有关[5]。既往研究表明,MPPED2与全身炎症改变、创伤预后不良、龋齿相关[6-7]。此外,也有研究表明MPPED2与肿瘤的发生发展相关。Shen等发现miR-448可下调MPPED2促进口腔鳞癌细胞增殖并抑制其凋亡[8]。Li 等发现MPPED2可能与甲状腺乳头状癌(PTC)的发生密切相关,并认为MPPED2的异常表达将成为PTCs的诊断标志物[9]。在最近的一项研究中发现MPPED2启动子区的表观遗传改变在大肠肿瘤进展过程中依次出现,它可能成为结直肠癌早期诊断和分期监测的一个有前景的生物标志物[10]。然而,MPPED2在结直肠癌中的具体功能及其机制并没有进一步深入研究。本文旨在探讨MPPED2对结直肠癌CT26细胞增殖、迁移与凋亡的影响及其可能的机制。
1 材料与方法
1.1 组织标本采集 采集2019年1~8月在西南医科大学附属医院行结直肠癌切除术患者的结直肠癌组织及邻近癌组织旁的正常组织。结直肠癌切除术后立即采集结直肠癌组织及邻近癌组织旁的正常组织共30对,为了保证有足够的样本供最终病理诊断,每对约2 g。样品立即在-196 ℃的液氮罐中冷冻,然后转移到-80 ℃的低温冰箱中长期保存。所有样本均经患者及其家属知情同意,并签署相关伦理文件。本实验经西南医科大学附属医院伦理委员会批准。
1.2 细胞与试剂 结肠癌细胞株CT26与正常结直肠细胞株FHC购于美国标准细胞培养库ATCC;胎牛血清(FBS)及DMEM培养基购买于美国GIBCO公司;Trizol试剂购自北京天根生化科技有限公司;逆转录试剂盒及Real-time PCR试剂盒购买于日本TOYOBO公司;转染试剂及MPPED2抑制剂购买于中国广州瑞博生物有限公司;CCK8试剂、结晶紫染液购买于上海碧云天生物科技有限公司;细胞凋亡检测试剂盒购买于美国BD Biosciences公司;P-PI3K抗体、PI3K抗体、P-AKT抗体、AKT抗体、GAPDH抗体(1∶1 000稀释)购买于Abcam公司。
1.3 细胞转染 将对数生长的CT26细胞接种于细胞培养板,在细胞密度达到30%~50%时,分别转染siRNA-MPPED2及siRNA-NC,siRNA-MPPED2及siRNA-NC的终浓度为100 nmol,转染24 h后,更换新鲜培养基,进行下一步实验,siRNA-MPPED2的引物序列为:(5’-TTCATGGCAGAC-3’)。
1.4 总RNA提取和Real-time PCR分析 用Trizol试剂提取患者组织和细胞系的总RNA,并使用分光光度计和1%琼脂糖凝胶电泳测定核酸的数量、质量和纯度。随后,使用500 ng总RNA进行反转录,然后行Real-time PCR反应,GAPDH为内参,反应模式为预变性90 ℃ 30 s;变性94 ℃ 1 min;退火72 ℃ 1 min;延伸72 ℃ 7 min,共40个循环。2-△△ct计算法检测MPPED2相对于GAPDH的表达量。
1.5 Transwell迁移实验 将含有转染后的CT26细胞(5×105个细胞/孔)的无血清DMEM培养基(200μL)接种到Transwell小室的上室,然后将含有20%FBS的DMEM培养基添加到下室。细胞在含5%CO2的37 ℃培养箱中孵育48h,取出小室用PBS清洗2次,用棉签擦掉上室中的未迁移细胞。用4%甲醛固定10 min后加入5%结晶紫染色。在100倍镜下用图像和相差显微镜观察移行细胞。
1.6 CCK8增殖实验 将CT26细胞(3×103/孔)接种到96孔板中,最终体积为100 μL,然后转染上述siRNA-MPPED2及siRNA-NC。分别于基因转染后24、48、72 h进行检测。将CCK-8试剂(10 μL)加入每个孔中,并在37 ℃孵箱中培养2 h。在450 nm波长处测量吸光度并计算活细胞数。
1.7 流式细胞凋亡实验 将CT26细胞制备成含有5×105/mL的细胞悬液接种于6孔板中,第2天转染siRNA-MPPED2及siRNA-NC后再次培养24 h,消化、离心后用预冷的PBS清洗2~3次,加入Annexin V-FITC/PI各5 μL,温室避光反应15 min,上流式细胞仪检测细胞凋亡率。
1.8 Western blot实验 RIPA缓冲液从CT26细胞中提取总蛋白后,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,转移到聚偏氟乙烯(PVDF)膜上,之后,用脱脂牛奶在室温下封闭2 h,然后与一抗在4 ℃低温条件下孵育过夜,第2天,用PBST冲洗与一抗孵育的PVDF膜3次,然后在室温下用1∶3 000稀释的二抗孵育1 h,用增强化学发光检测试剂检测蛋白质条带,并用Photo Shop image软件进行定量分析。
2 结果
2.1 MPPED2在结直肠癌组织与细胞中的表达 采用Real-time PCR法检测MPPED2在组织和细胞系中的表达情况。结果表明,与邻近的正常组织(5.21±3.61)相比,MPPED2在结直肠癌组织(1.54±1.44)中的表达显著下调(P=0.0001,见图1A)。同时,MPPED2在CT26细胞(0.29±0.09)中的表达也明显低于FHC细胞(1.30±0.35)(P=0.0081,见图1B),结果提示MPPED2可能在结直肠癌的发生发展中起重要作用。

A:在组织的表达情况;B:细胞中的表达情况;**:P<0.01。图1 MPPED2在组织、细胞中的表达情况
2.2 下调MPPED2后CT26细胞的增殖能力增强 体外培养CT26细胞将其分为两个组,分别为实验组(siRNA-MPPED2)与对照组(siRNA-NC),用Real-time PCR法检测两组细胞中MPPED2的表达情况,结果显示,与siRNA-NC组(1.01±0.12)相比,siRNA-MPPED2组(0.05±0.01)中MPPED2的表达明显降低(P=0.0002,见图2A),提示转染成功。采用CCK8实验检测CT26细胞的增殖能力,如图2B所示,与siRNA-NC组(1.76±0.15)相比,siRNA-MPPED2组(3.75±0.19)的增殖能力明显升高(P=0.000 1,见图2B),提示MPPED2调控了CT26细胞的增殖能力。
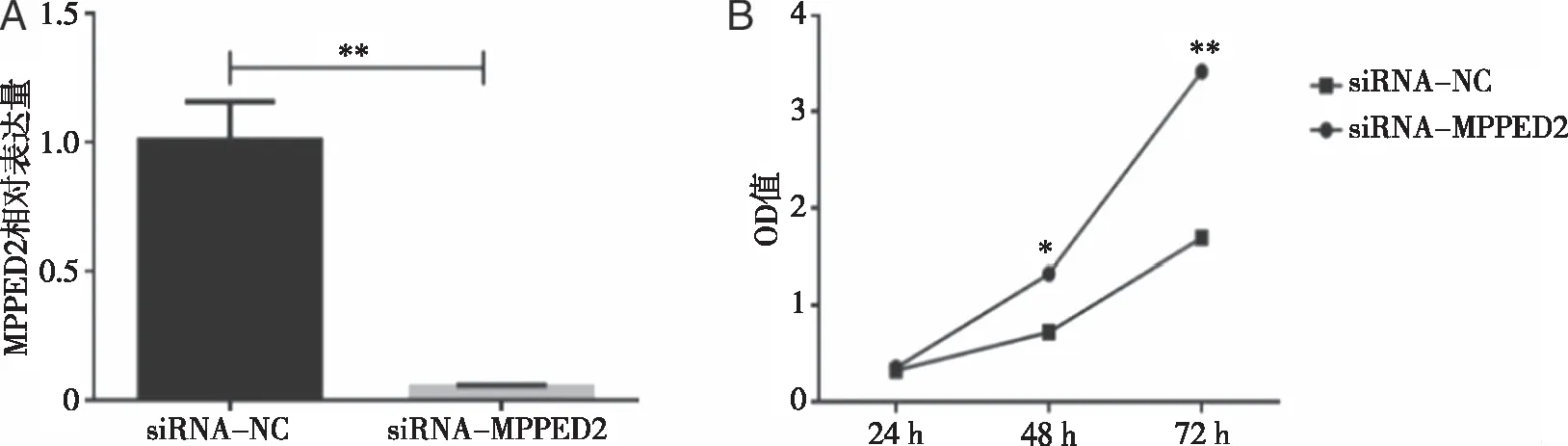
A:转染后MPPED2在CT26细胞中的表达情况;B:CCK8实验检测CT26细胞的增殖能力;*:P<0.05,**:P<0.01。图2 MPPED2在CT26细胞中表达情况及CT26细胞的增殖能力
2.3 下调MPPED2后CT26细胞的迁移能力增强 用Transwell试验检测CT26细胞的迁移能力,将其分为实验组(siRNA-MPPED2)与对照组(siRNA-NC),结果表明与siRNA-NC组(154.00±17.56)相比,siRNA-MPPED2组(282.00±13.93)的迁移能力明显增强(P=0.0006,见图3A、B),提示MPPED2调控了CT26细胞的迁移能力。

**:P<0.01。图3 Transwell实验检测CT26细胞的增殖能力
2.4 下调MPPED2后抑制CT26细胞的凋亡 用流式细胞术分别检测实验组(siRNA-MPPED2)与对照组(siRNA-NC)的凋亡情况。与对照组(21.22±1.38)的凋亡率相比,实验组(11.05±1.28)的凋亡率明显降低(P=0.0163,见图4A、B),提示MPPED2调控了CT26细胞的凋亡。

*:P<0.05。图4 流式细胞术检测CT26细胞凋亡率
2.5 MPPED2通过PI3K/AKT信号通路调控结直肠癌的增殖、迁移与凋亡 用Western blot检测结直肠癌CT26细胞中PI3K、AKT及其磷酸化蛋白的表达情况。结果表明,与siRNA-NC组(0.09±0.04、0.08±0.05)相比,siRNA-MPPED2组(1.46±0.03、1.29±0.05)中P-PI3K、P-AKT的蛋白表达水平明显升高(P=0.0041、0.0124,见图5A、B),提示MPPED2通过PI3K/AKT信号通路调控结直肠癌的增殖、迁移与凋亡。

*:P<0.05,**:P<0.01。图5 Western blot检测CT26细胞中P-PI3K及P-AKT的蛋白表达情况
3 讨论
MPPED2基因编码哺乳动物中一种新的金属磷酸酯酶蛋白,它通常调节许多基本的细胞功能,包括分化、增殖和凋亡[8,11]。同时,MPPED2也被认为在大脑发育中起着重要的作用[12]。既往研究中,MPPED2已经被发现与多种肿瘤组织的发生与发展相关,在肿瘤的生长中起着关键的作用,比如在甲状腺乳头状癌、口腔鳞癌、宫颈癌等癌症中表达下调[8,13-15]。在最近的一项研究中,高甲基化诱导的低表达是MPPED2在结肠癌变过程中沉默的最可能机制[10],但是,目前还没有研究报道过MPPED2在结直肠癌中的具体功能与相关通路。因此,本研究进一步探讨了MPPED2作为结直肠癌潜在分子靶点的可能性治疗。在本研究中,我们首先用Real-time PCR法检测了MPPED2在30对人结直肠癌组织及邻近正常组织中的表达,发现MPPED2在人结直肠癌组织中的表达下调,与既往研究一致,表明MPPED2与结直肠癌的发生发展存在一定关联。然后,我们通过下调MPPED2后采用CCK8实验、Transwell实验、流式细胞术探究MPPED2对结直肠癌CT26细胞的增殖、迁移与凋亡的影响。结果表明下调MPPED2后,结直肠癌细胞的增殖与迁移能力增强,细胞凋亡率下降。由此可见,MPPED2在结肠癌的发生与发展中调节了其增殖、迁移及凋亡的能力。
众所周知,PI3K/AKT信号通路是调控转录、蛋白翻译、细胞生长、增殖、细胞存活和代谢的重要信号级联[16]。它在肿瘤的发生发展中同样也起着重要的作用,在既往研究中,多种基因通过PI3K/AKT信号通路调控肿瘤的增殖、迁移与凋亡等,比如Jiang 等发现MEX3A通过PI3K/AKT信号通路促进三阴性乳腺癌的增殖和迁移[17]。也有研究表明Long non-coding RNA LINC00152/miR-613/CD164轴通过PI3K/AKT途径调控胶质瘤细胞增殖、凋亡、迁移和侵袭[18]。COL6A3通过激活PI3K/AKT信号通路促进骨肉瘤细胞的恶性生长[19]。AKR1C2在食管鳞癌中可以通过激活PI3K/AKT信号通路作为癌基因发挥作用,促进肿瘤的增殖和迁移[20]。然而,MPPED2与PI3K/AKT信号通路之间的关系还没有研究表明,在本研究中,我们探讨了MPPED2与PI3K/AKT信号通路之间的关联,在下调MPPED2后,P-PI3K与P-AKT的蛋白表达水平明显升高,说明了MPPED2是通过PI3K/AKT信号通路调控结直肠癌的增殖、迁移与凋亡。
总之,我们的研究结果表明MPPED2在结直肠癌组织和CT26细胞中的表达显著下降。此外,我们还发现MPPED2可通过PI3K/AKT信号通路来调控CT26细胞的增殖、迁移与凋亡。然而,本实验的缺点是没有对MPPED2进行体内研究,这将是我们下一步的研究计划。

