埃及伊蚊不同组织的基因共表达模式分析
刘 杰,李 勃,陈晓洁,陈 斌
(重庆师范大学昆虫与分子生物学研究所,媒介昆虫重庆市重点实验室,重庆 401331)
截至2017年,全球已知蚊虫约3 573种,其中我国约有419种(付文博和陈斌,2018)。它们分布广,繁殖快。绝大多数种类的雌蚊需要吸食血液作为补充营养以使卵正常发育。因其吸血行为,蚊虫传播许多危险的人类疾病的病原体,是多种恶性传染病的传播媒介(Tolle,2009)。蚊媒病是人类健康的主要威胁,每年全球有7亿人受感染,造成70多万人死亡。近年来,登革热发病率大幅度增长,全球约有一半人口面临登革热的威胁(WHO,2019)(https:∥www.who.int/zh/news-room/fact-sheets/detail/dengue-and-severe-dengue)。埃及伊蚊Aedesaegypti(Linnaeus,1762)是登革热病毒的主要传播媒介,同时也携带基孔肯雅热、黄热病以及寨卡病毒病等传染病病原。这些疾病每年在全世界造成数亿人感染,导致数万人死亡,并呈逐年上升趋势(Akbarietal.,2013)。媒介蚊虫的控制是蚊媒病控制的关键,已成为当今社会所面临的亟待解决的重大问题之一。蚊虫的不同组织承担不同的生理功能,掌握它们的基因表达差异有利于认知它们的生物学功能。蚊虫的遗传控制是蚊虫潜在的重要控制措施之一,弄清蚊虫不同组织在行使功能过程中的共表达基因以及起重要作用的核心(hub)基因有利于寻找遗传控制的靶标基因。
转录组是特定细胞或组织在特定时间或状态下所有转录产物的集合(Wangetal.,2010),通过对转录组的研究可以揭示蚊虫组织分化过程中的基因表达模式和结构变异,并发现新基因等。近年来,随着microarray和RNA-Seq等高通量技术的飞速发展与成本的降低,产生了大规模蚊虫组织转录组学数据(Martínez-Barnetcheetal.,2012;Matthewsetal.,2016;Chenetal.,2017)。传统的转录组学研究主要是在两类样本相互比较的基础上,鉴定差异表达基因,进而对差异基因进行注释与富集分析,并挖掘这些基因的功能表现和参与的通路(pathway),从而解析相关的生物学问题或分子机制。但这样的研究策略主要局限于对组间差异表达的基因进行研究,容易忽略掉基因之间的协同表达或表达互作。目前,基于全局的权重基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)正好为这个问题的解决带来了契机。WGCNA分析基于大样本转录组数据,根据基因表达水平的不同将基因聚类,具有相似表达模式的基因会被划分到同一个模块,同一模块中的基因常具有相似的生物学功能(杨宇昕等,2019)。作为一种系统生物学分析方法,WGCNA可以用来鉴定高度协同变化的基因集、挖掘与目标组织或性状相关的特异性模块,并可进一步研究模块内基因的互作关系,以及筛选hub基因(Langfelder and Horvath,2008),且在描述解析复杂表型下的分子作用机制和网络关系等方面具有独特优势。自WGCNA方法和软件包开发以来,它已广泛应用于多个研究领域,并取得了一系列的研究成果(Greenhametal.,2017;Liuetal.,2018;Dengetal.,2019)。
在蚊虫转录组研究领域,Hickner等(2015)用WGCNA方法研究了尖音库蚊Culexpipiens滞育诱导的潜在调控机制,构建了包含5个模块的基因共表达网络,通过对网络模块中基因的富集分析,鉴定出了与滞育诱导相关的多个基因集;通过对埃及伊蚊环境驱动变异介导的模块化基因网络研究,Kang等(2018)揭示了先天免疫反应的关键转录调控因子和关键基因。这些研究表明,将转录组学数据与WGCNA方法相结合,可为探索蚊虫生物学过程相关分子机制提供强有力的工具。然而,尚未有基于WGCNA方法对蚊虫不同组织基因共表达模式的研究。
蚊虫的不同组织在其传播疾病过程中起着重要的作用,可作为防控的靶标。本研究利用WGCNA方法,结合RNA-Seq转录组数据,构建了埃及伊蚊9种组织加权基因共表达网络,挖掘出与组织特异性相关的共表达模块,研究模块基因功能,并筛选出在组织特异性模块内起重要作用的hub基因,揭示基因间的相互作用关系,旨在为探究蚊虫不同组织特有的基因资源信息,进而解析基因功能与组织功能的联系,筛选遗传控制的靶标基因提供新的思路和途径。
1 材料与方法
1.1 转录组数据来源
埃及伊蚊不同组织的转录组数据来源于NCBI(National Center for Biotechnology Information)的SRA(Sequence Read Archive)数据库,获取码为PRJNA236239(Matthewsetal.,2016)。选择其中未吸血状态下雌蚊和雄蚊9种组织的双端测序数据进行分析,包括雌蚊的触角、脑、喙、下颚须、卵巢,以及雄蚊的触角、脑、前足、中足、后足和腹部末端(被定义为雄蚊包括生殖器在内的3个末端腹节)等。不同组织数据包含的生物学重复次数为:雌蚊喙5次生物学重复,触角、下颚须4次重复,卵巢3次重复,脑2次重复,雄蚊各组织均3次重复,总计36个样本。WGCNA分析根据基因表达水平的不同将基因聚类。在转录组研究中,可通过比对到基因组区域或基因外显子区的测序序列(reads)计数(read counts)来估计基因的表达水平。但reads计数除了与基因的真实表达水平成正比外,还与基因的长度和测序深度成正相关,因此使得不同基因的表达水平不具有可比性。为了解决这个问题,人们引入了FPKM(fragments per kilobase million)、RPKM(reads per kilobase million)和TPM(transcripts per million)的概念。其中TPM是每百万条reads的转录本,其同时考虑了测序深度和基因长度对reads计数的影响,是目前常用的衡量基因表达水平的方法之一。本研究中埃及伊蚊不同组织基因的TPM值采用Matthews等(2016)文献中Additional File 6中的结果。
1.2 基因共表达网络构建
采用TPM值作为标准化的基因表达水平定量,本研究共纳入36个样本。在应用WGCNA前,基于公式log2(TPM+1)对数据进行转换(赵志洪,2017)。经过缺失值移除以及方差计算后,筛选出方差最大的5 000个基因,使用R(v.3.6.1)软件中(https:∥cran.r-project.org/bin/windows/base/old/)的WGCNA(v.1.67)包来构建加权基因共表达网络并划分模块。首先利用函数pickSoftThreshold(Langfelder and Horvath,2008)计算权重值,通过选择合适的权重值,使网络符合无尺度网络分布。
根据上一步分析结果,选择最优的软阈值。使用自动网络构建函数blockwiseModules(Langfelder and Horvath,2008)构建共表达网络,除参数minModuleSize=50外,其余参数按照默认设置。
1.3 基因表达组织特异性模块鉴定
一组表达模式高度相似的基因常聚集在同一模块,而具有相似表达模式的基因被认为具有类似的生物学功能(杨宇昕等,2019)。一般而言,如果某模块与样品的某种特定表型的相关性显著高于其他模块,说明这一个模块可能与该表型存在强的关联,为特异性模块。本研究由于只有埃及伊蚊不同组织的转录组数据,并没有其他表型数据,在此直接将不同组织作为研究的表型性状,以分析模块与组织的联系。首先建立一个行为36个组织样本,列为11个不同取样组织名称的矩阵,若行与列为同一组织,即为1,不是同一组织即为0。计算每个模块特征向量基因(module eigengene,ME)和这个矩阵之间的相关系数,该数值越接近1,表示模块与样品表型的正相关性越强;越接近-1,表示模块与样品表型负相关性越强。本研究中模块与组织高度正相关的筛选标准为:模块与组织相关系数大于0.65,且统计显著性P<0.05。选择与组织高度正相关的模块,作为组织特异性模块进行后续分析(Downsetal.,2013)。
1.4 组织特异性模块基因的GO和KEGG富集分析
首先,使用Bioconductor中的AnnotationHub(v.2.18.0)包获取埃及伊蚊的注释信息,下载埃及伊蚊OrgDb数据库(AH76482,v.2.1)中的注释数据,再利用Bioconductor中的clusterProfiler(v.3.14.3)包对模块内基因进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析(Yuetal.,2012)。一般情况下,P<0.01,q<0.05,则为富集功能项或通路。
1.5 模块基因互作网络构建筛选hub基因
导出WGCNA共表达网络分析结果到Cytoscape(v.3.7.1)软件(Suetal.,2014)中,对基因调控网络进行可视化。通过CytoHubba插件的12种算法,得到连接度在前10的基因,选择在不同算法中重复出现次数大于5的基因,在本研究中被定义为hub基因。
2 结果
2.1 权重基因共表达网络构建
根据基因表达水平对样本进行聚类。如图1所示,基于平均(average)距离和层次聚类算法聚类结果表明,基因表达模式除了在雄成蚊前足和中足中出现了一定的散乱之外,测序所用的埃及伊蚊成蚊组织大多具有很高的重复性。雌/雄成蚊的触角、脑中基因表达模式相近,聚类在一起;雄成蚊前足、中足及后足中基因表达模式相近,聚类在一起;雌成蚊喙与下颚须中基因表达模式相近,聚类在一起。对软阈值(β)进行筛选,最终选取β值为12。通过WGCNA方法成功构建埃及伊蚊成蚊不同组织加权基因共表达网络,并将网络划分为11个模块(图2:A)。图2(A)上半部分的聚类树中每个枝代表一个模块,每个枝上的叶代表一个基因,图2(A)下半部分的模块颜色中每个颜色代表一个模块。共表达模块中基因的具体数量如图2(B)所示。模块中基因个数123~1 423不等,共含有5 000个基因。其中turquoise模块包含的基因数目最多,达1 423;greenyellow模块内的基因数量最少,为123;grey表示未划分到模块中的基因,图2(A)中grey模块基本不可见,因未划分到模块的基因仅有7个。
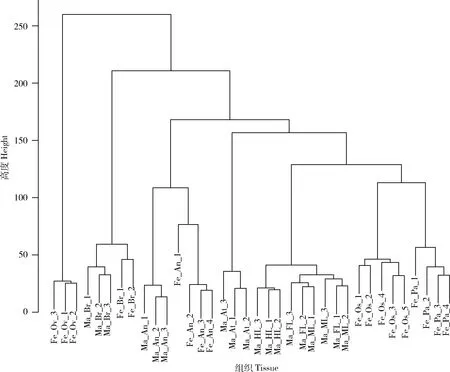
图1 基于基因表达水平的埃及伊蚊成蚊不同组织聚类Fig.1 Clustering of different adult tissues of Aedes aegypti based on gene expression levelsFe_Ov:雌蚊卵巢Female ovary;Ma_Br:雄蚊脑Male brain;Fe_Br:雌蚊脑Female brain;Ma_An:雄蚊触角Male antenna;Fe_An:雌蚊触角Female antenna;Ma_At:雄蚊腹部末端Male abdominal tip;Ma_HL:雄蚊后足Male hindleg;Ma_FL:雄蚊前足Male foreleg;Ma_ML:雄蚊中足Male midleg;Fe_Os:雌蚊喙Female proboscis;Fe_Pa:雌蚊下颚须Female maxillary palp。根据基因表达水平,采用平均距离和层次聚类算法对样本进行聚类。横轴表示埃及伊蚊成蚊不同组织,代号末位的数字表示该组织的重复样本;纵轴代表基因间的聚类高度。According to gene expression level,average distance and hierarchical clustering algorithm were used to cluster the samples.The abscissa represents the different adult tissues of A.aegypti,the last digit of the code represents a duplicate sample of the tissue,and the ordinate represents the cluster height of genes.
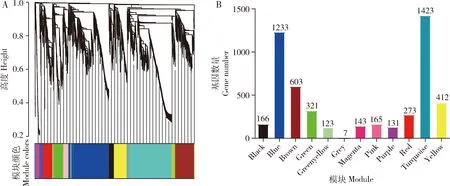
图2 埃及伊蚊成蚊不同组织基因共表达模块Fig.2 Gene co-expression modules in different adult tissues of Aedes aegyptiA:基因聚类数和模块分割。上半部分表示基因聚类所得聚类树,纵坐标代表各基因间的聚类距离;下半部分表示按树的分枝切割得到的模块,相同模块用同一颜色表示。Clustering dendrogram of genes and module splitting.The upper part represents dendrogram tree obtained by gene hierarchical clustering,and the ordinate represents the clustering distance between genes.The lower half represents the module cut by the branches of the tree,and the same module is represented by the same color.B:共表达模块中基因数量分布。横坐标代表模块,纵坐标代表模块中的基因数目,不同的颜色与模块名称对应,每个柱子上的数字表示该模块内的基因数目。Distribution of gene number.The abscissa represents the module,and the ordinate represents the number of genes in the module.Different colors correspond to the module name.The number on each column represents the number of genes in the module.
2.2 组织特异性模块分析结果
通过筛选发现在11个模块中有6个为高度的组织特异性模块(r>0.65,P<0.05)(图3)。在雌成蚊触角、喙、卵巢、下颚须以及雄成蚊脑和腹部末端组织中各鉴定出1个特异性模块。green模块与雌成蚊触角存在高度相关性(r=0.69,P=4E-06),purple模块与雌成蚊喙存在高度相关性(r=0.8,P=4E-09),turquoise模块与雌成蚊卵巢存在高度正相关性(r=0.96,P=4E-20),red模块与雌成蚊下颚须存在高度正相关性(r=0.69,P=4E-06)。与雄成蚊脑高度正相关的模块为blue模块(r=0.7,P=2E-06),与雄成蚊腹部末端高度正相关的模块为magenta模块(r=0.96,P=2E-37)。6个组织特异性模块中没有任何一个模块和雄成蚊前足、中足、后足存在较高相关性。推测可能是这3个组织中的基因主要进行基本的生命活动,因此没有特异性的模块与之对应。
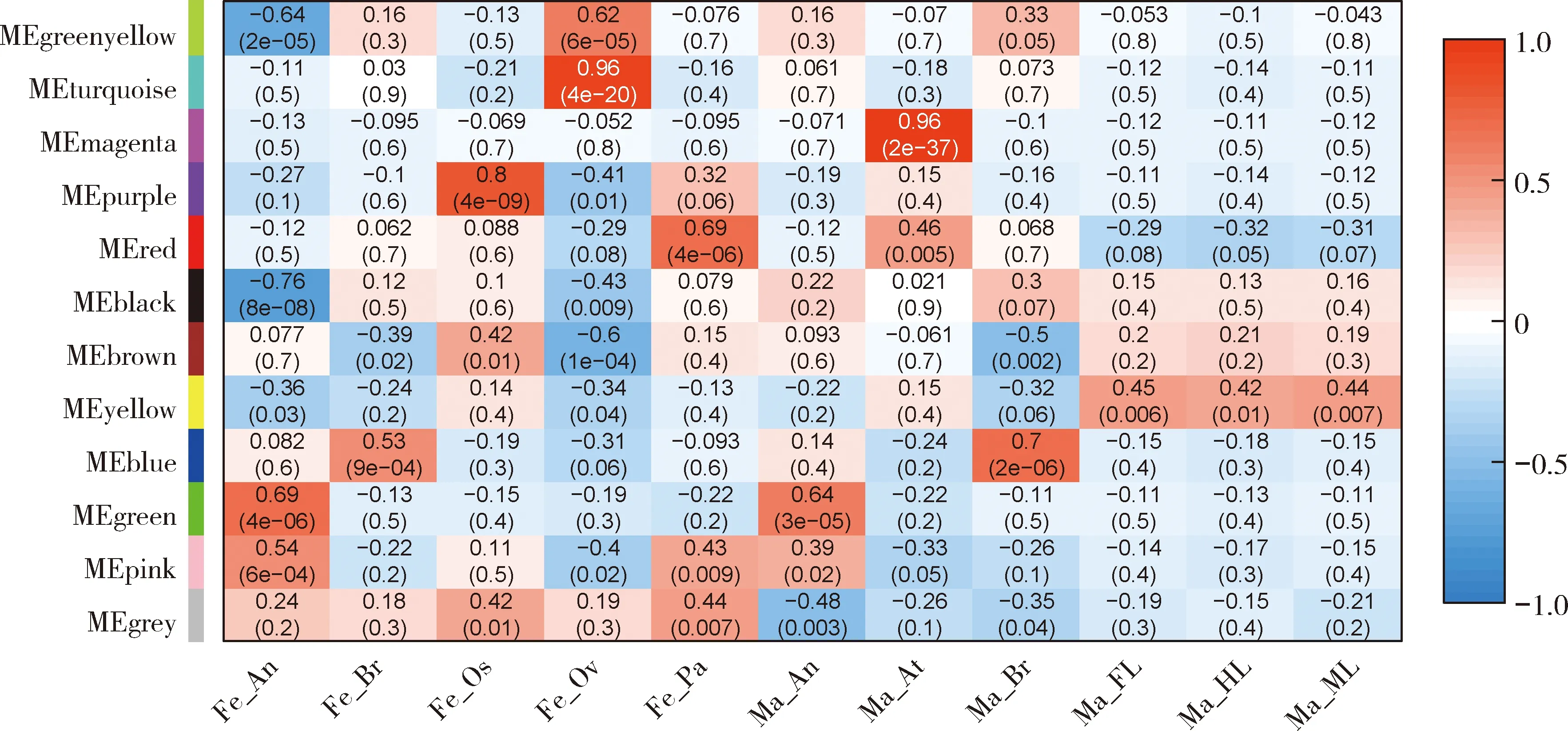
图3 埃及伊蚊成蚊不同组织基因共表达模块与性状关联热图Fig.3 Heat map of module-trait relationship of different adult tissues in Aedes aegyptiFe_An:雌蚊触角Female antenna;Fe_Br:雌蚊脑Female brain;Fe_Os:雌蚊喙Female proboscis;Fe_Ov:雌蚊卵巢Female ovary;Fe_Pa:雌蚊下颚须Female maxillary palp;Ma_An:雄蚊触角Male antenna;Ma_At:雄蚊腹部末端Male abdominal tip;Ma_Br:雄蚊脑Male brain;Ma_FL:雄蚊前足Male foreleg;Ma_ML:雄蚊中足Male midleg;Ma_HL:雄蚊后足Male hindleg.MEgreenyellow:黄绿色模块特征向量基因Module eigengene of green yellow module;MEturquoise:蓝绿色模块特征向量基因Module eigengene of turquoise module;MEmagenta:品红色模块特征向量基因Module eigengene of magenta module;MEpurple:紫色模块特征向量基因Module eigengene of purple module;MEred:红色模块特征向量基因Module eigengene of red module;MEblack:黑色模块特征向量基因Module eigengene of black module;MEbrown:棕色模块特征向量基因Module eigengene of brown module;MEyellow:黄色模块特征向量基因Module eigengene of yellow module;MEblue:蓝色模块特征向量基因Module eigengene of blue module;MEgreen:绿色模块特征向量基因Module eigengene of green module;MEpink:粉红色模块特征向量基因Module eigengene of pink module;MEgrey:灰色模块特征向量基因Module eigengene of grey module.该图基于R语言所得,横轴表示埃及伊蚊不同组织,纵轴表示每一个模块的特征向量。括号内数值表示模块与组织相关系数和统计显著性。相关系数越接近1,表示模块与样品正相关性越强;越接近-1,表示模块与样品负相关性越强。Based on the R language,the horizontal axis represents the different tissues of A.aegypti,and the vertical axis represents the module eigengene of each module.The values in parentheses represent the correlation coefficient and statistical significance between the module and the tissues.The closer the correlation coefficient is to 1,the stronger the positive correlation between the module and the sample;the closer to -1,the stronger the negative correlation between the module and the sample.
2.3 组织特异性模块GO和KEGG富集分析
组织特异性模块可能参与组织特有的生物学过程,为进一步解析组织特异性模块内基因的生物学功能,并与相应组织功能联系,同时也验证共表达网络构建和组织特异性模块的可靠性,对这6个特异性模块进行GO和KEGG富集分析。GO富集分析结果表明(表1),与雌成蚊触角高度正相关的green模块在纤毛组装、基于微管运动和细胞对刺激的反应等生物学过程中发挥主要作用,其主要的细胞组分为微管相关复合物、细胞外围、质膜等,具有气味结合、嗅觉受体活性、跨膜信号受体活性等生物学功能;与雄成蚊脑高度正相关的blue模块在生物学过程调节、信号转导、神经系统过程等生物学过程中发挥主要作用,其主要的细胞组分为质膜、突触、突触后膜等,具有转运活性、神经递质受体活性、铁离子结合等功能;与雌成蚊喙高度正相关的purple模块具有丝氨酸型肽链内切酶活性、丝氨酸水解酶活性等功能;与雌成蚊卵巢高度正相关的turquoise模块在DNA复制、细胞分裂、细胞周期等生物学过程中发挥主要作用,其主要的细胞组分为核小体、染色体等,具有DNA结合、锌离子结合、微管结合、解旋酶活性等功能;与雌蚊下颚须高度正相关的red模块在有机酸代谢、羧酸代谢、细胞氨基酸代谢等生物学过程中发挥作用,其细胞组分为细胞外区域,具有丝氨酸型肽链内切酶活性、碳水化合物结合等功能;与雄成蚊腹部末端高度正相关的magenta模块在羧酸代谢、草酸代谢、有机酸代谢等生物学过程中发挥主要作用。

表1 埃及伊蚊成蚊组织特异性基因共表达模块的GO富集分析Table 1 GO enrichment analysis of tissue specific gene co-expression module in Aedes aegypti adults
KEGG富集分析结果表明(表2),与雌成蚊触角高度正相关的green模块显著富集在药物代谢-细胞色素P450、不饱和脂肪酸的生物合成以及谷胱甘肽代谢等通路;与雄成蚊脑高度正相关的blue模块显著富集在刺激神经组织中的交互、光传导以及其他多糖降解通路;与雌成蚊卵巢高度正相关的turquoise模块显著富集在DNA复制、错配修复、戊糖和葡萄糖醛酸盐的相互转化等通路;与雌成蚊下颚须高度正相关的red模块显著富集在甘氨酸、丝氨酸和苏氨酸的代谢通路以及精氨酸和脯氨酸代谢通路;magenta和purple模块未发现显著富集通路。
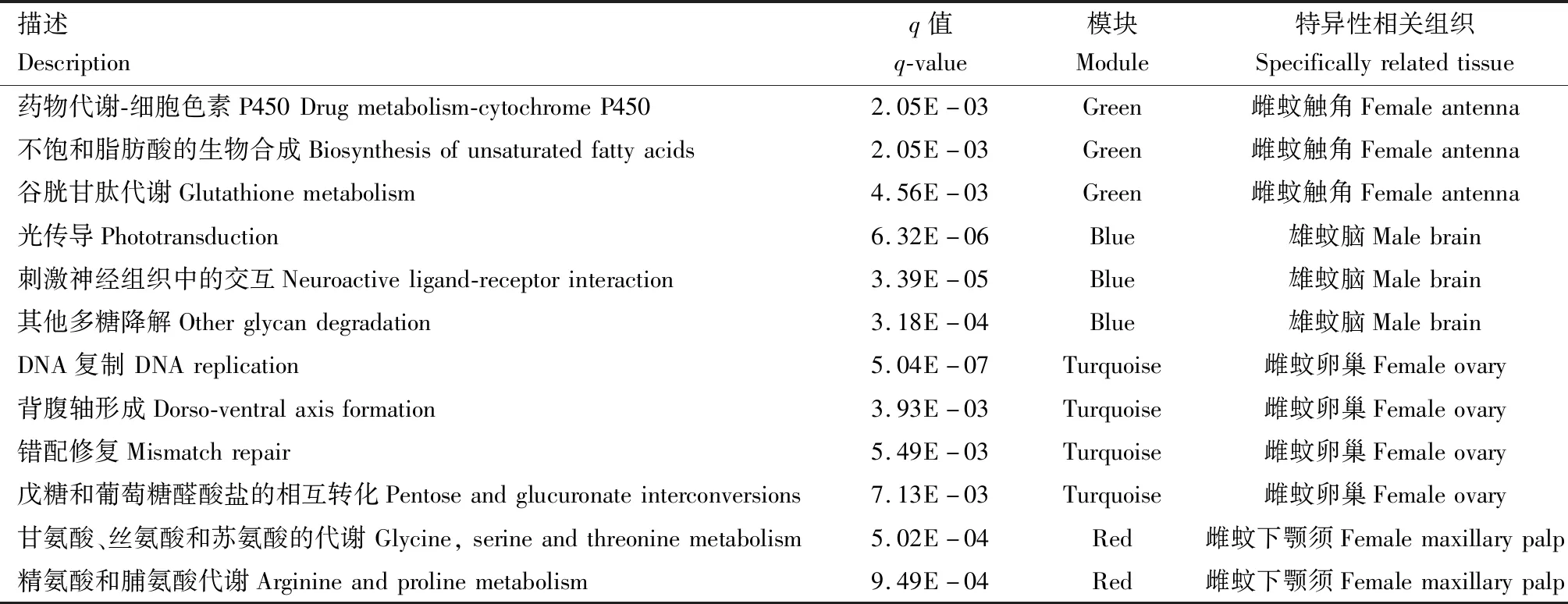
表2 埃及伊蚊成蚊组织特异性基因共表达模块的KEGG富集分析Table 2 KEGG enrichment analysis of tissue specific gene co-expression module in Aedes aegypti adults
2.4 组织特异性模块hub基因识别
整合CytoHubba插件12种不同算法的结果,取重复出现次数大于5次的基因,共得到47个hub基因(green,blue,purple,turquoise,red和magenta模块分别有9,5,6,9,9和9个)(表3)。green,blue,purple,turquoise,red和magenta模块中连通性最高的基因分别为AAEL010426,AAEL002896,AAEL002600,AAEL000961,AAEL007784和AAEL006429。

表3 埃及伊蚊成蚊组织特异性基因共表达模块内的hub基因Table 3 Hub genes within a tissue-specific module in Aedes aegypti adults
基于WGCNA共表达网络分析结果,对组织特异性模块内连通性最高的核心基因进行可视化展示,因与核心基因互作的基因较多,仅对权重值前50个有关联的基因进行可视化(图4)。结果发现,green模块的基因在雌/雄成蚊触角中高表达,与核心基因AAEL010426具有较高互作网络关系的基因为AAEL017505,AAEL017129,AAEL017104,AAEL007147和AAEL013563;blue模块的基因在雌/雄成蚊脑中高表达,与核心基因AAEL002896具有较高互作网络关系的基因为AAEL012541,AAEL004246,AAEL007559,AAEL003472和AAEL002220;purple模块的基因在雌成蚊喙中表达最高,与核心基因AAEL002600具有较高互作网络关系的基因为AAEL014382,AAEL017265,AAEL011610,AAEL013032和AAEL014390;turquoise模块的基因在雌成蚊卵巢中高表达,与核心基因AAEL000961具有较高互作网络关系的基因为AAEL000898,AAEL013338,AAEL000923,AAEL007879和AAEL011516;red模块的基因在雌成蚊下颚须、雄成蚊腹部末端较高表达,与核心基因AAEL007784具有较高互作网络关系的基因为AAEL000044,AAEL003114,AAEL007033,AAEL002624和AAEL012726;magenta模块的基因在雄成蚊腹部末端高表达,与核心基因AAEL006429具有较高互作网络关系的基因为AAEL010040,AAEL006414,AAEL002000,AAEL001550和AAEL005107。
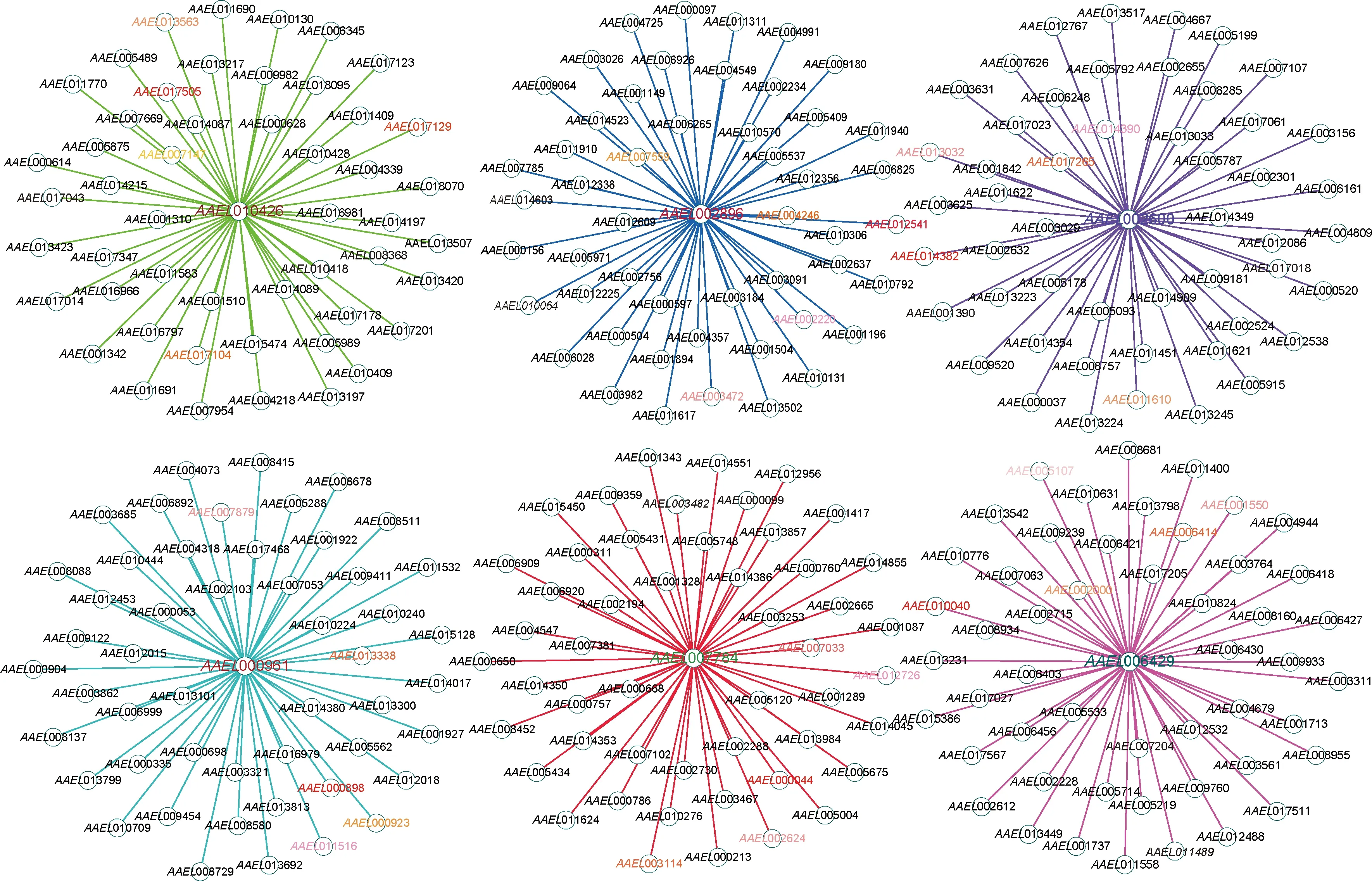
图4 埃及伊蚊成蚊组织特异性基因共表达模块内连通性最高的核心基因的基因网络Fig.4 Gene networks of the most interconnected hub gene in the tissue-specific gene co-expression module of Aedes aegypti adults图中绿色、蓝色、紫色、蓝绿色、红色和品红色线条分别表示green,blue,purple,turquoise,red和magenta模块。每个网络图中位于中心的为该组织特异性基因共表达模块内连通性最高的核心基因,其余带有颜色标记的基因表示与模块内连通性最高的核心基因具有较高互作网络关系的前5个基因,颜色越深表示互作关系越强。网络中只列出与核心基因互作权重值较高的基因。The green,blue,purple,turquoise,red,and magenta lines in the figure represent the green,blue,purple,turquoise,red,and magenta modules,respectively.At the center of each network diagram is the hub gene with the highest connectivity within the tissue-specific gene co-expression module.The remaining genes with color marks represent the top 5 genes with a higher interactive network relationship with the hub genes with the highest connectivity in the module.The darker the color,the stronger the interactive relationship.In the network,only the genes with high weights interacted with the hub genes were listed.
已知AAEL007373和AAEL008046可能参与埃及伊蚊寻找宿主过程中氨的检测(Matthewsetal.,2016)。基于WGCNA分析结果,发现AAEL007373被划分到green模块,该模块基因在雌/雄成蚊触角中高表达;AAEL008046被划分到blue模块,该模块基因在雌/雄成蚊脑中高表达。以这两个基因为核心构建局部网络(图5),发现green模块内的基因AAEL007373与离子通道型受体基因AAEL000047、气味受体基因AAEL015147和AAEL005999等具有较高互作网络关系;green模块内的核心基因AAEL014089,AAEL007669,AAEL012424,AAEL010426,AAEL001510和AAEL013197也均与其存在互作。blue模块内的基因AAEL008046与AAEL004246,AAEL006825和AAEL000504等存在关联;blue模块内的核心基因AAEL002896,AAEL010918和AAEL001696也与其存在互作网络关系。
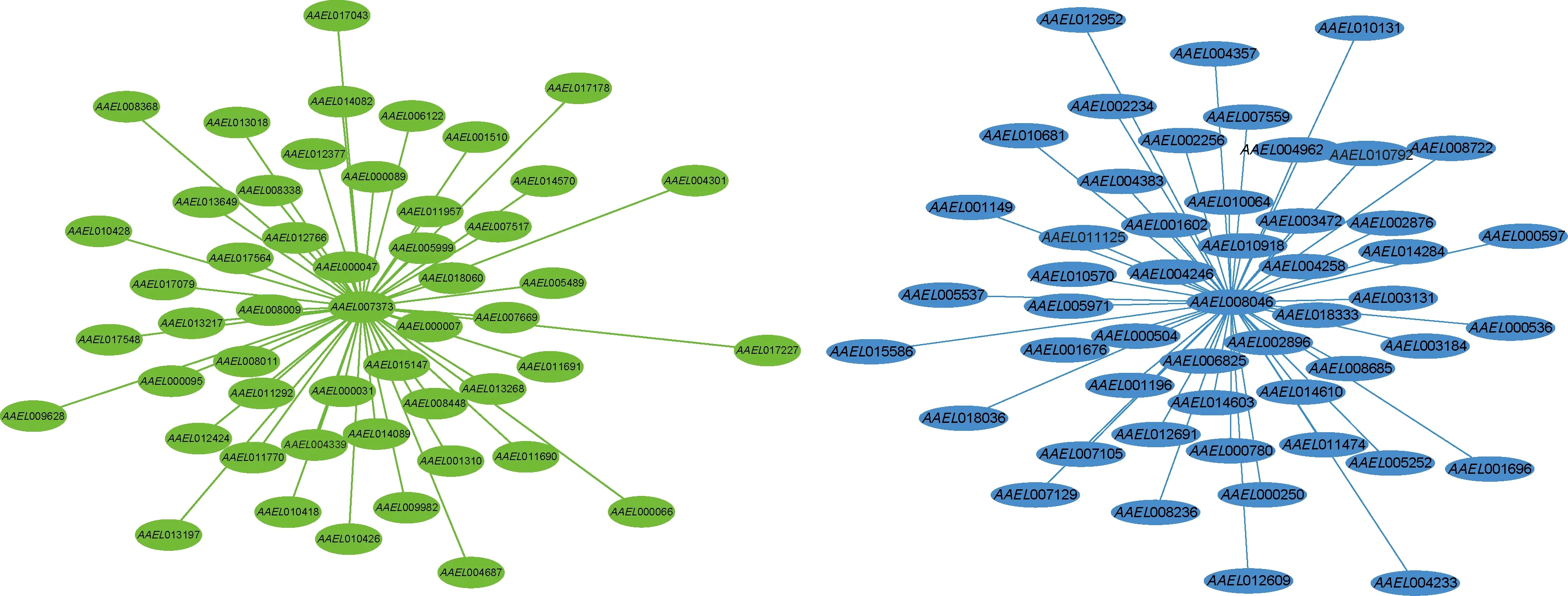
图5 埃及伊蚊AAEL007373和AAEL008046的基因网络Fig.5 Gene networks of AAEL007373 and AAEL008046 of Aedes aegypti图中绿色和蓝色分别表示green和blue模块。网络中只列出与核心基因互作权重值较高的基因。Green and blue colors in the figure represent green and blue modules,respectively.In the network,only the genes with high weights interacted with the hub genes were listed.
3 讨论与结论
基因的表达存在相关性,功能相关的一组基因常协调一致,共同表达。对蚊虫不同组织的基因共表达模式进行研究,可获得组织特有的基因资源信息,得到组织在行使功能过程中的共表达基因以及起重要作用的核心基因,帮助研究者深入理解组织中基因间的相互作用模式,进而解析基因功能与组织生物学功能的联系,筛选遗传控制的靶标基因。在大样本转录组数据中,传统的差异分析或趋势分析,仅罗列了单一的基因列表,无法得到基因间的相关性,并对基因进行有效的分类,亦不能推测新的基因相互作用关系。WGCNA分析从系统角度出发,将协同变化的基因进行聚类,以网络模块的形式呈现基因的共表达特性。其优势在于,将海量的数据进行归纳和整理,高效研究基因整体表达规律,并系统地反馈样本中基因间的相互作用模式,同时可特异性地筛选出与样本性状相关的基因模块和hub基因。作为一种高效的数据挖掘手段,其在多样本RNA-Seq数据的应用中越来越流行(Zhaoetal.,2010;巨飞燕等,2019)。WGCNA分析可为蚊虫不同组织的基因共表达模式研究提供新思路。
本研究利用WGCNA方法对埃及伊蚊成蚊不同组织的基因共表达模式进行研究,构建了埃及伊蚊9种组织加权基因共表达网络,结果显示埃及伊蚊这9种组织涉及11个基因共表达模块(图2);将转录组数据对应的不同组织(雌蚊:脑、触角、喙、下颚须、卵巢;雄蚊:脑、触角、前足、中足、后足、腹部末端)作为研究的性状,成功鉴定到与雌蚊触角、喙、下颚须、卵巢以及雄蚊脑、腹部末端相关的6个组织特异性模块,分别为green,purple,red,turquoise,blue和magenta模块(图2)。蚊虫分化成熟的多个组织共同支撑其追寻寄主、吸取血液、交配产卵、传播疾病等生命活动过程。研究表明,蚊虫可利用多种化学和物理线索,如宿主释放的气味、CO2、周围环境的化学信号以及雌蚊翅产生的特定频率等,并据此定位宿主的位置、选择配偶和找寻产卵地点(Hartberg,1971;Catoretal.,2009;Matthewsetal.,2016)。触角、喙和下颚须在此过程中起着极其重要的作用,因此它们被认为是蚊虫防治控制的重要靶标之一(张晶晶,2019)。其中触角是蚊虫最主要的嗅觉器官,在成蚊触角上有许多被称为感受器的感觉结构,这是进行化学感知的物理位置(张静等,2019);喙是蚊虫在进食过程中处理味觉代码的重要头部附属物,其作为探针到达宿主皮肤下的血管(Maekawaetal.,2011)。下颚须是蚊虫主要的化学感觉器官,可感知CO2和挥发性气味物质等(Grantetal.,1995)。脑是蚊虫神经调节的重要场所,也是目前蚊虫生物防控研究的热点之一,其内含有多种神经递质,如乙酰胆碱、GABA以及谷氨酸等(Matthewsetal.,2016)。在脑的高级处理中心可整合嗅觉和其他感觉模式,最终将这些信号转化为行为,其可能是蚊虫防控的一个新靶标(Riabininaetal.,2016)。而卵巢、腹部末端是与蚊虫生殖细胞发育、繁殖相关的重要场所,有研究认为可通过将雌蚊转化为无害的雄蚊的策略而实现蚊虫防控,提示调节蚊虫性别分化过程可能是当前防控蚊虫的一个重要突破口(Halletal.,2015)。对6个组织特异性模块内基因的注释分析发现,与雌成蚊触角特异性相关的green模块具有气味结合和嗅觉受体活性等功能;与雌成蚊喙特异性相关的purple模块具有丝氨酸型肽链内切酶活性和丝氨酸水解酶活性等功能;与雌成蚊下颚须正相关的red模块具有丝氨酸型肽链内切酶活性和碳水化合物结合等功能;与雄成蚊脑特异性相关的blue模块在生物学过程调节、信号转导、神经系统过程等生物学过程中发挥主要作用;与雌成蚊卵巢特异性相关的turquoise模块在DNA复制、细胞分裂、细胞周期等生物学过程中发挥主要作用;与雄成蚊腹部末端特异性相关的magenta模块在羧酸代谢、草酸代谢、有机酸代谢等生物学过程中发挥主要作用(表1和2)。其均能与对应组织功能相联系,说明组织特异性模块的识别可靠,可用于后续相关信息的挖掘。
核心基因在基因表达网络中具有高的连接度,其往往是重要的作用靶点和研究热点,在生物学过程中起着关键作用。但通过Cytoscape构建基因互作网络后,较多的node和edge常会掩盖真正的核心基因,影响筛选过程。因此本研究采用Cytoscape软件中的CytoHubba插件,进一步缩小了6个组织特异性模块中核心基因的搜索范围,共筛选出47个在模块内可能起重要作用的hub基因(表3)。这些基因大多可在黑腹果蝇Drosophilamelanogaster中找到对应直系同源物。green模块内AAEL005810,AAEL007669,AAEL010214和AAEL013197在黑腹果蝇中的直系同源基因分别为CG14085,Antdh,CCDC151和CG4362;blue模块内hub基因在黑腹果蝇中均有直系同源物;turquoise模块内AAEL008595,AAEL000961和AAEL003226在黑腹果蝇中有直系同源基因,分别为Mael,Clos和Cpr49Aa-Cpr65Az;red模块内AAEL007033,AAEL000311和AAEL013417在黑腹果蝇中直系同源基因分别为P5cr-2,Fon和CG30280;magenta模块内AAEL006427,AAEL006429,AAEL017567和AAEL004944在黑腹果蝇中的直系同源基因分别为CG17571-thetaTry,thetaTry-CG17571,Nep5和Muc12Ea(Matthewsetal.,2016)。47个hub基因中,29个基因为已知功能基因。如与雌成蚊触角特异性相关的green模块中,共筛选出9个hub基因(表3),其中AAEL010426和AAEL001510被描述为气味受体家族基因(Heetal.,2015;Matthewsetal.,2016);AAEL014089属于离子受体家族基因;AAEL010214编码卷曲螺旋结构域蛋白,AAEL012424编码微管蛋白。与雌成蚊喙特异性相关的purple模块中,共筛选出6个hub基因(表3),其中AAEL000011和AAEL000039属于离子受体家族基因(Matthewsetal.,2016);AAEL002600,AAEL013033和AAEL013032被描述为丝氨酸蛋白酶家族基因(Bartholomayetal.,2004;Matthewsetal.,2016)。与雌成蚊下颚须特异性相关的red模块中,共筛选出9个hub基因(表3),其中AAEL011624属于丝氨酸蛋白酶家族基因,AAEL000044属于鸟氨酸脱羧酶家族基因,AAEL013417编码血管生成素相关蛋白(Matthewsetal.,2016);AAEL007033编码A-凝集素锚定亚基,AAEL003405为微管动态蛋白的调节因子,AAEL006920被描述为G蛋白偶联受体家族基因(Bartholomayetal.,2004;Matthewsetal.,2016)。筛选到的hub基因功能与组织功能相关,表明筛选到的基因较为可靠,但有的hub基因的报道研究甚少,提示后续可进一步通过blast,RT-PCR以及RNA干扰等手段对筛选到的hub基因功能进行预测和检验。Matthews等(2016)认为2个与氨转运有关的基因AAEL007373和AAEL008046可能参与埃及伊蚊寻找宿主过程中氨的检测,本研究WGCNA分析结果发现AAEL007373被划分到green模块,其在雌/雄蚊触角中高表达,AAEL008046被划分到blue模块,其在雌/雄蚊脑中高表达,这与Matthews等(2016)报道相符,此外,本研究构建了以这两个基因为核心的局部网络,揭示其基因网络关系(图5)。AAEL000252被报道为雌蚊富集表达基因(Matthewsetal.,2016),在本研究中被划分到turquoise模块,其在雌成蚊卵巢中高表达;AAEL010631被报道为雄蚊富集表达基因(Matthewsetal.,2016),被划分到magenta模块,其在雄成蚊腹部末端中高表达。
本研究是基于WGCNA方法和转录组数据对蚊虫不同组织基因共表达模式的首次探索。构建了埃及伊蚊成蚊9种组织加权基因共表达网络,获得了11个基因共表达模块,其中,6个模块与组织特异性相关。完成了组织特异性模块内基因的功能富集分析,发现这些模块的生物学功能均与对应组织功能密切相关。此外,鉴定了6个组织特异性模块内共47个hub基因,揭示了其基因互作网络关系。本研究结果可为蚊虫基因共表达模式分析提供方法基础,对探究蚊虫不同组织特有的基因资源信息以及功能基因生物信息研究有参考价值。

