罗耳阿太菌多糖对Cu2+和Cd2+的吸附工艺优化及表征
刘玉琪,李鸿梅,范春婷,闵伟红,高雅文
(吉林农业大学食品科学与工程学院,吉林长春 130118)
重金属造成的水污染是近年来最大的环境问题之一,土壤、农业用水的重金属污染尤为严重[1],它们可以积聚在动植物体内,通过食物链进入人体,对健康造成巨大的危害[2-3]。铜和镉是废水中最常见的两种重金属[4]。虽然铜是人体必需元素,但在体内过量积累也会带来严重的毒理学问题,如呕吐、痉挛、抽搐,甚至死亡[5]。镉是目前废水中发现毒性最大的重金属,会对呼吸系统和生殖系统造成危害[6-7],也可导致骨骼软化、肝中毒、肺癌等[8]。因此去除废水中的重金属成为近年来的研究热点,目前去除铜、镉的方法有化学沉淀、离子交换、生物吸附、膜过滤、电化学处理等[9-13],其中生物吸附是一种新型有效且经济环保的方法,受到众多学者关注[14]。
罗耳阿太菌多糖(Atheliarolfsiipolysaccharide,AEPS)是一种生物吸附剂,国内外学者研究表明,生物吸附可能是由静电吸附、络合、离子交换、表面沉淀[15]等引起的。2015年侯文洁[16]从苜蓿中华根瘤菌株中分离出胞外聚合物,发现铜离子主要以离子交换方式结合在胞外聚合物上。2018年Adam等[17]报道了从牛肝菌子实体中分离出碱性多糖,并通过吸附铅和镉离子试验证实了这种多糖具有良好的生物吸附能力。同年田月月等[18]研究了水溶性大豆多糖对铅离子的吸附,并通过动力学试验推测大豆多糖分子链的羧基是与铅离子吸附的主要基团。
本研究旨在采用正交试验优化AEPS吸附铜离子和镉离子,并通过扫描电子显微镜和X射线能谱仪及红外光谱初步揭示AEPS吸附铜离子和镉离子机理,为AEPS处理重金属污染的食品工业和农业用水的应用奠定基础。
1 材料与方法
1.1 材料与仪器
罗耳阿太菌 吉林农业大学发酵工程实验室提供;氯化钠、五水硫酸铜、四水硝酸镉、氢氧化钠、浓硫酸、苯酚 均为国产分析纯试剂;SephacrylTM S-400 High Resolution柱料 GE公司;超滤离心管(3000 Da) 美国Millipore公司。
电热恒温水槽 上海精宏实验设备有限公司;UV-1700紫外可见光分光光度计、Prestige-21傅里叶变换红外光谱仪、AA-6300原子吸收分光光度计 日本岛津公司;低温高速离心机 德国HERMLE公司;FD-1B-50冷冻干燥机 北京博医康实验仪器有限公司;旋转蒸发器 上海亚荣生化仪器厂;扫描电子显微镜、X-射线能谱仪 COXEM公司。
1.2 实验方法
1.2.1 重金属离子标准溶液的配制 Cu2+标准溶液:将3.9281 g CuSO4·5H2O溶于少量去离子水中,待完全溶解后,用容量瓶定容至1 L,得到Cu2+标准溶液(1 g/L),试验中逐级稀释使用。
Cd2+标准溶液:将2.7442 g Cd(NO3)2·4H2O溶于少量去离子水中,待完全溶解后,用容量瓶定容至1 L,得到Cd2+标准溶液(1 g/L),试验中逐级稀释使用。
1.2.2 罗耳阿太菌粗AEPS的提取与纯化 罗耳阿太菌发酵培养后,取发酵液调节pH至7~8,恒温80 ℃水浴30 min,冷却后4 ℃,8000 r/min离心5 min,上清液木瓜蛋白酶法除蛋白后醇沉,透析后冷冻干燥,得到粗AEPS粉备用[19]。
采用Sephacryl S400-HR柱料进行纯化,AEPS浓度1.5 g/L,上样量5 mL,以0.9%(w/w)氯化钠溶液洗脱5 h,流速0.5 mL/min。采用苯酚-硫酸法隔管检测AEPS含量,收集纯化后AEPS,浓缩透析冷冻干燥后用于后续分析[20]。
1.2.3 单因素实验
1.2.3.1 pH对Cu2+和Cd2+吸附率的影响 Cu2+和Cd2+溶液浓度为0.2 g/L(用标准溶液稀释得到),将AEPS溶液与等体积的重金属离子溶液混匀,AEPS浓度为1.5 g/L,调节Cu2+溶液pH(1、2、3、4、5),Cd2+溶液pH(1、2、3、4、5、6、7、8),30 ℃反应60 min,反应结束后,置于超滤离心管中4500 r/min离心30 min,取上清液稀释100倍后,采用火焰原子吸收法测定Cu2+和Cd2+残留量,每组样品3次平行。
1.2.3.2 AEPS初始浓度对Cu2+和Cd2+吸附率的影响 其他条件不变,Cu2+溶液pH为4,Cd2+溶液pH为6,AEPS溶液浓度分别为0.5、1、1.5、2、2.5 g/L,30 ℃反应60 min,每组样品3次平行。
1.2.3.3 吸附温度对Cu2+和Cd2+吸附率的影响 其他条件不变,AEPS浓度为1.5 g/L,Cu2+溶液pH为4,Cd2+溶液pH为6,在不同温度下(20、30、40、50、60 ℃)反应60 min,每组样品3次平行。
1.2.3.4 吸附时间对Cu2+和Cd2+吸附率的影响 其他条件不变,AEPS浓度为1.5 g/L,Cu2+溶液pH为4,Cd2+溶液pH为6,40 ℃反应15、30、45、60、75、90 min,每组样品3次平行。
1.2.4 正交试验 在单因素实验的基础上,选取pH、AEPS浓度、温度、吸附时间为自变量,以Cu2+和Cd2+吸附率为因变量,进行正交试验设计,确定AEPS吸附Cu2+和Cd2+的最优工艺条件。

表1 AEPS吸附Cu2+正交试验设计

表2 AEPS吸附Cd2+正交试验设计
1.2.5 吸附率的测定 铜离子和镉离子残留量采用《水和废水监测分析方法》中直接吸入火焰原子吸收法检测,吸附率按照以下公式进行计算。
式中:Y为重金属离子吸附率,%;Ci为混合液中重金属离子的初始浓度,g/L;Cf为混合液中重金属离子的平衡浓度,g/L。
1.2.6 SEM和EDS分析 用导电胶粘合剂固定好吸附前后的AEPS,镀上金粉,利用扫描电子显微镜和X-射线能谱分析仪对样品进行扫描观察[21]。
1.2.7 红外光谱分析 KBr于150 ℃烘箱中干燥4 h,称取1 mg吸附Cu2+和Cd2+前后的AEPS样品分别与100 mg干燥后的KBr混合。将混合物精细研磨然后压片。选定波长范围在4000~400 cm-1,分辨率为4 cm-1,光阑设置8 mm,描时间16 s,测红外光谱[22]。
1.3 数据处理
2 结果与分析
2.1 AEPS的纯化
如图1所示,AEPS经过Sephacryl S400-HR分离纯化后,获得两个不同组分AEPSⅠ和AEPSⅡ,两个组分呈现单一、尖锐、对称峰型,且没有拖尾现象,说明两个组分较为专一。收集两个组分多糖用于后续分析。

图1 Sephacryl S400-HR洗脱曲线
2.2 单因素实验结果
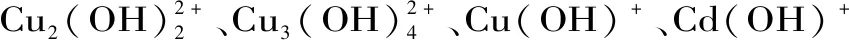

图2 pH对Cu2+和Cd2+吸附率的影响
2.2.2 AEPS初始浓度对Cu2+和Cd2+吸附率的影响 由图3可知,当AEPS初始浓度在0.5~1.5 g/L时,Cu2+和Cd2+吸附率随着AEPS初始浓度的增加而增大,AEPS初始浓度在1.5 g/L时达到最大值,Cu2+为84.0%,Cd2+为75.52%,随着AEPS初始浓度的继续增大,Cu2+和Cd2+吸附率缓慢下降。AEPS初始浓度也是影响重金属离子吸附的另一个重要条件,当AEPS浓度过低时,不能提供足够的供金属离子结合的位点,当浓度过高时,AEPS提供的吸附位点过饱和,但结合的重金属离子不稳定,而且吸附剂单位质量吸附的重金属离子减少[29],导致吸附率略有下降。因此,选择AEPS初始浓度1.3、1.5、1.7 g/L为Cu2+和Cd2+吸附正交试验的三个水平。

图3 AEPS初始浓度对Cu2+和Cd2+吸附率的影响
2.2.3 吸附温度对Cu2+和Cd2+吸附率的影响结果 由图4可知,当吸附温度在20~40 ℃时,Cu2+和Cd2+吸附率随着吸附温度的升高而增大,吸附温度在40 ℃时达到最大值,Cu2+吸附率为86.72%,Cd2+吸附率为75.31%,随着吸附温度的继续升高,Cu2+和Cd2+吸附率缓慢下降。这可能是由于温度的升高使AEPS分子中部分官能团的键发生断裂,AEPS的分子活性增强,重金属离子之间的分子动能增加,吸附率升高。但温度过高,AEPS生物活性会减弱,吸附率下降[30]。因此,选择反应温度35、40、45 ℃为Cu2+和Cd2+吸附正交试验的三个水平。

图4 吸附温度对Cu2+和Cd2+吸附率的影响
2.2.4 吸附时间对Cu2+和Cd2+吸附率的影响结果 由图5可知,当吸附时间在0~45 min时,Cu2+吸附率随着吸附时间的增大而增大,吸附时间在45 min时达到最大值85.24%,随着吸附时间的继续增大,Cu2+吸附率轻微下降;当吸附时间在0~60 min时,Cd2+吸附率随着吸附时间的增大而增大,吸附时间在60 min时达到最大值75.09%,随着吸附时间的继续增大,Cd2+吸附率缓慢下降。因此,选择时间40、45、50 min为Cu2+吸附正交试验的三个水平,选择时间55、60、65 min为Cd2+吸附正交试验的三个水平。
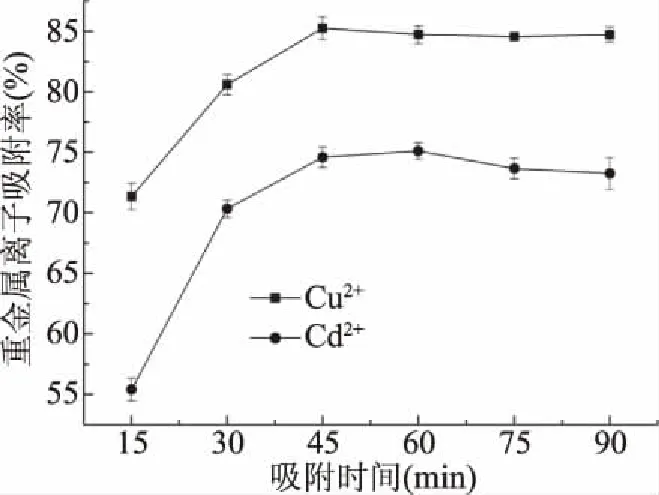
图5 吸附时间对Cu2+和Cd2+吸附率的影响
2.3 正交试验优化
如表3所示,通过极差分析可知A、B、C、D四个因素影响AEPS吸附Cu2+的主次顺序是B>A>D>C,即AEPS初始浓度>pH>吸附时间>吸附温度。由表4可知,AEPS初始浓度、pH和吸附时间对Cu2+吸附有极显著(P<0.01)影响,最佳吸附条件为A3B2C2D2,取最佳条件进行验证实验,AEPS吸附率为88.27%,即pH4.5,AEPS浓度1.5 g/L,吸附温度40 ℃,吸附时间45 min,最佳吸附率为88.27%。

表3 AEPS吸附Cu2+正交试验优化

表4 AEPS吸附Cu2+正交试验方差分析表
如表5所示,通过极差分析可知A、B、C、D四个因素影响AEPS吸附Cd2+的主次顺序是B>A>D>C,即AEPS初始浓度>pH>吸附时间>吸附温度。由表6可知,AEPS初始浓度和pH对Cd2+吸附有极显著(P<0.01)影响,吸附时间对Cd2+吸附有显著(P<0.05)影响,最佳吸附条件为A3B2C3D2,取最佳条件进行验证实验,AEPS吸附率为77.81%,即pH6.5,AEPS浓度1.5 g/L,吸附温度45 ℃,吸附时间60 min,此时对应的吸附率为77.81%。由AEPS对Cu2+和Cd2+的吸附最优条件中可以看出,对两种重金属离子吸附影响因素最主要的是吸附pH不同,在Cu2+的最优条件下Cd2+也有吸附效果,但在Cd2+的最优条件下pH为6.5,在此pH下Cu2+会产生沉淀。因此若对溶液中同时存在Cu2+和Cd2+时,可以采用先在Cu2+的最优条件下吸附Cu2+,使Cu2+的吸附率达到最高,然后调整溶液pH,温度等条件以达到Cd2+的最优条件,在此条件下吸附Cd2+。

表5 AEPS吸附Cd2+正交试验优化

表6 AEPS吸附Cd2+正交试验方差分析表
2.4 外貌观察
如图6所示,经过真空冻干后,AEPS吸附重金属离子前后外貌存在明显差异,A为AEPS,冻干后为淡黄色絮状物质,结构紧密;B为AEPS-Cu,冻干后结构松散,呈颗粒和碎片状,颜色略微偏蓝;C为AEPS-Cd,冻干后状态和AEPS-Cu相似,颜色较AEPS偏浅。

图6 AEPS、AEPS-Cu和AEPS-Cd外貌观察
2.5 扫描电子显微镜分析
如图7所示,图7A~图7F显示了AEPS、AEPS-Cu和AEPS-Cd在扫描电子显微镜下的表面形态,吸附前(图7A、图7B),AEPS结构以薄片为主,伴有一些碎片状和杆状形态,并且表面平整无其他物质存在。吸附Cu2+和Cd2+后(图7C~图7F),AEPS表面不平整,以碎片状和杆状为主,这和吸附后(图6)外貌观察结果一致,在5000倍放大倍数下观察,发现AEPS表面变粗糙,明显看到有其他物质存在,这可能是因为Cu2+和Cd2+吸附于AEPS表面,导致表面结构发生了变化。

图7 AEPS、AEPS-Cu和AEPS-Cd的SEM观察
2.6 X-射线能谱分析
对AEPS、AEPS-Cu和AEPS-Cd进行EDS观察,结果如图8~图10所示,由图8可知,AEPS吸附金属离子前,AEPS中主要元素为C、N、O,还有少数Na、Mg、P、S、Cl存在,这可能是由于在罗耳阿太菌发酵过程中,发酵培养基中含有柠檬酸、MgSO4·7H2O、KCl,AEPS在发酵和提取过程中吸附了这些离子。由图9、图10可知,AEPS吸附Cu2+后,谱图中出现了之前没有的Cu和Cd元素,说明AEPS成功吸附了Cu2+和Cd2+,根据能谱峰强度来看,AEPS、AEPS-Cu和AEPS-Cd各个元素含量都不一样,这可能是由于EDS结果取决于AEPS的孔隙率和表面均匀性[31],并且由峰的面积可知,AEPS吸附Cu2+的能力大于Cd2+的能力,除了pH、多糖浓度等影响因素外,还可能是因为Cd2+的原子半径比Cu2+的大,Cu2+更有利于AEPS的吸附[32],该结果与AEPS-Cu和AEPS-Cd的单因素和正交试验结果相吻合。

图8 AEPS X射线能谱仪分析

图9 AEPS-Cu X射线能谱仪分析

图10 AEPS-Cd X射线能谱仪分析
2.7 红外光谱分析
AEPS吸附Cu2+和Cd2+前后的红外光谱如图11所示,多糖具有典型的特征吸收峰,对于AEPS,3392.63 cm-1处的吸收峰是O-H的伸缩振动产生的,这是多糖的主要官能团,2929.74 cm-1处的吸收峰是C-H的伸缩振动吸收峰,AEPS吸附Cu2+和Cd2+后,O-H的吸收峰分别移动至3398.42和3388.71 cm-1,C-H的吸收峰移动至2933.67 cm-1,这可能是由于吸附作用,Cu2+和Cd2+取代了官能团中的H所导致;1240.17 cm-1处的吸收峰是C-H变角振动引起的吸收峰,由图谱可以看出AEPS-Cu和AEPS-Cd在此处的峰明显增强;1080.09 cm-1处的吸收峰是由两种C-O伸缩振动引起的吸收峰,AEPS-Cu移动至1112.88 cm-1,且峰型明显变宽,AEPS-Cd移动至1078.16 cm-1,峰型与AEPS-Cu相比较窄,说明AEPS吸附Cu2+能力强于Cd2+;900~800 cm-1处的吸收峰是β型C-H变角振动的特征吸收峰,这与AEPS是β型葡聚糖结论一致[33],且吸附金属离子后,该吸收峰都明显增强;600~400 cm-1处的吸收峰主要是CCO变形振动吸收峰,由图11可以看出,AEPS在468.68 cm-1有吸收峰,而在AEPS-Cu和AEPS-Cd谱图中消失了,这可能是由于金属离子的加入将其双键结构打破导致的。通过FTIR分析可以发现,AEPS中的羟基、羧基等官能团参与了反应。Liu[34]报道多糖吸重金属离子的主要机理是通过羟基、羧基和酰胺基团的络合反应,Wei等[35]研究发现,羧酸中的羰基、酚类碳氢键和酰胺基团的拉伸和振动在重金属吸附中起着重要作用,而Dang等[36]则发现羧基基团的去质子化形式的静电吸附和非离子化羟基与重金属离子的络合作用也是一种重要的吸附机理。推测AEPS吸附Cu2+和Cd2+的主要机理是Cu2+和Cd2+取代了O-H和C-H官能团中的H+,并与C-O官能团发生了络合反应,同时打破了CCO官能团中的双键,这些反应的发生使得AEPS能够很好地吸附Cu2+和Cd2+。

图11 AEPS、AEPS-Cu和AEPS-Cd红外光谱分析
3 结论
AEPS吸附Cu2+最优工艺为pH4.5,AEPS浓度1.5 g/L,吸附温度40 ℃,吸附时间45 min,吸附率为88.27%;AEPS吸附Cd2+最优工艺为pH6.5,多糖浓度1.5 g/L,吸附温度45 ℃,吸附时间60 min,吸附率为77.81%。扫描电子显微镜和X射线能谱仪结果表明,AEPS为薄片和杆状结构,吸附Cu2+和Cd2+后表面变粗糙,以杆状和碎片为主,并在能谱图中出现Cu和Cd元素峰。红外光谱结果表明,AEPS中的O-H、C-H、C-O和CCO官能团和Cu2+、Cd2+之间产生静电吸附和络合作用,是吸附反应的关键基团。本文研究的结果,为AEPS处理重金属污染的食品工业和农业用水提供了可参考的理论依据。

