山茱萸籽粕亚临界水降解动力学及多糖性质研究
何坤明,陈兰转,孙光友,谭旺桥,白新鹏,*
(1.海南大学食品科学与工程学院,热带多糖资源利用教育部工程研究中心,海南海口 570228;2.海南雅葆天维实业股份有限公司,海南海口 570000;3.海南大白康健医药股份有限公司,海南海口 570000)
山茱萸(CornusofficinalisSieb.et Zucc.)属于山茱萸科山茱萸属植物,产于河北、河南等地。山茱萸果肉中含有山萸甙、没食子酸、皂甙、熊果酸等活性成分,维生素、氨基酸和矿物质种类也十分丰富,应用于六味地黄丸的研制[1]。山茱萸籽是山茱萸果剥去山茱萸果肉剩下的果核,其栲胶、油脂、蛋白、糖类物质含量相当丰富[2-4]。
近年来植物多糖已成为实验研究的热点,多糖提取、纯化[5-6]及抗氧化、抗肿瘤[7]等研究较多。山茱萸籽中的糖类物质相当丰富,大量的山茱萸籽中的糖类物质未得到合理的利用,造成植物多糖资源的浪费;废物资源再利用一方面可以获得多糖等副产品,一方面促进种植户增收。故本实验对山茱萸籽多糖进行提取,并对其理化性质进行研究。
多糖提取是基于相似相溶原理将多糖从生物体里分离出来的过程。常用的多糖提取方法有水提取法[8]、超声波辅助提取法[9]、酸碱提取法等。水提取法提取率低、耗时长,酸碱提取法则易破坏多糖的空间结构及其生物活性[10]。而亚临界水提取法则具有绿色环保、得率高、省时、产物结构稳定等优点。
亚临界水是指温度在沸点和临界温度之间,维持在适当压力状态的水[11]。亚临界水提取技术作为一种新型绿色提取技术,目前在多糖、多酚、黄酮和花青素等天然产物提取得到广泛应用[12]。杜晓静等[13]利用亚临界水降解脱脂椰蓉制备可溶性膳食纤维发现,与酶-化学法、超声-化学法对比,亚临界水提取具有较高的得率。李振梅等[14]利用亚临界水同步提取茶籽油及茶皂素的工艺,通过气相色谱-质谱法分析发现,与索氏提取法相比,实验提取的茶籽油不饱和脂肪酸含量更高,表明亚临界水法提取的茶籽油品质更优,进一步证实了亚临界水提取装置的高效性。马若影等[15]利用亚临界水提取红心火龙果茎多糖发现,对比超声辅助法提取红心火龙果茎多糖,亚临界水提取多糖具有得率高、省时等优点。
本研究以山茱萸籽粕为原料,建立山茱萸籽粕亚临界水降解动力学模型,得到降解动力学参数,通过亚临界水提取,进一步分离得山茱萸籽多糖,对其理化性质、形态、结构组成、抗氧化活性等方面进行了初步研究,为山茱萸籽的综合开发利用提供参考。
1 材料与方法
1.1 材料与仪器
山茱萸籽 购于河南南阳(西峡县山茱萸种植基地,2018年10月);无水乙醇、葡萄糖、碳酸钠、石油醚 西陇科学股份公司;没食子酸、浓硫酸、苯酚 广州化学试剂厂;福林酚试剂 北京索莱宝科技有限公司;以上试剂均为分析纯。
HT-250FC型亚临界水设备 上海霍桐实验仪器有限公司;GL-20G-11型高速冷冻离心机 上海安亭科学仪器厂;752N型紫外可见分光光度计 上海仪电分析仪器有限公司;FDU-2100型冷冻干燥机 埃朗科技国际贸易(上海)有限公司;Agilent1100高效液相色谱仪,配DAD检测器 安捷伦科技有限公司。
1.2 实验方法
1.2.1 山茱萸籽粕成分测定 山茱萸籽80 ℃烘干、粉碎过60目筛,索氏提取脱脂得山茱萸籽粕,干燥器中保存备用。
水分测定:GB 5009.3-2010,灰分测定:GB 5009.4-2016,纤维素、半纤维素、木质素测定:范式Van Soest分析法[16]。
1.2.2 亚临界水降解山茱萸籽粕实验研究 精确称取山茱萸籽粕5.0 g,量取200 mL蒸馏水,放入亚临界反应釜中,按照设定的降解温度、降解时间,对山茱萸籽粕进行亚临界水降解,降解结束,迅速用冰块冷却至常温,抽滤得残渣和液态产物,残渣烘干干燥器保存备用,液态产物于棕色试剂瓶保存备用。
考察不同降解温度(100、120、140、160、180、200 ℃)和不同降解时间(5、10、20、30、40、50 min)的条件下,固定单因素条件为160 ℃、降解时间20 min,对山茱萸籽粕亚临界水降解还原糖产率进行实验研究。
1.2.3 液态产物中还原糖产率测定 采用3,5-二硝基水杨酸法[17]测定液态产物中还原糖浓度,以葡萄糖为标准品,在波长540 nm处测定液态产物的吸光度值,标准曲线为y=11.014x+0.0373(决定系数R2=0.9948,线性范围在0~0.10 μg/mL)。其还原糖产率计算公式如下:
式(1)
式中:C为还原糖浓度(g/L);m0为山茱萸籽粕中半纤维素含量(g);V为液态产物总体积(mL);n为稀释倍数。
1.2.4 动力学模型建立 目前,国内外研究学者采用Saeman模型对木质纤维素类进行亚临界水降解实验研究[18-20],主要反应过程如下:
半纤维素→低聚糖→单糖→降解物
本实验探究山茱萸籽粕在亚临界水中其纤维素、半纤维素类物质降解为小分子还原糖,最终得到降解产物。在动力学方程中,还原糖的量为水解糖的总量,建立一级连串均相反应模型。
山茱萸籽粕(h)→还原糖(s)→降解物(d)
式(2)
式(3)
式中:k1为山茱萸籽粕降解为还原糖的反应速率常数(min-1);k2为还原糖分解的反应速率常数(min-1);Ch为山茱萸籽粕半纤维素浓度(g/L);Cs为山茱萸籽粕还原糖浓度(g/L)。设t=0时,Cs为0,对式(2)和(3)进行积分得:
Ch=Ch0exp(-k1t)
式(4)
式(5)
1.2.5 动力学参数的确定 将山茱萸籽粕降解实验数据Ch、Cs、Cd代入式(6),通过曲线拟合求解得出100、120、140、160、180、200 ℃的速率常数k1和k2,将k1和k2数值代入Arrhenius方程[21]:
式(6)
式中,Ch0代表山茱萸籽粕降解前的半纤维素浓度(g/L)。
式(7)
式中:Ki0为指前因子(min-1);T为降解温度(K);R为气体常数;Eai为反应活化能(kJ/mol)。
式(7)取对数得:lnki=lnki0-Eai/(RT),可以看出lnki与T-1是线性关系,对lnki与T-1作一条拟合的直线,得到拟合直线方程,方程的截距为Ki0,斜率为Eai。
1.2.6 山茱萸籽粕残渣形态、转化率及液态产物pH变化 为进一步分析判断山茱萸籽粕亚临界水降解程度,对山茱萸籽粕残渣形态、转化率及液态产物pH变化进行观察、测定。采用电镜扫描观察在降解温度100、120、140、160、180、200 ℃及降解时间5、10、20、30、40、50 min降解后残渣形态的变化,并计算其转化率。液态产物pH测定采用pH计。
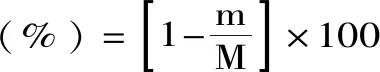
式(8)
式中:m为降解后残渣质量(g);M为原料质量(g)
1.2.7 液态产物山茱萸籽多糖单糖组成分析 取液态产物浓缩至原体积1/5左右,加入4倍体积的无水乙醇,4 ℃放置12 h,6000 r/min离心5 min,沉淀冷冻干燥得到山茱萸籽多糖[22]。
称取10 mg多糖样品于20 mL的钳口瓶中,加入5 mL的2 mol/L TFA,充N2封管(10 L/min,1 min),100 ℃烘箱中水解2 h;冷却后打开盖,取1 mL水解液加入1 mL甲醇后,70 ℃水浴下用N2吹干,如此重复加甲醇并用N2吹干2次,以去除TFA;加入1 mL NaOH(0.3 mol/L)充分溶解残渣,为多糖水解液,稀释后衍生测定。
游离单糖的提取:称取多糖干样0.4 g、多糖湿样1.5 g于具塞刻度管中,加入10 mL 80%乙醇,70 ℃下超声提取30 min;10000 r/min离心,取上清液用80%乙醇定容至10 mL,然后取2 mL加入试管N2吹干,之后加入1 mL NaOH(0.3 mol/L)溶解残渣。
单糖衍生化:分别取400 μL的混合单糖标准液或多糖水解液于5 mL的具塞试管中,加400 μL PMP甲醇溶液,于70 ℃水浴2 h;取出放置至常温;加400 μL HCl(0.3 mol/L)于混合液,至pH6~7;加蒸馏水1200 μL,再加等体积的氯仿溶液,涡旋混匀振摇,静置,分离水相,重复2次以上。采用0.45 μm微孔膜(水系)过滤水相,然后供HPLC进样分析。
色谱条件:色谱柱C18柱,250 mm×4.6 mm,粒度5 μm;流动相A:100 mmol/L 磷酸钠缓冲液(pH=6.4);流动相B:乙腈;进样量20 μL;检测波长:250 nm;柱温30 ℃;流速1 mL/min。
1.2.8 傅里叶红外光谱分析 将山茱萸籽多糖和KBr按比例1∶40混合研磨,压片机压片。样品测试前进行背景扫描去除干扰,500~4000 cm-1范围内进行空白扫描。
1.2.9 扫描电镜分析 取1 mg山茱萸籽多糖,粘在扫描电镜样品盘上,用吹尘球吹掉多余样品,喷金,观察样品表观结构。
1.2.10 抗氧化活性分析
1.2.10.1 DPPH自由基清除率测定 参考Vilma等[23]的方法,将3 mL乙醇溶解的DPPH(0.1 mmol/L)溶液加入到不同质量浓度(0、0.2、0.4、0.6、0.8和1.0 mg/mL)的2 mL多糖样品溶液中。将溶液摇匀,避光水浴30 min,在517 nm处测定吸光值。
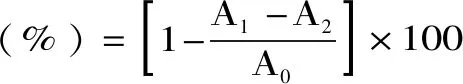
式(9)
式中,A1为样品或VC+3 mL DPPH溶液的吸光值;A2为待测溶液+3 mL无水乙醇后的吸光值;A0为空白对照,2 mL的蒸馏水+3 mL DPPH溶液的吸光值。
1.2.10.2 羟自由基清除率测定 参考王新等[24]的方法,分别在2 mL不同质量浓度(0、0.2、0.4、0.6、0.8和1.0 mg/mL)多糖样品溶液中加入1 mL FeSO4(6 mmol/L)溶液和1 mL H2O2(6 mmol/L),静置10 min,然后加入1 mL无水乙醇(6 mmol/L)溶解的水杨酸,静置反应30 min,在510 nm处测定吸光值。
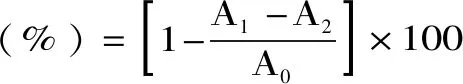
式(10)
式中,A1为样品或者VC溶液反应后的吸光值;A2为待测溶液+2 mL蒸馏水+1 mL无水乙醇后的吸光值;A0为空白对照,即2 mL的待测溶液换为2 mL的蒸馏水后的吸光值。
1.2.10.3 ABTS自由基清除率测定 参考管瑛等[25-26]的方法,称取0.384 g ABTS和0.066 g过硫酸钾,蒸馏水溶解定容至100 mL,然后在室温下避光静置12 h。将10 mL ABTS溶液用0.01 mol/L pH7.4 PBS缓冲液稀释50倍,使其在734 nm处的吸光度值约为0.7。将1 mL不同浓度的样品溶液转移到1 mL蒸馏水和2 mL稀释的ABTS溶液中,摇匀,置于室温黑暗中静置6 min,然后在734 nm处测量吸收值。

表1 原料及残渣的主要成分(%)
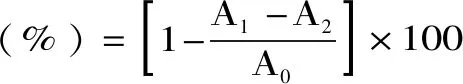
式(11)
式中:A1为样品或者VC溶液与ABTS溶液反应后的吸光值;A2为待测溶液+3 mL蒸馏水的吸光值;A0为空白对照,即1 mL的待测溶液换为1 mL的蒸馏水后的吸光值。
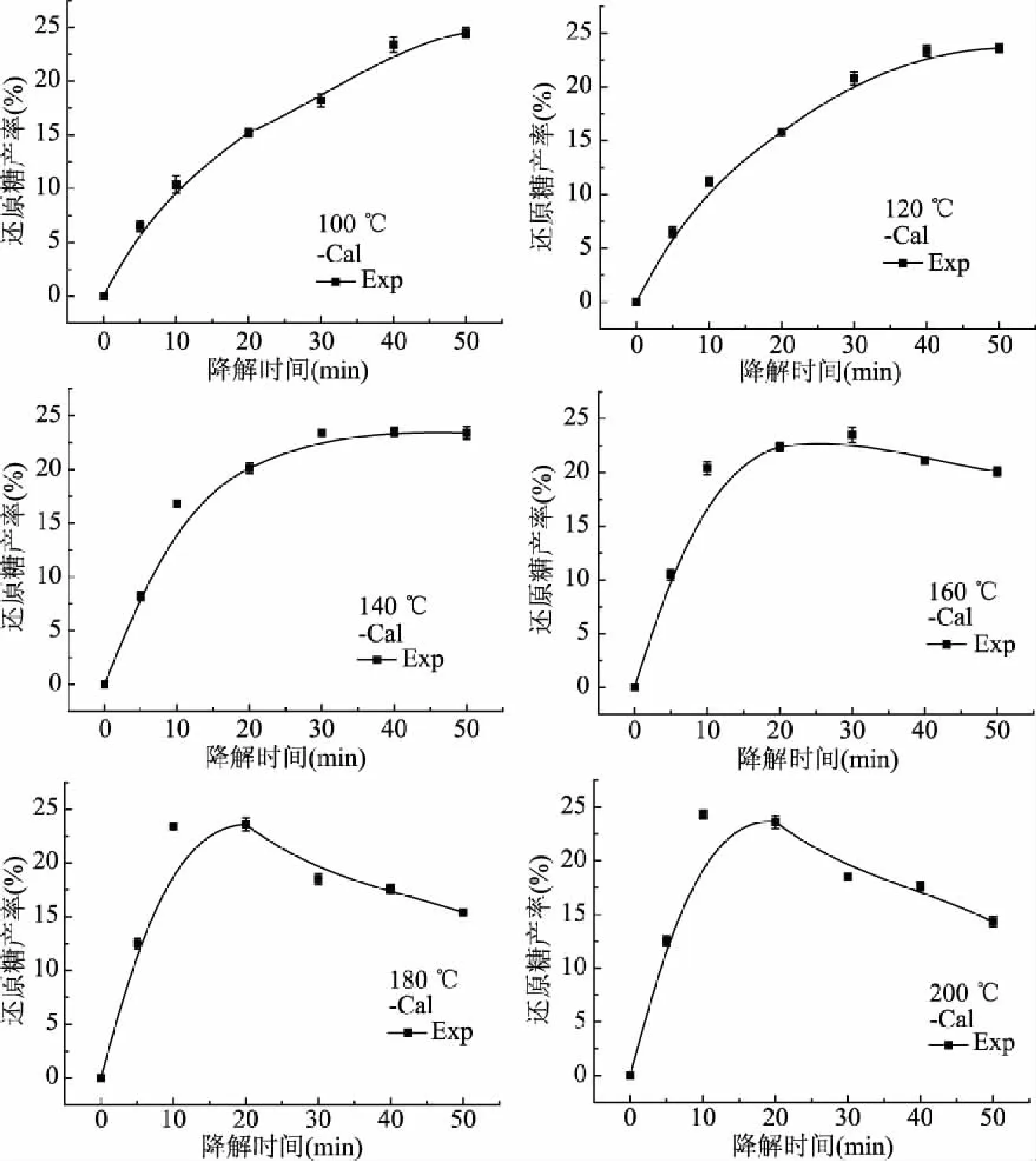
图1 不同降解温度下的还原糖产率
1.3 数据处理
采用Excel 2010软件进行数据统计处理,所有数据为3次重复的平均值和标准差。采用Origin软件进行绘图。
2 结果与分析
2.1 原料及降解残渣主要成分分析
利用范式分析法及国标测定原料(山茱萸籽粕)和160 ℃、20 min降解条件下的残渣主要成分,结果如表1所示,由表1可知,本实验降解的主要成分是半纤维素,原因是在亚临界水条件下(160 ℃、20 min)引起山茱萸籽粕中半纤维素降解为还原糖。纤维素的质量分数由20.34%升至45.10%,原因可能是山茱萸籽粕在亚临界水降解下,植物细胞壁等结构受到破坏,导致更多的纤维素裸露。
2.2 亚临界水动力学参数的确定
不同降解温度、降解时间下,实验值(Exp)与模型计算值(Cal)见图1,对于本实验探究的降解温度,实验值与模型计算值较为接近,说明Saeman模型能很好解释山茱萸籽粕亚临界水降解过程,其半纤维素降解遵循一级连串降解反应动力学模型。在100、120、140 ℃降解温度时,随着时间延长,还原糖产率逐渐增大,当温度在160 ℃以上时,还原糖产率随着时间延长呈现先增大后降低趋势。可能是在高温状态下,山茱萸籽粕中的半纤维素在短时间内大部分降解完毕,而还原糖产量下降可能是山茱萸籽粕中的半纤维素基本降解完全,此时的温度又不足以打断纤维素的糖苷键,因此还原糖生成量低于其降解量[27]。
由图1可知,180和200 ℃温度下,还原糖产率达到最大值时,时间太短,然后急剧下降。在100~160 ℃温度中,相同时间内,160 ℃下还原糖产率较高,故选取降解温度为160 ℃、降解时间为20 min。
将山茱萸籽粕降解的实验数据代入式(6),通过拟合得到100~200 ℃下的k1和k2。结果如表2所示,其中R2为曲线拟合决定系数。
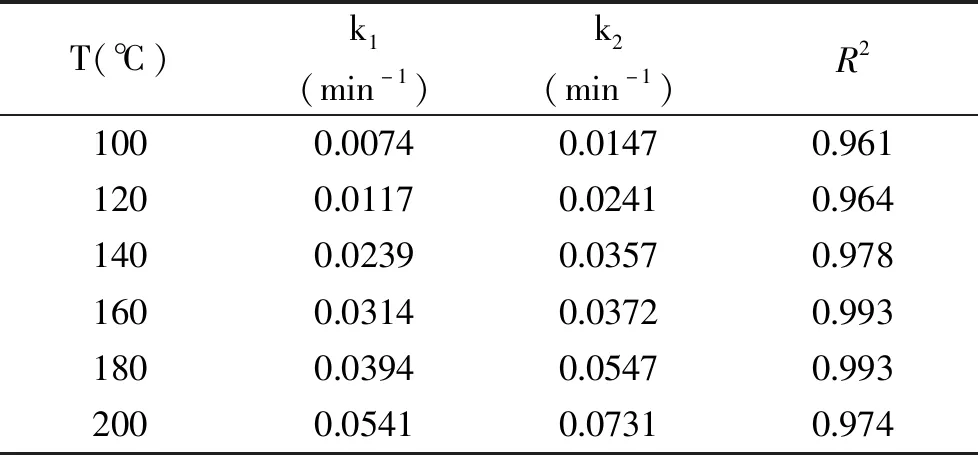
表2 山茱萸籽粕在不同温度下亚临界水降解的k1和k2值
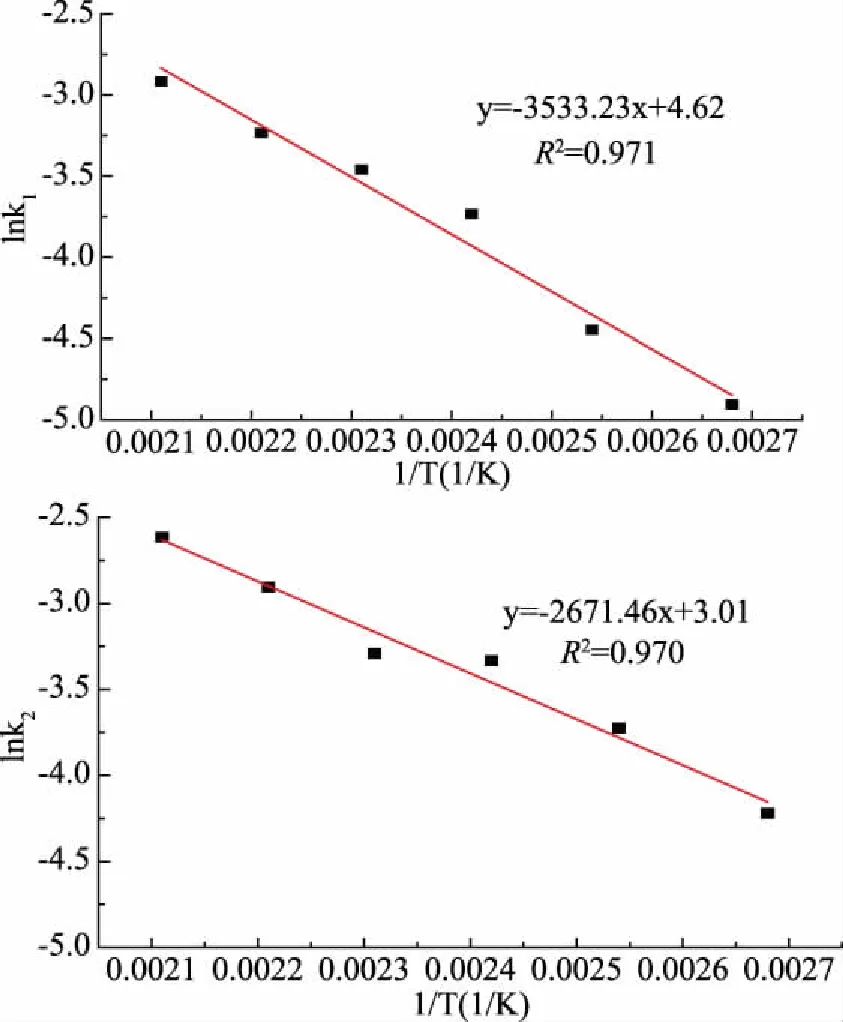
图2 山茱萸籽粕亚临界水降解lnk与1/T的关系
取拟合直线方程的截距和斜率分别用于求Ki0和Eai,结果如表3所示:

表3 山茱萸籽粕亚临界水降解的指前因子和反应活化能
2.3 山茱萸籽粕残渣形态变化
原料和在降解时间20 min条件下,不同降解温度下的残渣扫描电镜变化如图3可知,山茱萸籽粕原料堆叠呈无规则颗粒状,粒径大小不一的球状结构物。经100 ℃降解后,结构表面呈多孔状,覆盖在表面的球状物发生脱落,早期骨架形成。120 ℃降解后,残渣结构出现片状结构物,覆盖在结构表面的球状物完全脱落。140 ℃降解后,残渣结构呈现多孔状,但骨架较为紧凑。160~180 ℃降解后,残渣结构开始出现疏松多孔状,骨架也出现了断裂,无规则状。200 ℃降解后,残渣结构连接物断裂,呈稀碎、无规则堆积状[28]。

图3 原料和不同降解温度下的残渣扫描电镜图(2000×)
在降解温度160 ℃、料液比为1∶40条件下,原料和不同降解时间下的残渣扫描电镜变化如图4可知,与原料相比,不同降解时间,残渣结构表观各不相同,5 min时初步生成片状物,球状物出现脱落。10 min时骨架基本形成,架构较为紧密。20 min时球状物基本完全脱落,呈现多孔状,但骨架较为紧凑。30~50 min时骨架基本断裂,呈稀碎、无规则堆积状。

图4 原料和不同降解时间下的残渣扫描电镜图(2000×)
2.4 山茱萸籽粕转化率的变化
为进一步分析判断山茱萸籽粕亚临界水降解程度,对其不同温度、不同时间条件下的转化率进行测定。由图5可知,降解温度、降解时间对山茱萸籽粕亚临界水降解有着显著的影响,不同温度下的转化率在刚开始时差异显著的原因是在短时间内,随着降解温度升高,山茱萸籽粕亚临界水降解程度增大,山茱萸籽粕结构被破坏程度增大,多糖、蛋白质等大分子发生更大程度溶出。当降解时间为5 min时,降解温度由100 ℃提高到200 ℃,转化率由35.20%提高到65.21%,转化率提高了46.02%。当降解时间为50 min时,降解温度由100 ℃提高到200 ℃,转化率由44.90%提高到67.10%,转化率提高了33.08%。原因可能是随着降解温度升高和降解时间延长,山茱萸籽粕空间结构发生变化,由原来堆叠紧密变为疏松多孔状,其表面的球状物多糖、蛋白质等分子溶出。
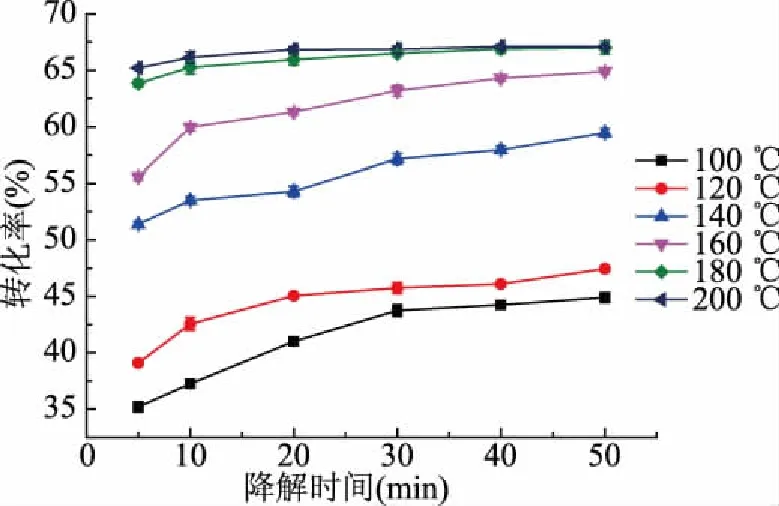
图5 降解温度和时间对山茱萸籽粕转化率的影响
2.5 液态产物pH的变化
液态产物pH测定能进一步判断山茱萸籽粕亚临界水降解程度大小。由图6可知,随着降解时间的增长,液态产物pH逐渐下降,在前20 min内下降趋势较显著,20 min后下降趋势较为平缓,甚至保持不变。降解温度越高,pH下降趋势越显著,原因可能是在亚临界水降解下,温度越高,水分直接相互作用越强烈,从而加速催化降解速率,山茱萸籽粕结构被破坏程度增大,对应还原糖产率略微升高,半纤维素分解速率略微增大。pH下降原因与山茱萸籽粕的半纤维素中含有乙酰基团,反应初期水解产生大量乙酸有关[29-31]。
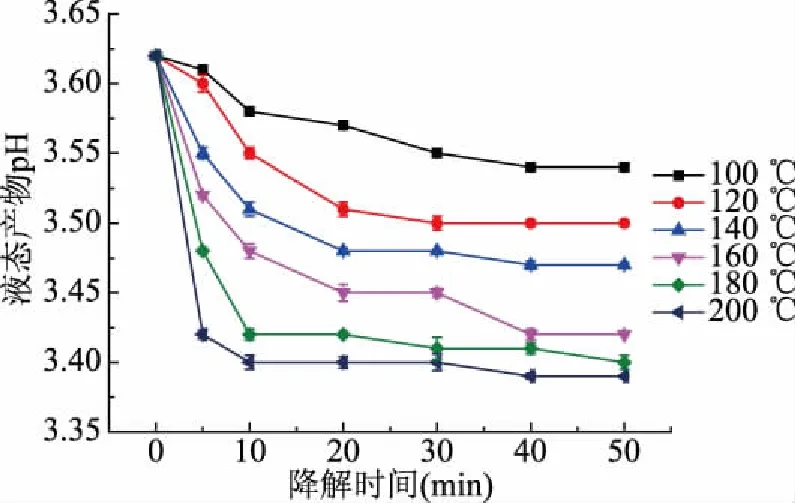
图6 液态产物pH的变化
2.6 山茱萸籽多糖单糖组成
单糖组成的分析在植物多糖的结构与功效、中药材的检测与鉴定等方面有着十分重要的作用[32],为了进一步探究山茱萸籽多糖的结构与功效,对其多糖组成进行进一步分析。多糖标品的高效液相色谱图见图7。由表4和图8可知,山茱萸籽多糖单糖组成中葡萄糖含量最高,含量达33.58%,其次是木糖,含量16.75%,半乳糖含量14.54%。
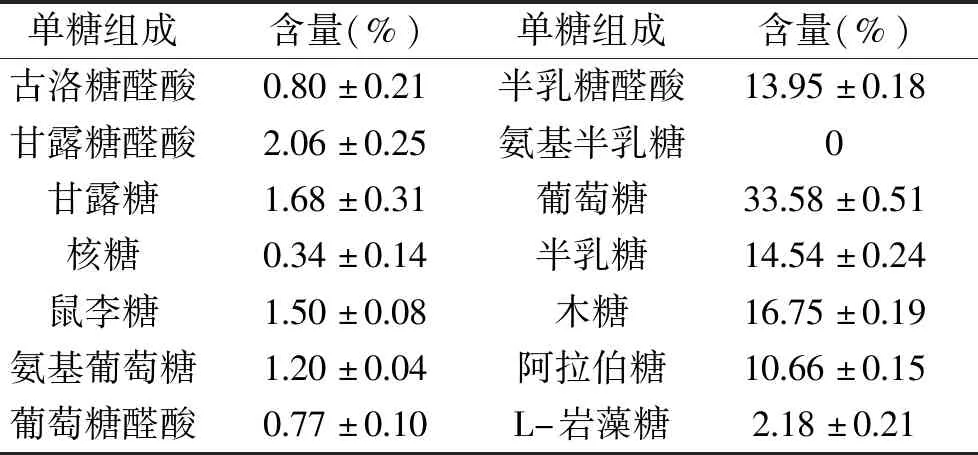
表4 山茱萸籽多糖的单糖组成
图7 多糖标品的高效液相色谱图
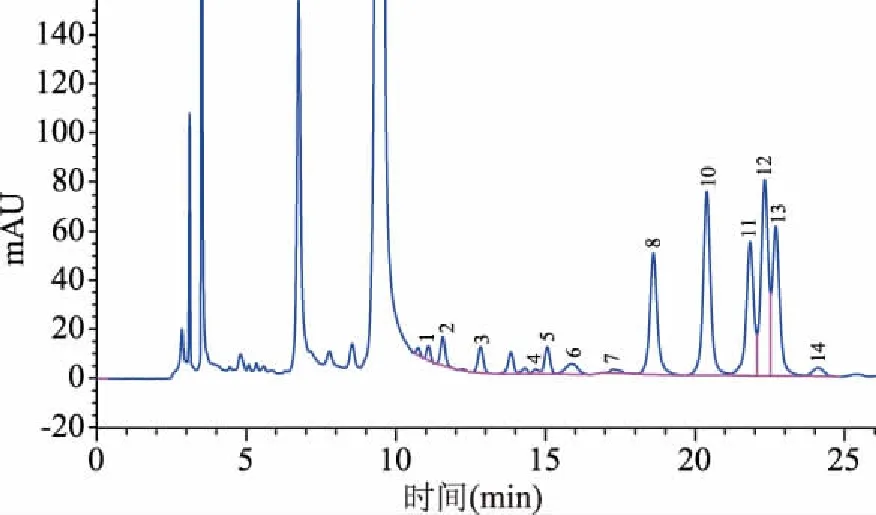
图8 山茱萸籽多糖的单糖组成
2.7 傅里叶红外光谱分析
从图9可以看出,山茱萸多糖在4000~500 cm-1区域具有多糖吸收的一般特征。在3424 cm-1处,由于多糖间羟基的O-H伸缩振动,导致吸收峰宽而强。1618.29 cm-1处的弱吸收峰为结合水的多糖水化振动吸收峰。1341.04 cm-1处的弱吸收峰为烷基的C-H变角度振动吸收峰。1150~1050 cm-1的前缘为吡喃糖苷环骨架的C-O可变角度振动吸收峰,说明分子中存在C-O-H和C-O-C结构[33]。757.90 cm-1处出现一个微弱的吸收峰,推测其含有吡喃糖环结构[34],且由单糖组成分析可知,其含有葡萄糖、半乳糖等具有吡喃环结构的糖苷键。
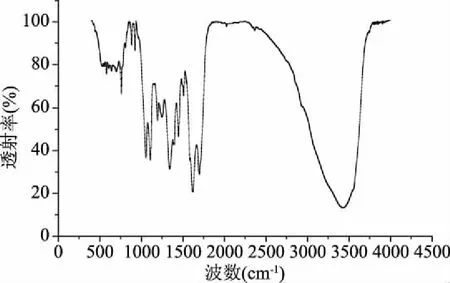
图9 山茱萸籽多糖的红外吸收光谱图

图10 山茱萸籽多糖扫描电镜图(左700×、右2000×)
2.8 扫描电镜分析
山茱萸籽多糖的微观结构见图10,山茱萸籽多糖结构呈表面光滑,无规则颗粒状,粒径大小不一的球状结构物,在山茱萸籽粕扫描电镜图中得到证实。其球状结构物相互堆叠,相互紧靠。扫描电镜图表明在亚临界水降解温度160 ℃、降解时间20 min情况下,山茱萸籽多糖结构完整。
2.9 抗氧化活性分析
2.9.1 DPPH自由基的清除率测定 如图11所示,在质量浓度为0.2 mg/mL时,自由基清除率为75.63%,在0.2~1.0 mg/mL范围内增长较为缓慢,1.0 mg/mL时,清除率达到最大值85.61%。而标准品VC对DPPH自由基的清除率高达96.60%。
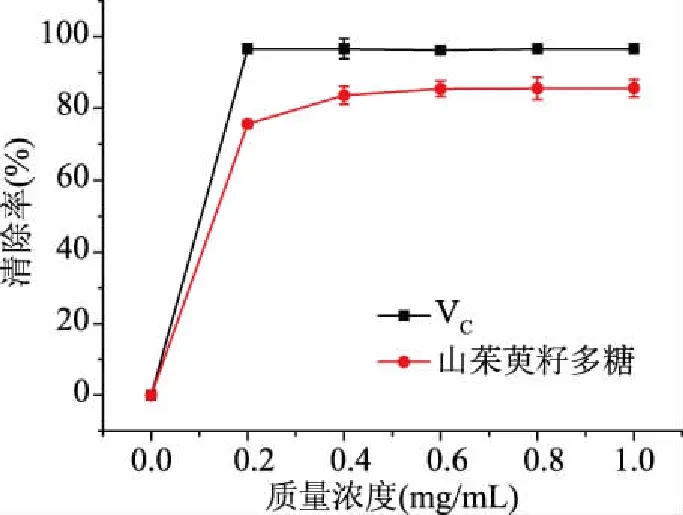
图11 山茱萸籽多糖清除DPPH自由基的能力
2.9.2 羟自由基的清除率测定 如图12所示,山茱萸籽多糖对羟自由基清除率随着质量浓度的增加呈快速增长趋势,在浓度达到0.8 mg/mL后,增长趋势较为平缓,在1 mg/mL时清除率达到最大值63.40%。而标准品VC对羟自由基自由基的清除率高达90.21%。
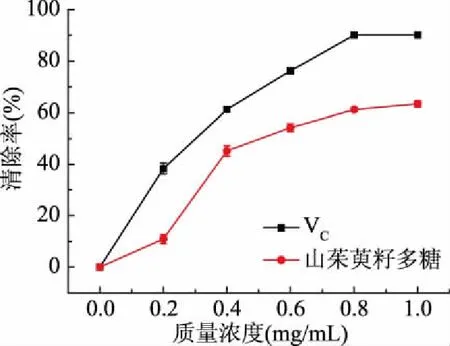
图12 山茱萸籽多糖清除羟自由基的能力
2.9.3 ABTS自由基清除率测定 如图13所示,在质量浓度0~1.0 mg/mL范围内,山茱萸籽多糖对ABTS自由基清除率逐渐增大,在1 mg/mL时达到最大值76.20%。标准品VC对羟基自由基的清除率达97.80%。
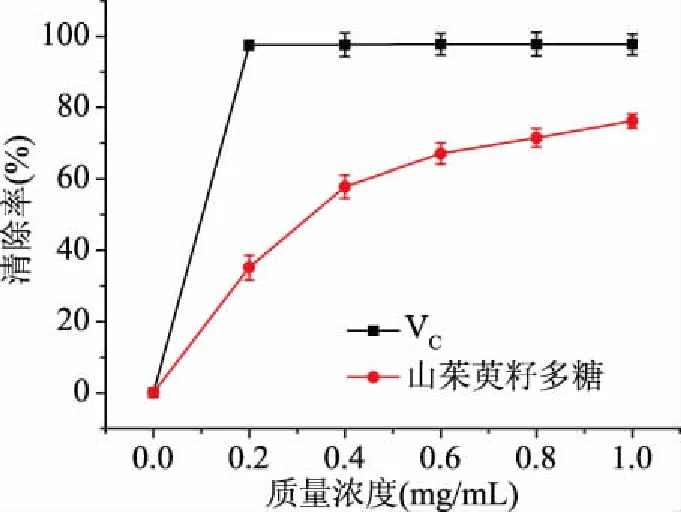
图13 山茱萸籽多糖清除ABTS自由基的能力
3 结论
经过实验研究,Saeman模型能较好地反映亚临界水降解山茱萸籽粕的过程,降解温度和降解时间是还原糖产率的主要影响因素,在降解温度160 ℃、降解时间20 min条件下,能得到产量较高的还原糖。单糖组成分析结果表明,主要由、葡萄糖、木糖、半乳糖等组成;结构分析结果表明,山茱萸籽多糖结构呈表面光滑,无规则,粒径大小不一的球状结构物,为吡喃型糖苷环骨架,多糖结构完整;抗氧化实验结果表明,山茱萸籽多糖具有一定的抗氧化活性,随着多糖浓度的增加,其抗氧化活性逐渐增强。试验结果为山茱萸籽多糖的进一步分离纯化和理化特性、形态结构的分析提供了参考。

