铜和磺胺嘧啶复合污染对土壤酶活性及微生物群落功能多样性的影响①
李明珠,廖 强,董远鹏,刘喜娟,邵翼飞,胡欣欣,李梦红,刘爱菊*
铜和磺胺嘧啶复合污染对土壤酶活性及微生物群落功能多样性的影响①
李明珠1,廖 强1,董远鹏1,刘喜娟1,邵翼飞1,胡欣欣2,李梦红2,刘爱菊2*
(1山东理工大学农业工程与食品科学学院,山东淄博 255091;2 山东理工大学资源与环境工程学院,山东淄博 255091)
随着畜禽养殖业规模化发展以及畜禽粪便的大量农用,由此导致的土壤重金属和抗生素复合污染问题日益突出。以畜禽养殖常用的饲料添加剂铜(Cu)和磺胺嘧啶(sulfadiazine, SDZ)为目标污染物,分别采用土壤酶试剂盒(微量法)和Biolog-ECO板法,研究二者复合污染对土壤酶活性和微生物群落功能多样性的影响。结果发现:低剂量Cu(200 mg/kg)复合污染可缓解SDZ对土壤脱氢酶和β-葡萄糖苷酶活性的抑制效应,低剂量Cu与SDZ表现为拮抗作用;但加重SDZ对磷酸酶活性的抑制效应,二者表现为协同抑制作用。高剂量Cu(500 mg/kg)和SDZ复合对所测试土壤酶活性均表现为协同抑制作用。Biolog-ECO分析表明,SDZ 10 mg/kg添加量对土壤微生物活性具有促进作用,而Cu和SDZ复合污染则可显著抑制土壤微生物代谢活性。多样性指数分析表明,Cu和SDZ复合污染对微生物群落多性影响较小,但可显著改变微生物种群的均一性;且主成分分析也表明,二者复合污染可显著改变土壤微生物群落结构组成。可见,Cu和SDZ复合污染对土壤酶活性的影响与土壤酶的种类及复合剂量有关,且土壤脱氢酶活性是反映SDZ及其与Cu复合污染较为敏感的指标;Cu和SDZ复合污染可显著抑制土壤微生物群落的整体代谢活性,并改变代谢功能,进而促使土壤微生物结构发生变化。
重金属;抗生素;土壤;酶活性;微生物多样性
自抗生素被发现并投入实际应用以来,其使用量每年都在增加[1]。我国作为发展中国家,对抗生素的使用也越来越多。其中磺胺类、喹诺酮类、四环素类和大环内酯类抗生物使用量尤为突出[2]。近年来,随着畜禽养殖业的发展,抗生素因其良好的抗菌性和促生长性常作为添加剂被大量添加到动物饲料中[3]。但相关研究表明,这些抗生素进入到生物体内之后,能真正被利用吸收的量很少,约80% 以上都随粪便和代谢物排出体外,导致环境中抗生素的污染问题[4]。此外,土壤作为环境污染物的最终归宿,其抗生素污染问题也越来越不容忽视。Qian等[5]通过对浙江省及其周边地区畜禽粪便源有机肥料中残留抗生素的研究发现,受检的219个样品中,抗生素的检出率达到了63.9% 以上。成玉婷等[6]调查了广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征,结果发现,8种磺胺类抗生素在土壤中普遍检出,总含量为0.73 ~ 973 μg/kg。
微生物作为土壤中不可或缺的一部分,一直以来,被诸多学者作为观测农田污染的指标[7]。已有研究表明,土壤微生物对于污染物胁迫有着敏感的响应,其中微生物量、酶活性、种群结构及多样性是常用于衡量土壤污染程度的重要指标[8],且在抗生素等污染物胁迫下,土壤微生物的各项生态指标会发生不同程度的变化[6]。已有研究显示,磺胺甲基嘧啶(SMA)胁迫会抑制土壤潜在硝化势、呼吸作用、脱氢酶和脲酶活性[9];但不同抗生素对土壤中不同酶活性的影响效果并不一致[10]。此外,土壤作为环境中污染物的汇集地,其抗生素与重金属污染问题也日趋严峻[11-12]。已有研究表明,土壤重金属与抗生素的复合污染,其作用机制比单一污染更为复杂,主要表现为协同、拮抗及加和作用。刘爱菊等[9]通过研究土壤中Cu与抗生素的协同作用发现,二者共同存在条件下会对土壤潜在硝化势、脱氢酶活性产生协同抑制作用。闫赛红[13]研究了恩诺沙星(ENR)和镉单一及复合污染对土壤微生物的影响,结果发现,两种污染条件下细菌、真菌、放线菌都表现出抑制作用,且复合污染对3种微生物的交互作用以拮抗作用为主。目前关于抗生素和重金属复合污染对土壤酶活性的影响已开展了较深入的研究,但是有关土壤微生物功能多样性的响应内容还有所欠缺,且将两者结合起来探讨重金属和抗生素复合污染的土壤生态毒理效应研究更鲜有报道。
为此,本研究选取在畜禽粪便中检出率高、土壤污染问题较为严重的磺胺嘧啶(SDZ)和铜(Cu)作为典型污染物,以山东平度未经污染的农田土壤为研究对象,采用室内培养试验法,探讨在SDZ胁迫的情况下,Cu的添加对土壤微生物酶活性以及功能多样性的影响,尝试从土壤微生物的角度来探究重金属和抗生素复合污染的土壤生态毒理效应,以期为土壤重金属和抗生素污染防治及土壤生态系统安全保障提供可靠的理论依据。
1 材料与方法
1.1 供试土壤
供试土壤为采自山东平度的农田土壤,是未受污染的褐土,采样深度为0 ~ 20 cm,在30 m × 30 m范围内分5点采集后将土样混合均匀。土样经除杂、风干、研磨和过筛(2 mm)后备用,并从中取适量土样进行理化指标的测定,具体测定方法参照鲁如坤的《土壤农业化学分析方法》[14],测定结果见表1。

表1 供试土壤的基本理化性质
1.2 试验设计
以SDZ和Cu为外源添加污染物,进行室内培养试验。在正式试验前,先用去离子水将供试土壤的含水量调节至田间最大持水量的50%,并置于25℃ ± 1℃恒温培养箱内避光预培养7 d,使土壤微生物恢复活性。之后,分别取100 g(以风干土计算)土壤置于500 ml带盖塑料瓶中,先按10 mg/kg的剂量往土壤中添加SDZ充分混匀后,再分别按照0、200、500 mg/kg的剂量加入Cu2+,同时设置土壤空白对照,即得到4个不同的处理(表2),每个处理重复3次。污染物添加完成后,将土壤的含水量调节为田间最大持水量的60%,并再次置于25℃±1℃恒温培养箱内避光培养,每隔2 d采用称重法补足损失的水分,培养7 d后,取适量样品测定各处理土壤的脲酶、磷酸酶、β-葡萄糖苷酶和脱氢酶活性,同时分析各处理土壤中微生物功能多样性的变化。

表2 Cu和SDZ的添加量及实测量(mg/kg)
1.3 土壤酶活性测定及微生物群落多样性分析
本研究采用土壤酶试剂盒测定土壤脲酶、磷酸酶、β-葡萄糖苷酶、脱氢酶活性。其中,脲酶活性测定采用苯酚钠-次氯酸钠比色法,中性磷酸酶活性测定采用磷酸苯二钠比色法,β-葡萄糖苷酶活性测定采用可见分光光度法,脱氢酶活性测定采用TTC比色法[15]。具体实验步骤参照试剂盒(科铭生物科技有限公司,中国)说明书进行,最后使用酶标仪(Infinite F200 Pro Tecan公司,德国)进行测定。
微生物群落多样性采用Biolog-ECO板(Biolog 公司,美国)测定。Biolog是20世纪90年代发展起来的一种微平板技术,采用该技术可简单、快速地获知土壤微生物对多种碳源利用能力的差异[16],具体操作步骤如下:首先,称取相当于5 g烘干质量的新鲜土壤于250 ml三角瓶中,加入45 ml灭菌的0.05 mol/L的磷酸缓冲液,将三角瓶置于振荡器上以160 r/min的速率振荡30 min,然后静置30 min,取悬浮液,按十倍稀释法稀释1 000倍后即为接种液。将接种液移至已灭菌的V型槽中,用排枪向Biolog- ECO板的每个微孔注入150 μl稀释液,接种好的Biolog-ECO板放入培养箱中,避光,25℃ ± 1℃培养,分别于12、24、36、48、60、72、84、96、108、120、132、144 h在酶标仪(infinite F200Pro)上读取OD590 nm值[17]。
其中,用微孔的平均颜色变化率(average well color development, AWCD)表征土壤微生物群落整体代谢活性,分别用Shannon、Simpson和Mcintosh等多样性指数表征土壤微生物种群的丰富度、最常见物种的优势度及群落的均一性[15]。AWCD值及微生物群落多样性指数计算公式如下:

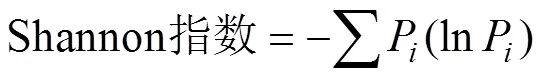


式中:C为每个微孔在590 nm下的吸光值;为对照孔的吸光值;P为第孔相对吸光值与整板相对吸光值总和之比;n为第孔的相对吸光值,即(C-R)。
1.4 土壤中Cu和SDZ的测定
土壤中Cu含量的测定:先用8 ml HCl-HNO3- HF(3∶9∶4,)混合溶液微波消解,再用ICP-AES (Vista MPX, Varian, 美国)进行测定。分析过程中采取空白样、平行样和标准物质控制法,在实际测定过程中加入国家土壤标准样品(GSS-1)进行分析质量控制[18]。土壤中SDZ的测定:先用1% 甲酸-甲醇(7∶3,)混合溶液浸提,再经0.45 μm滤膜过滤,用高效液相色谱法(HPLC 1100,安捷伦,美国)进行测定[19]。
1.5 数据处理与统计分析
所得试验数据采用Excel 2010进行处理,SPSS17.0进行统计和相关性分析,PAST 3.0进行主成分分析,Origin 8.5进行绘图。
2 结果与分析
2.1 Cu和SDZ复合污染胁迫下土壤酶活性的变化
土壤酶是指土壤中的聚积酶,包括游离酶、胞内酶和胞外酶,土壤酶活性可以较全面地反映土壤环境、质量和肥力变化,对于分析和探讨土壤生态系统结构、功能及其可持续利用具有重要的现实意义[20]。本文采用室内添加污染物培养法,研究和分析了不同Cu和SDZ复合污染处理下,土壤脱氢酶、磷酸酶、β-葡萄糖苷酶、脲酶活性变化,结果如图1所示。由图1可知,10 mg/kg的SDZ对土壤脱氢酶和β-葡萄糖苷酶活性具有显著的抑制作用,对脲酶活性具有显著的刺激作用,而磷酸酶活性几乎不受10 mg/kg SDZ污染的影响。表明土壤脱氢酶和β-葡萄糖苷酶活性对SDZ污染胁迫较为敏感,而土壤磷酸酶和脲酶活性则对其污染具有一定耐性或抗性。各土壤酶活性对SDZ与Cu复合污染胁迫的响应也各不相同。与SDZ单一污染处理相比,200 mg/kg Cu的加入可在一定程度缓解SDZ对脱氢酶和β-葡萄糖苷酶活性的抑制作用,Cu和SDZ表现为拮抗作用;而对于土壤磷酸酶和脲酶活性,Cu和SDZ则产生显著的协同抑制作用。且由图1还可以看出,Cu和SDZ复合污染对土壤磷酸酶活性的联合抑制作用不受Cu添加量的影响,而二者复合污染对土壤脲酶活性联合抑制作用则随着Cu添加量的升高而增强。这表明土壤磷酸酶活性对Cu和SDZ复合污染较土壤脲酶活性更为敏感。

(图中不同小写字母表示处理间差异显著(P < 0.05))
2.2 Cu和SDZ复合污染胁迫下土壤微生物群落活性的变化
AWCD是培养时间内Biolog-ECO板的平均颜色变化率,能够反映土壤微生物的活性、生理功能多样性,它在时间维度上的变化可表征微生的平均代谢活性[21]。AWCD值的增长速率反映了土壤微生物代谢活性变化。本研究中SDZ单一及与Cu复合污染处理的总AWCD变化曲线如图2所示,可见,随着培养时间的延长,各处理AWCD值逐渐增加,在0 ~ 96 h变化较快,变化趋势较为稳定,96 h以后,增长速度逐渐减缓,在培养120 h后,碳源利用能力逐渐趋于稳定。这表明在0 ~ 96 h碳源利用率强,微生物活性逐渐增强,在120 h后,土壤微生物活性逐渐趋于稳定。但在0 ~ 96 h时间段内,4种处理的碳源利用率基本呈SDZ ≈ SDZ+Cu2>CK>SDZ+Cu5的规律,96 h后则呈现SDZ>SDZ+Cu2>CK>SDZ+Cu5的规律。表明SDZ及其与低剂量Cu(200 mg/kg)复合污染对土壤微生物代谢活性具有一定的促进作用;而SDZ与高剂量Cu(500 mg/kg)复合污染胁迫致使土壤微生物碳源利用能力减弱,显著抑制土壤微生物代谢活性。

图2 各处理下AWCD值的变化
2.3 Cu和SDZ复合污染胁迫下土壤微生物多样性指数的变化
本研究以培养132 h时各处理的AWCD值,分别对物种丰富度Shannon指数、常见物种优势度Simpson指数以及物种群落均一性Mcintosh指数进行了计算,结果如表3所示。由表3可知,与对照处理相比,SDZ及其与Cu复合污染处理的Shannon和Simpson指数并未发生明显的变化,表明SDZ及其与Cu复合污染处理对土壤中微生物的丰富度和其常见种群未产生显著影响。然而,各处理Mcintosh指数值则呈现SDZ>CK>SDZ+Cu2>SDZ+Cu5的变化趋势,表明SDZ污染可增加土壤微生物群落的均一性,而其与Cu复合污染则显著破坏土壤微生物群落的均一性,且SDZ与高剂量Cu(500 mg/kg)复合污染的破坏作用最为显著。

表3 各处理条件下的多样性指数
2.4 Cu和SDZ复合污染胁迫下土壤微生物碳源利用特征的变化
依据Biolog-ECO板31种碳源化合物的结构和性质,可将其分为糖类、氨基酸类、胺类、醇类、酸类和脂类6大类[22-23]。为了进一步了解Cu和SDZ复合污染胁迫下微生物对各类碳源的利用情况,本文对培养132 h 时6类碳源的AWCD值进行分析,结果见图3。由图3可以看出,与对照处理相比,SDZ单一及与Cu复合污染处理并未改变土壤微生物的碳源利用结构,表明SDZ单一及与Cu复合污染处理对土壤微生物的种群组成未产生显著的影响。但是在各类碳源的利用水平上,各处理之间存在较大差异。具体表现为,10 mg/kg SDZ添加可显著增加土壤微生物对糖类、酸类以及脂类的利用水平,这表明试验剂量下SDZ对以糖类、酸类和脂类为主要营养物质的微生物生长具有显著的刺激作用;SDZ和低剂量 Cu (200 mg/kg)复合污染显著抑制了土壤微生物对胺类碳源的代谢,促进其对酸类碳源的代谢,而SDZ和高剂量Cu(500 mg/kg)复合处理中,6类碳源的AWCD值均低于对照处理,其中糖类、胺类以及脂类的碳源代谢受到显著抑制。该结果表明SDZ单一及与Cu复合污染可显著改变土壤微生物对不同碳源的利用水平。
对各处理培养132 h时的每孔吸光值进行主成分分析,可以表征不同处理下微生物群落对碳源的利用情况,结果如图4所示,可以看出,4个处理在PC轴上分异明显。其中,SDZ和CK两处理离散距离相对较近,说明SDZ处理与CK处理的碳源利用能力相似,即表明他们具有相似的土壤微生物群落。SDZ+ Cu2处理和SDZ+Cu5处理分别位于第三象限和第二象限,二者之间及其与SDZ、CK处理的数值分布均具有较为明显的差异,表明SDZ和Cu复合污染处理与SDZ处理的土壤微生物群落结构差异较大,且SDZ和Cu复合污染处理可显著改变土壤微生物群落结构。

(图中不同小写字母表示同一碳源下不同处理间差异显著(P < 0.05))

图4 土壤微生物碳源利用特征的主成分分析
3 讨论
3.1 抗生素–重金属复合污染对土壤酶活性的影响
土壤酶是土壤生物学活性的重要组成部分[24],对土壤营养物质代谢过程具有重要的驱动作用,常被作为土壤环境质量变化的生物指标[25]。本研究发现,低剂量Cu的复合添加,在一定程度上缓解SDZ对土壤脱氢酶、β-葡萄糖苷酶活性的抑制效应(表现为拮抗作用),但对土壤磷酸酶和脲酶活性则表现为协同抑制作用;对于所测试的4种土壤酶,高剂量Cu和SDZ复合污染均表现为联合抑制作用。抗生素和重金属复合污染对土壤酶活性的影响与土壤酶的种类、污染物含量等因素密切相关。该研究结果与已有的文献报道相似。如高若松[26]研究表明,高剂量Cd与低剂量磺胺间甲氧嘧啶复合处理对土壤蔗糖酶的活性始终保持抑制作用;并且保持磺胺间甲氧嘧啶含量不变,增加Cd的复合污染含量,对土壤磷酸酶活性的抑制程度也随之加强。阮存鑫[27]在研究四环素和Cu复合污染的土壤酶活性效应时也有类似发现,即在乌栅土中,四环素和Cu复合污染可显著抑制脲酶活性,且抑制效果高于单一污染;在红壤中,复合条件下四环素可在一定程度上缓解Cu对脲酶和酸性磷酸酶的毒性。以上分析表明,在复合污染条件下,抗生素与重金属复合污染物对土壤酶的毒性效应较为复杂,且存在很多不确定性,并可在一定程度上加剧复合污染的生态风险。因此,应进一步加强抗生素-重金属复合污染的生态毒性效应研究,以便更好地解释二者复合污染的污染特性和机理。
3.2 抗生素–重金属复合污染对土壤微生物多样性的影响
土壤微生物是维持土壤微生物活性的重要组成部分,其数量、群落结构改变均能反映土壤质量和健康状况,是土壤环境质量评价的重要生物指标[28]。本研究结果表明,SDZ单一及与低剂量Cu复合污染对土壤微生物代谢活性具有明显的刺激作用;而SDZ与高剂量Cu复合污染则显著抑制土壤微生物的代谢活性(图2)。同时,SDZ和Cu复合污染可显著改变土壤微生物对不同碳源的利用水平(图3),破坏土壤微生物群落的均一性(表3),进而改变土壤微生物群落结构(图4)。Kong等[29]研究发现类似现象,即土壤微生物的功能多样性、均匀性、基质利用率等均随着土霉素和Cu剂量的增加而显著降低。毛书帅[30]在研究不同抗生素与Cu单一及复合污染对土壤微生物的影响时发现,与其他抗生素与Cu复合污染相比,磺胺二甲嘧啶和Cu对土壤微生物多样性Simpson指数和Shannon指数影响较小。本研究结果也表明,SDZ及其和Cu复合污染处理虽然降低土壤微生物群落的均一性,但对土壤微生物群落的丰富度(Shannon指数)和常见种群的优势度(Simpson指数)影响较小(表3)。分析其原因,这可能与Biolog-ECO方法只能反映能够利用ECO板上碳源的微生物信息,并不一定反映整个土壤微生物群落的功能多样性有关[31-32]。此外,杨玖[33]研究堆肥过程磺胺二甲嘧啶和Zn复合污染处理对微生物群落影响发现,在堆肥第6天,二者复合污染对堆料中微生物活性的抑制作用低于单一污染处理,且微生物群落结构不稳定,复杂程度也降低;在堆肥第25天,复合污染显著提升堆料中微生物群落的多样性。由此可推测,抗生素与重金属复合污染对土壤微生物群落的生态毒理效应与污染胁迫时间有关。因此,应加强抗生素与重金属复合污染的土壤生态风险长期监测和评估研究。
4 结论
本研究表明,SDZ和Cu复合污染对土壤酶活性的影响与土壤酶种类、污染物含量等因素密切相关。复合污染条件下,低剂量Cu可缓解SDZ对土壤脱氢酶和β-葡萄糖苷酶活性的抑制效应,低剂量Cu和SDZ表现为拮抗作用;高剂量Cu和SDZ复合污染则对土壤酶均表现为协同抑制作用。
Biolog-ECO分析表明,SDZ和低剂量Cu复合污染对土壤微生物群落代谢活性具有促进作用;而SDZ与高剂量Cu复合污染则显著抑制土壤微生物代谢活性;同时,SDZ和Cu复合污染可显著改变土壤微生物对不同碳源的利用水平,破坏土壤微生物群落的均一性,进而改变土壤微生物群落功能结构。
[1] 南琼, 唐景春, 胡羽成, 等. 不同环境介质中抗生素检测方法研究进展[J]. 化学研究与应用, 2017, 29(11): 1609–1621.
[2] 郭欣妍, 王娜, 许静, 等. 兽药抗生素的环境暴露水平及其环境归趋研究进展[J]. 环境科学与技术, 2014, 37(9): 76–86.
[3] 张敏, 张俊, 钱金秋, 等. 磺胺二甲嘧啶对沼气发酵过程中酶活性和微生物群落功能多样性的影响[J]. 生态与农村环境学报, 2017, 33(7): 653–659.
[4] 彭凤姣. 典型抗生素在土壤中的吸附与解吸行为及其吸附态的生物活性研究[D]. 中国科学院大学, 2014.
[5] Qian M, Wu H, Wang J, et al. Occurrence of trace elements and antibiotics in manure-based fertilizers from the Zhejiang Province of China[J]. Ence of the Total Environment, 2016, 559(Jul. 15): 174–181.
[6] 成玉婷, 吴小莲, 向垒, 等. 广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J]. 中国环境科学, 2017, 3(37): 1154–1161.
[7] 李光宇, 吴次芳. 土壤微生物研究在农田质量评价中的应用[J]. 土壤学报, 2018, 055(3): 543–556.
[8] 刘金光, 李孝刚, 王兴祥. 连续施用有机肥对连作花生根际微生物种群和酶活性的影响[J]. 土壤, 2018, 50(2): 305–311.
[9] 刘爱菊, 刘敏, 李梦红, 等. Cu、抗生素协同污染对土壤微生物活性的影响[J]. 生态环境学报, 2013, 000(11): 1825–1829.
[10] 杨文亭, 冯远娇, 王建武. 不同耕作措施对土壤微生物的影响[J]. 土壤通报, 2011, 42(1): 214–219.
[11] 张彦, 张惠文, 苏振成, 等. 长期重金属胁迫对农田土壤微生物生物量、活性和种群的影响[J]. 应用生态学报, 2007(07): 1491–1497.
[12] 章强, 辛琦, 朱静敏, 等. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 2014(7): 1075–1083.
[13] 闫赛红. 恩诺沙星与镉单一及复合污染对土壤微生物群落结构和功能的影响[D]. 山东农业大学环境工程, 2015.
[14] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[15] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010.
[16] 徐江兵, 王艳玲, 刘明, 等. BIOLOG与微量热耦合研究提高红壤微生物代谢活性的碳源因子[J]. 土壤学报, 2018, 55(1): 203–212.
[17] 高晓奇, 肖能文, 叶瑶, 等. 基于Biolog-ECO分析长庆油田土壤微生物群落功能多样性特征[J]. 应用与环境生物学报, 2014, 20(5): 913–918.
[18] 彭杨, 吴婧, 巢静波, 等. 土壤/沉积物中14种金属元素的ICP-MS准确测定方法[J]. 环境化学, 2017, 36(1): 175–182.
[19] 李彦文, 莫测辉, 赵娜, 等. 高效液相色谱法测定水和土壤中磺胺类抗生素[J]. 2008.
[20] 王理德, 王方琳, 郭春秀, 等. 土壤酶学硏究进展[J]. 土壤, 2016, 48(1): 12–21.
[21] Garau G, Castaldi P, Santona L, et al. Influence of red mud, zeolite and lime on heavy metal immobilization, culturable heterotrophic microbial populations and enzyme activities in a contaminated soil[J]. Geoderma, 2007, 142(1/2): 47–57.
[22] K H S, H G, J K M, et al. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns[J]. Applied and Environmental Microbiology, 1995, 4(61): 1458–1468.
[23] J P, L B, F R P. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles—A critique[J]. FEMS Microbiology Ecology, 2002, 1(42): 1–14.
[24] 张丽娟, 曲继松, 朱倩楠, 等. 不同剂量外源纤维素酶对设施土壤生物活性与番茄生长的影响[J]. 植物营养与肥料学报, 2017, 23(4): 1089–1094.
[25] 谢伟, 王紫泉, 曹永昌, 等. 基于土壤水分变化的砷与土壤碱性磷酸酶活性关系探讨[J]. 环境科学学报, 2015, 35(10): 3261–3268.
[26] 高若松. Cd-磺胺间甲氧嘧啶单一及复合污染的生态毒性效应研究[D]. 河南师范大学环境科学, 2011.
[27] 阮存鑫. 四环素与铜复合污染对土壤硝化作用及植物生长的影响[D]. 南京林业大学, 2010.
[28] 郑有飞, 石春红, 吴芳芳, 等. 土壤微生物活性影响因子的研究进展[J]. 土壤通报, 2009, 40(5): 1209–1214.
[29] Kong W D, Zhu Y G, Fu B J, et al. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J]. 2006.
[30] 毛书帅. 三种抗生素和铜单一及复合污染对土壤酶和微生物群落功能多样性的影响[D]. 山东农业大学环境工程, 2016.
[31] 陈秋芳. 不同森林恢复方式对土壤微生物多样性的影响[D]. 湖南农业大学, 2006.
[32] 单鹤翔. 长期秸秆与化肥配施条件下土壤微生物群落多样性研究[D]. 中国农业科学院, 2012.
[33] 杨玖. 磺胺类抗生素与锌对堆肥过程中酶活性及微生物群落结构多样性的影响[D]. 西北农林科技大学, 2014.
Effects of Copper and Sulfadiazine Combined Pollution on Soil Enzyme Activity and Metabolic Function Diversity of Microbial Community
LI Mingzhu1, LIAO Qiang1, DONG Yuanpeng1, LIU Xijuan1, SHAO Yifei1, HU Xinxin2, LI Menghong2, LIU Aiju2*
(1 School of Agricultural Engineering and Food Science, Shandong University of Technology, Zibo, Shandong 255091, China; 2 School of Resources and Environment Engineering, Shandong University of Technology, Zibo, Shandong 255091, China)
With the large-scale development of livestock and poultry breeding industry, large amount of livestock and poultry manure has been used to agriculture, resulting in the deterioration of combined pollution of heavy metals and antibiotics in soil. In this paper, the feed additives copper (Cu) and sulfadiazine (SDZ), which are commonly used in livestock and poultry breeding, were used as the target pollutants. The soil enzyme kit (micro method) and Biolog ECO-plate method were adopted to study the effect of the combined pollution on enzyme activity and the functional diversity of soil microbial community. The results showed that low concentration of Cu (200 mg/kg) combined pollution could alleviate the inhibitory effect of SDZ on soil dehydrogenase and β-glucosidase, i.e., antagonistic effect. However, SDZ had a synergistic inhibitory effect on phosphatase. The high concentration of Cu (500 mg/kg) and SDZ complex showed synergistic inhibition on soil enzymes tested. Biolog ECO-plate analysis showed that the addition of 10 mg/kg SDZ promoted soil microbial activity, while the combination of Cu and SDZ significantly inhibited soil microbial metabolic activity. The diversity index analysis showed that the combined pollution of Cu and SDZ had little effect on microbial community traits, but significantly changed the homogeneity of microbial populations. Principal component analysis also showed that the combined pollution could significantly change soil microbial community structure. In conclusion, the effect of Cu and SDZ combined pollution on soil enzyme activity is related to soil enzyme species and pollutant concentration, and soil dehydrogenase is a sensitive indicator reflecting SDZ and its combined pollution with Cu; The combined pollution of Cu and SDZ can significantly inhibit the overall metabolic activity of soil microbial communities and change the metabolic function, thus can promote the changes of soil microbial structure.
Heavy metal; Antibiotic; Soil; Enzyme activity; Microbial diversity
S154.3
A
10.13758/j.cnki.tr.2020.05.016
李明珠, 廖强, 董远鹏, 等. 铜和磺胺嘧啶复合污染对土壤酶活性及微生物群落功能多样性的影响. 土壤, 2020, 52(5): 987–993.
国家自然科学基金项目(41671322, 41771348)、山东省自然科学基金项目(ZR2015DM010)和校城融合支持计划项目(2016ZBXC102)资助。
李明珠(1994—),女,山西晋城人,硕士研究生,主要从事土壤污染生态毒理学研究。E-mail:16503060362@stumail.sdut.edu.cn

