运动调节FUNDC1介导的线粒体自噬改善AD的机制研究
李亚楠 闫清伟
摘 要:研究证实阿尔茨海默症( Alzheimer's disease, AD)脑内Aβ累积,导致线粒体功能障碍,造成线粒体自噬活性降低,无法彻底清除毒性物质,导致AD发生发展。而运动可提高线粒体自噬活性,清除Aβ,改善AD的病理特征,但其机制尚不清楚。通过分析发现低氧下UNC-51样激酶1(unc-51like kinase1,ULK1)磷酸化FUNDC1(FUN14 domain conTaining1)的Ser17位点,磷酸甘油变位酶家族蛋5(phosphOglyeerate-mutase family member 5,PGAM5)去磷酸化Ser13位点,促进FUNDC1与微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)结合,介导线粒体自噬发生。而在运动刺激下,可激活AMPK-ULK1途径,磷酸化FUNDC1的Ser17位点,诱导FUNDC1和LC3结合,提高线粒体自噬活性,减少Aβ,改善脑内线粒体功能障碍,为防治AD提供新的治疗靶点。
关键词:运动;阿尔茨海默病;FUNDC1;线粒体自噬
一、前言
AD是一种累进性脑功能障碍退行性病变。主要表现为记忆力减退、认知及学习功能障碍。典型的病理特征是β-淀粉样蛋白沉积形成的老年斑(SPs)、Tau蛋白累积形成的神经纤维缠结(NFTs)[1]。目前世界上已有4000万人患AD,预计经过10年,患AD人数可能增加至8200万例。2015年在AD方面耗资8000亿美元,随着患病人数的增加,费用也每年呈递增式增加,这给全球经济带来了挑战[2]。所以针对AD的防治变得极为迫切,然而当前尚无药物可以根治AD,人们的注意力逐渐转移到运动锻炼。
大量研究证实运动可提高线粒体自噬水平,减少脑内Aβ累积,改善线粒体功能,缓解AD脑损伤。人体实验中:50~80岁认知障碍患者进行3个月中等强度有氧运动后,通过MMSE、ADAS-cog等检查发现,中等强度有氧运动可以缓解AD患者的认知功能障碍[3]。另外AD患者经过中、高强度有氧运动后,其学习记忆能力显著提高,并且高强度有氧运动对学习记忆的改善作用主要表现在短期,长期内则是中等强度有氧运动效果好[4]。总之研究证实维持运动可提高AD患者学习认知能力,而缺乏运动则会增加AD的患病率。动物实验中:D-半乳糖模型大鼠经过跑台和游泳的混合运动后,Aβ42减少,D-半乳糖模型大鼠的学习记忆能力显著提高[5]。APP/PS1小鼠进行12周高强度间歇运动后,海马内Aβ降低,线粒体自噬活性提高,APP/PS1小鼠的认知功能提高[6]。综上所述,人体和动物实验均证实运动可有效清除Aβ沉积,提高线粒体自噬活性,减轻AD脑内线粒体氧化应激状态,抑制AD的发生发展。随着研究的深入,发现FUNDC1可能在运动介导线粒体自噬的分子机制中占有重要的地位。然而目前尚不清楚运动发挥此作用的机制,需要进一步深入探究。因此本文分析运动和FUNDC1的关系以及FUNDC1和线粒体自噬与AD的关系,提出运动改善AD的分子机制。
二、AD脑内线粒体自噬障碍
自噬是一种保障细胞正常运行的过程。在氧化应激等刺激下,细胞产生适应性反应,损伤的细胞等毒性物质转运至自噬体,随后与溶酶体形成自噬溶酶体被降解,从而维持细胞内稳态。这种细胞自发的保护反应称为自噬。自噬可以分为:大自噬、微自噬以及伴侣自噬[7]。其中大自噬进一步划分为选择性和非选择性自噬,已证实线粒体自噬是属于选择性自噬[2]。首先自噬体选择性的筛选出功能障碍的线粒体,其次将其包裹在包被结构内与溶酶体融合,最后被降解清除,避免细胞再次损伤。
研究证实Aβ诱导的线粒体自噬障碍是AD发病的重要因素。正常生理条件下,功能障碍的线粒体主要是通过线粒体自噬来清除。但AD海马内线粒体自噬活性较低,造成毒性物质堆积,加剧AD的病理现象。并且研究证实突变型APP转基因小鼠与对照组相比,转基因小鼠线粒体分裂蛋白基因表达升高,而融合、生物发生以及线粒体自噬基因表达降低[2]。另外在AD患者海马体内发现溶酶体功能受损,含有Aβ的自噬体积聚[8]。提示AD线粒体自噬活性下降可能是由于溶酶体功能失调所致。而提高线粒体自噬活性可能是防治AD的治疗策略。自噬相关基因LC3在细胞质中转化成LC3-I,随后与磷脂酰乙醇胺结合形成LC3-II。LC3-Ⅱ是促进自噬溶酶体降解的重要蛋白,因此LC3-Ⅱ被认为是判断自噬體的金标准[9]。而P62是一种泛素结合蛋白,在线粒体自噬过程中P62与LC3连接并被降解。因此P62在细胞中表达增加,而自噬活性会下降,两者是负相关的关系[10]。综上所述在实验研究中,检测LC3-II、P62的表达可作为观察线粒体自噬活性的指标。
三、FUNDC1调节AD脑线粒体自噬的分子机制
在2012年证实FUNDC1是一种哺乳动物内的线粒体外膜蛋白[11]。FUNDC1中含有155个氨基酸结构域,其中N端结构域包含一段与LC3结合的区域(LC3-interacting region,LIR)。因此FUNDC1与LC3作用,诱导线粒体自噬。FUNDC1处于特定的环境中,介导的线粒体自噬机制是复杂的。在正常环境中肌酸激酶2(creatine kinase 2,CK2)磷酸化FUNDC1的Ser13位点,与此同时BCL2L1阻碍PGAM5去磷酸化Ser13位点,导致FUNDC1被磷酸化,抑制线粒体自噬。在低氧刺激下BCL2L1被降解,因此BCL2L1与PGAM5结合受阻,PGAM5重新发挥去磷酸化作用,诱导FUNDC1与LC3结合,促进线粒体自噬。如果PGAM5基因突变,那么线粒体自噬会被显著抑制[12]。提示低氧下PGAM5可去磷酸化FUNDC1的Ser13位点,促进FUNDC1与LC3结合,诱导线粒体自噬发生。另外介导FUNDC1发生线粒体自噬的分子机制中还有一个重要的参与者—ULK1。低氧刺激下ULK1表达上调并被转运至线粒体外膜,磷酸化FUNDC1的Ser17位点,促进FUNDC1与蛋白CanX(Calexin)分离并和LC3结合,介导线粒体自噬发生[13]。
研究证实敲除FUNDC1基因,会阻断ULK1转移和抑制线粒体自噬。因此FUNDC1可能是ULK1在线粒体外膜的作用靶点,促进线粒体自噬发生。在心脏缺血再灌注实验中,低氧可诱导血小板中FUNDC1结合LC3提高线粒体自噬活性,减轻I/R所致的心脏损伤,敲除FUNDC1基因后,FUNDC1-LC3途径被阻断,线粒体自噬活性降低[14]。同样在大脑神经元细胞中也证实FUNDC1和LC3结合,诱导线粒体自噬发生,减轻脑损伤[15]。综上所述在骨骼肌、心肌、大脑神经元细胞中提高线粒体自噬可能和FUNDC1-LC3途径相关。研究证实大脑神经元内线粒体自噬活性下降,Aβ大量堆积,可能造成AD的重要因素。因此在大脑神经元内FUNDC1与LC3结合提高线粒体自噬活性可能是清除Aβ,防治AD的治疗策略。
四、运动通过FUNDC1调节AD脑线粒体自噬的分子机制
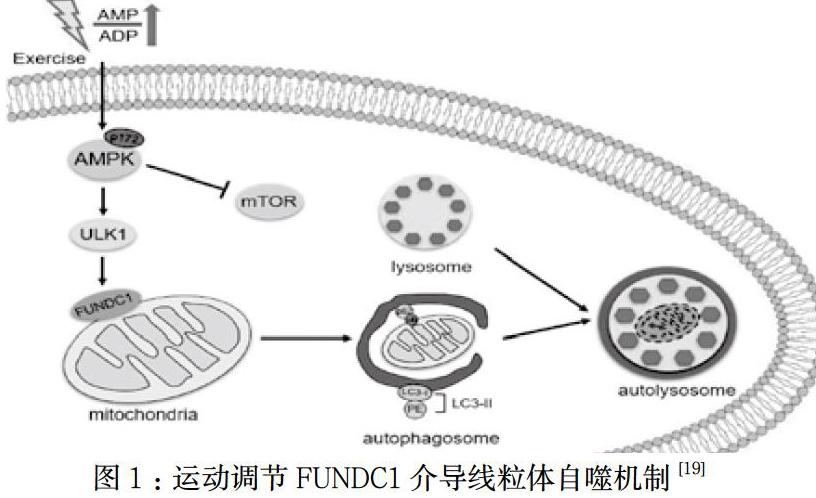
研究证实运动可介导线粒体自噬发生,但其具体机制尚不完全清楚。有氧运动可激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK),促进其介导线粒体自噬的通路发生,改善AD大脑神经元[16]。AMPK是细胞内重要的调控物质能量代谢的蛋白质。运动干预可调控AMPK的T172位点磷酸化激活AMPK,AMPK在S555区磷酸化ULK1,从而激活并上调ULK1。而FUNDC1作为ULK1的下游蛋白,受到其磷酸化作用的调控。ULK1可在Ser17位点磷酸化FUNDCl,进而增强FUNDCl与LC3的相互作用,若敲除FUNDC1上的ULK1结合序列,会抑制线粒体自噬。研究证实SD大鼠经过运动后,骨骼肌中FUNDC1、ULK1以及LC3-II/I比值表达增加,p62表达下降,提示运动可能是通过AMPK-ULK1通路影响FUNDC1的表达,介导FUNDC1与LC3结合,诱导线粒体自噬保护骨骼肌细胞[17]。在早期心衰大鼠实验中,FUNDC1、LC3-II/I的表达水平上调,提示有氧运动可通过FUNDC1和LC3结合,诱导线粒体自噬发生,保护大鼠心肌细胞[18]。在哺乳动物体内存在FUNDC1介导线粒体自噬发生的机制,通过激活FUNDC1-LC3途径,提高线粒体自噬活性可能是缓解大脑线粒体氧化损伤的治疗策略。那么运动刺激AMPK表达,激活ULK1-FUNDC1-LC3途径提高线粒体自噬活性可能也是大脑神经中枢的调控机制。海马内线粒体自噬可清除Aβ沉积,而Aβ是AD的重要病理特征,因此运动通过激活AMPK-ULK1途径介导FUNDC1与LC3结合,提高线粒体自噬活性清除Aβ是防治AD的重要途径之一。
五、小结
AD是一种多因素神经退行性疾病,然而尚未发现某种药物可以治愈AD患者。而运动提高线粒体自噬活性,清除Aβ,改善AD是公认的重要途径。FUNDC1作为新发现的线粒体自噬蛋白在其中发挥着重要作用。低氧下ULK1磷酸化FUNDC1的Ser17位点,PGAM5去磷酸化Ser13位点,促进FUNDC1介导的线粒体自噬是防治AD的关键通路之一。而运动通过激活AMPK以及ULK1-FUNDC1途径,促进FUNDC1与LC3结合,诱导线粒体自噬可能也是改善AD的重要通路。然而在运动下FUNDC1作为ULK1的连接蛋白介导线粒体自噬发生改善AD的分子机制仍需深入探索。探讨不同的运动方案对FUNDC1介导的线粒体自噬有什么影响?以及脑神经元细胞中FUNDC1参与线粒体自噬的机制还需大量临床实验验证。
参考文献
[1] 张赫,郑焱.β淀粉样蛋白级联假说相关的阿尔茨海默病发病机制及防治策略研究进展[J].中国医学科学院学报,2019,41(05):702-708.
[2] Reddy P H , Oliver D M . Amyloid Beta and Phosphorylated Tau-Induced Defective Autophagy and Mitophagy in Alzheimer's Disease[J]. Cells, 2019, 8(5):488-.
[3] 杨思雨. 有氧运动对早期阿尔茨海默病患者干预作用的临床研究[D].南京医科大学,2016.
[4] 王英,沈飞飞,朱奕,杨思雨,李海燕,汪琴,王炜,吴婷.中高强度有氧运动干预阿尔茨海默病的临床研究[J].中国临床神经科学,2014,22(05):504-509.
[5] 徐波,徐静,余锋,季浏.运动训练对D-半乳糖造阿尔茨海默病模型大鼠海马β位淀粉样蛋白42和裂解酶1的影响[J].中国康复医学杂志,2012,27(02):111-114+119.
[6] 张子怡,康伟民,张晟,薄海.高强度间歇运动训练上调APP/PS1转基因阿尔兹海默病小鼠海马线粒体自噬的研究[J].中国康复医学杂志,2020,35(06):670-675.
[7] 张莹,郭舒涵,房芳,何金生,彭向雷.自噬稳态调控与阿尔茨海默病防治策略[J].生命科学,2014,26(04):340-34-8.
[8] Bordi M, et al. Autophagy flux in CA1 neurons of Alzheimer hippocampus: Increased induction overburdens failing lysosomes to propel neuritic dystrophy. Autophagy. 2016:1–17.
[9] 王曉平,黄斌,马帅,黄睿,李晓佳.免疫抑制剂治疗对阿尔茨海默病大鼠海马自噬蛋白Beclin-1和LC3表达的影响[J].华中科技大学学报(医学版),2020,49(04):450-454.
[10] 赵娜,张宪亮,夏杰,闫清伟,徐波.12周有氧跑台运动对APP/PS1小鼠海马细胞自噬活性的影响[J].体育科学,2019,39(12):43-53.
[11] Lei Liu, Du Feng, Guo Chen, et al. Mitochondrial outer-membrane protein FUNDC1 mediates hypoxia-induced mitophagy in mammalian cells. 2012, 14(2):177-185.
[12] Wu H , Xue D , Chen G , et al. The BCL2L1 and PGAM5 axis defines hypoxia-induced receptor-mediated mitophagy[J]. Autophagy, 2014, 10(10):1712-1725.
[13] Wu W , Li W , Chen H , et al. FUNDC1 is a novel mitochondrial-associated-membrane (MAM) protein required for hypoxia-induced mitochondrial fission and mitophagy[J]. Autophagy, 2016:1675-1676.
[14] Zhang, Weilin,Siraj, Sami,Zhang, Rong, et al.Mitophagy receptor FUNDC1 regulates mitochondrial homeostasis and protects the heart from I/R injury[J].Autophagy,2017,13(6):1080-1081.
[15] Li J , Lu J , Mi Y , et al. Voltage-dependent anion channels (VDACs) promote mitophagy to protect neuron from death in an early brain injury following a subarachnoid hemorrhage in rats[J]. Brain Research, 2014, 1573:74-83.
[16] 曹海信,王小梅.有氧运动可保护β-淀粉样蛋白1-42诱导老年痴呆模型大鼠的大脑[J].中国组织工程研究,2021,25(11):1675-1681.
[17] Laker R C , Drake J C , Wilson R J , et al. Ampk phosphorylation of Ulk1 is required for targeting of mitochondria to lysosomes in exercise-induced mitophagy[J]. Nature Communications, 2017, 8(1):548.
[18] 董薇. 有氧运动影响压力负荷致早期心衰的大鼠心脏功能的分子基础[D].天津体育学院,2015.
[19] 于亮,史霄雨,刘子铭,王祯,李琳,高久翔,刘晓然,王瑞元.运动时长和强度对大鼠骨骼肌线粒体自噬的影响及其机制[J].生理学报,2020,72(05):631-642.
作者簡介:李亚楠(1994—),女,汉族,河南濮阳市人,硕士研究生,单位:西藏民族大学体育学院运动人体科学专业,研究方向:体育学习和身心健康。
闫清伟(1982-),男,汉族,副教授,博士,硕士研究生导师,单位:西藏民族大学体育学院,研究方向:脑衰老的运动及药物干预。
