生物解离对豆奶粉致敏性及其结构的影响
陈 龙,王冬梅,于爱华,李 波
(黑龙江省北大荒绿色健康食品有限责任公司,黑龙江佳木斯 154000)
大豆中蛋白质的含量在40%左右,其氨基酸组成及比例可以与牛奶蛋白质相媲美,含有人体必需的八种氨基酸组成[1],与其他植物蛋白相比,大豆蛋白属于营养价值十分丰富的完全蛋白质。近年来,大豆制品在新技术的改进下,其口感和功能得到了改善。但是随着大豆及其制品的广泛应用,其大豆中含有的致敏性蛋白成分越来越受到人们的关注。目前的研究表明,β-伴大豆球蛋白、大豆球蛋白、GlymBd30K(P34)和GlymBd28K是主要的大豆致敏蛋白,致敏蛋白是一种糖蛋白,糖基化位点位于成熟蛋白第170位天冬酰胺处,多糖组成为甘露糖、木糖等。P34中含有3对二硫键,主要由a-螺旋和β-折叠结构组成[2]。
大豆中的蛋白质空间结构在加工过程中会遭受不同程度的破坏,因此,利用加工方法必然能降低或消除其致敏性。Magishi等[3]研究表明,高温条件能够破坏大豆球蛋白的三维空间结构,进而改变蛋白的致敏性。然而也有研究表明,热处理会促使致敏性的增强,原因是热处理使得致敏原内部暴露了更多的抗原表位[4-6]。Hill等[7]研究发现,经半乳甘露聚糖修饰后,可以有效降低致敏性。Frias[8]利用枯草芽孢杆菌、米根霉和米曲霉,以大豆作为底物进行固态发酵,其致敏性降低了66%。
生物解离技术是一种新型的生物技术,其安全高效,广泛应用于各种植物油脂的提取和植物蛋白质的改性中。郑环宇等[9]研究采用超高压结合生物解离工艺,有效降低了大豆分离蛋白P34的致敏性。但生物解离技术应用于豆奶粉中,研究豆乳粉的致敏性及结构的变化鲜有报道。因此,本文采用生物解离的方法,研究其对豆奶粉致敏性、分子量及氨基酸组成的影响,并进一步分析脱敏豆奶粉的结构特性的变化。对扩大豆奶粉的应用领域及提升我国大豆产业健康发展具有重要意义。
1 材料与方法
1.1 材料与仪器
黑河43大豆 黑龙江省农业科学院黑河农科所;Alcalase 2.4 L碱性蛋白酶(50万U/g) 诺维信(中国)生物技术有限公司;丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、十二烷基磺酸钠(SDS)、β-巯基乙醇、四甲基乙二胺(TEMED)、考马斯亮蓝R-250、甘氨酸(Gly) 美国Sigma公司;美国磷酸氢二钠、磷酸二氢钠盐酸 天津市耀华化工厂;氢氧化钠 天津市天大化学试剂厂;十二烷基硫酸钠(SDS) 博士德生物有限公司;麦芽糖浆 山东西王糖业有限公司;消泡剂 美博食品科技有限公司;其它试剂 均为国产分析纯。
JE-502电子天平 上海浦春计量仪器有限公司;FA2004电子分析天平 上海舜宇恒平科学仪器有限公司;HH-4电热恒温水浴锅 余姚市东方电工仪器厂;PT-3502G型酶标仪、96孔酶标仪 北京普天新桥技术有限公司;DHG-9240A型电热鼓风干燥箱 上海一恒科学仪器有限公司;PHS-25C数字酸度计 上海大普仪器有限公司;电子万用炉 杭州钱江仪器设备有限公司;GJJ型超高压均质机 美国PHD科技有限公司;HYP-1020型智能消化炉 上海纤检仪器有限公司;Mini电泳仪电泳槽 美国伯乐。
1.2 实验方法
1.2.1 大豆基础理化指标的测定 水分测定GB/T 5009.3-2016;蛋白质测定GB/T 5009.5-2016;脂肪测定GB/T 5009.6-2016;灰分测定GB/T 5009.4-2016;膳食纤维测定GB 5009.88-2014;可利用碳水化合物参照GB 28050-2011,可利用碳水化合物=1-蛋白质含量-水分含量-脂肪含量-灰分含量-膳食纤维含量。
1.2.2 生物解离豆奶粉的制备 大豆生物解离豆奶粉制备流程如下:
大豆→清理→浸泡(6 h)→磨浆(干豆∶水=1∶6)→过滤(过200目筛布)→豆奶→生物解离(2.0‰加酶量,Alcalase 2.4 L碱性蛋白酶,V/V),50 ℃,pH=8,时间0、10、20、30 min)→灭酶(沸水浴10 min)→冷却→调配浓缩(pH=7.0~7.2)→均质(10 MPa,5 min)→喷雾干燥(进口温度140~160 ℃,出口温度85~90 ℃)→生物解离豆奶粉
1.2.3 豆奶粉中过敏原含量的测定 过敏原的提取:称取1 g脱脂豆奶粉于离心管中,加入19 mL的0.1 mol/L的Tris-HCl缓冲液,在室温条件下摇床振荡12 h,3000×g离心20 min,取上清,用0.45 μm膜过滤,再用缓冲液稀释10倍,得待试样。
采用大豆过敏原酶联免疫试剂盒测定大豆过敏原含量:用酶标仪在450 nm波长处测定样品的吸光度,利用标准曲线确定测试样品中过敏原的含量。标准曲线方程:Y=0.0456X+0.0387,R2=0.997。
1.2.4 豆奶粉中蛋白质分子量测定 参照黄苏[10]的方法,称取1 μL的样品置于样品靶位上,再移取1 μL CHCA基质溶液点置于对应的靶位上室温干燥,校准标准品以同样的方法置于与样品靶为相邻的靶位上。在10000~100000 m/z的一级质谱范围内进行图像采集。
1.2.5 豆奶粉中蛋白质水解度测定 参考Nielsen等[11]的方法,即邻苯二甲醛(o-phthaldialdehyde,OPA)法。蛋白质水解度按下式计算:
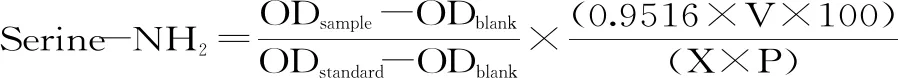
式中:Serine-NH2为meq serine NH2/g蛋白;V为样品体积(L);X为样品质量(g);P为样品中蛋白含量(%);h为水解的肽键数;htot为总肽键数(大豆htot为7.8);α为0.970;β为0.342。
1.2.6 豆奶粉中氨基酸组成测定 采用氨基酸全自动分析仪测定样品中氨基酸组成,取一定量样品于试管中,加入适量浓度为6 mol/L的盐酸并密封试管,将试管置于110 ℃烘箱中水解22 h,水解结束后用孔径为0.45 μm滤膜过滤,将滤液转移至50 mL容量瓶中定容。取1 mL溶液进行浓缩、复溶,重复操作3次后以50 μL的进样量进行过滤进样。测定各样品中各种氨基酸含量[12]。
1.2.7 生物解离豆奶粉原子力显微镜观察 利用原子力显微镜观察样品的微观结构。将制备的样品均匀分散在载玻片的表面。扫描频率为1.0 Hz,扫描区域为5 μm×5 μm和1 μm×1 μm之间,使用Nano Scope Analysis 1.5(Veeco,USA)用于AFM图像分析[13]。
1.2.8 拉曼光谱测定 样品采用BRAVO手持型拉曼光谱扫描仪,扫描波长为785 nm处、扫描功率0.3 W、在400~2000 cm-1的范围内扫描1 min,共扫描4次。将苯丙氨酸的吸收峰值作为归一因子(1003 cm-1),得样品蛋白质的拉曼谱图。采用ACD Labs V12软件进行谱图基线校正、谱峰归属查找[14]。
1.3 数据统计
2 结果与分析
2.1 大豆基础理化指标
黑河43大豆籽粒的水分含量为9.4%±0.2%,在粮食储藏安全水分以下;蛋白质含量为41.0%±0.1%,属于高蛋白型大豆;脂肪含量16.5%±0.2%,灰分含量5.4%±0.1%,膳食纤维含量5.0%±0.3%,碳水化合物含量为22.7%±0.4%。
2.2 生物解离对豆奶粉致敏性的影响
由图1可知,随着生物解离时间的增加,豆奶粉中过敏原含量呈先降低后趋于平缓的趋势。在生物解离10 min时豆奶粉过敏原含量显著降低(P<0.05),与未经生物解离的豆奶粉相比,过敏原含量降低了20.7%。在生物解离作用时间20和30 min时,豆奶粉中致敏原含量变化不显著(P>0.05)。进一步说明了适当的生物解离时间可有效降低豆奶粉中的致敏原含量,可能是由于豆奶粉在碱性蛋白酶的作用下,大分子的致敏性蛋白降解为致敏性较低的小分子肽,从而降低了豆奶粉的致敏性。这与Meinlschmidt等[15]研究结果一致。
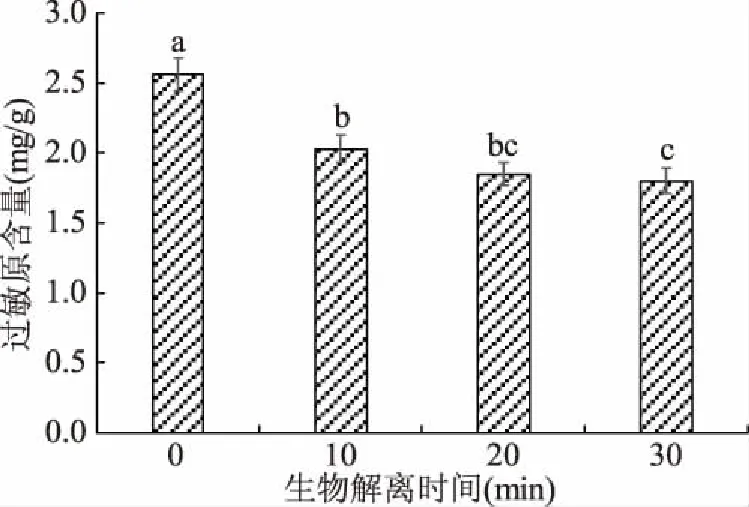
图1 生物解离时间对过敏原含量的影响
2.3 生物解离对豆奶粉中蛋白质分子量的影响
生物解离时间对豆奶粉中蛋白质分子量影响的分布如图2所示,豆奶粉中的蛋白质分子量均在5 kDa以上,经生物解离作用后,大分子的蛋白质变为小分子的蛋白质,分子量不断减小。在生物解离作用时间为10 min时,蛋白质分子量在2~4 kDa的含量最高。在生物解离30 min时,0~2 kDa的小分子肽含量最高,随着生物解离时间的不断增加,肽含量随之增加。分子量的变化进一步说明了豆奶粉中蛋白质致敏性降低与生物解离蛋白质分子量的降低有关。

图2 生物解离时间对豆奶粉中蛋白质分子量影响
2.4 生物解离对豆奶粉中蛋白质水解度的影响
蛋白质的水解度是指蛋白质分子经水解后,断裂的肽键数与蛋白质分子中总肽键数的比值[16]。在生物解离作用下,豆奶粉的蛋白质分子被水解后,其功能性质会发生改变,并对豆奶粉的溶解性及稳定性等产生影响[17]。生物解离时间对豆奶粉中蛋白质水解度的影响如图3所示,随着生物解离时间的增加,蛋白质的水解度不断增加。在生物解离作用时间为10 min时,蛋白质的水解度变化显著,生物解离作用时间20与30 min时,蛋白质的水解度变化不显著。豆奶粉中蛋白质经生物解离后,极性集团与小分子肽增加,亲水性增强,从而利于提高豆奶粉的溶解性。

图3 生物解离时间对豆奶粉中蛋白质水解度的影响
2.5 生物解离对豆奶粉中氨基酸组成的影响
不同生物解离时间条件下,豆奶粉中氨基酸含量如表1所示,经生物解离后,豆奶粉蛋白质中Met含量显著降低,而Thr、Gly、Cys、Val、Ile呈升高的趋势。这是由于在生物解离过程中,蛋白质的构象发生了一定程度的变化,导致一些氨基酸侧链基团从蛋白质分子的内部结构中暴露出来,生物解离程度越深,氨基酸暴露的含量就越多[18],而带有苯环的芳香族氨基酸多是疏水性氨基酸,因此生物解离导致了疏水性氨基酸百分比增加[19]。另外,Fischer等[20]研究表明生物解离后,疏水性氨基酸引起的疏水性相互作用对肽聚集有很大贡献,使蛋白质的肽链越来越短,其受到的空间阻碍越来越弱,这时肽链更容易通过疏水相互作用发生聚集,从而引起部分疏水性的降低。

表1 生物解离对豆奶粉中氨基酸组成的影响
2.6 生物解离豆奶粉原子力显微镜观察
原子力显微镜用以观察样品中蛋白的形貌特征,并观察蛋白质是分散或聚集状态[21]。由图4可知,在生物解离0和10 min的条件下,样品形态明显,表面不光滑,呈现出了分子聚集现象,并呈现α亚基结构的花骨形和α′亚基或β亚基结构的虫形。比较发现,在生物解离20 min的条件下样品表面较平滑,以单个分子状态存在,未出现7S的亚基的聚集体。在生物解离30 min条件下,再次呈现了分子的聚集现象。

图4 生物解离时间对豆奶粉中蛋白质微观结构的影响
2.7 生物解离豆奶粉拉曼光谱分析
拉曼光谱是研究分子相互作用的一种有效的手段,因此常采用拉曼光谱法分析蛋白中氨基酸及二硫键构象的变化。在拉曼光谱测定中,谱线强度与散射中心(化学键和基团)数目为正比例关系[22-23]。因此,依据样品拉曼谱线强度可以判断样品中特定化学键或基团的变化程度大小,谱线强度变小表明样品中蛋白质对应的基团或化学键受到破坏,含量变少。而谱线的偏移说明对应的化学键或基团发生了变化[24-25]。
生物解离不同时间下豆奶粉蛋白质的拉曼图谱分析如图5所示。随着生物解离时间的增加,豆奶粉中蛋白的谱线强度变弱,表明生物解离程度的加深,破坏了蛋白质中的基团或化学键。但蛋白质的谱线并未发生偏移,说明对应的化学键与基团并未发生变化。在拉曼光谱中500~550 cm-1处一般作为二硫键的谱带。此二硫键谱带区间上位移和拉曼振动模式的关系是:500~510 cm-1处为gauche-gauche-gauche(g-g-g)模式,515~525 cm-1gauche-gauche-trans(g-g-t)模式,535~545 cm-1为trans-gauche-trans(t-g-t)模式,经生物解离后豆奶粉蛋白质的分子内二硫键构型为g-g-g构型[26-28]。

图5 生物解离时间对豆奶粉中蛋白质微观结构的影响
3 结论
豆奶粉因其营养丰富,口感醇厚,受到广大消费者的喜爱,但豆奶粉的致敏性限制了部分人群的食用,本研究表明生物解离技术可有效降低豆奶粉中蛋白质的致敏性,经生物解离10 min后,豆奶粉的致敏性显著降低了20.7%。蛋白质的水解度增加,并产生了分子量小于1.0 kDa的大豆多肽。拉曼光谱分析显示蛋白质分子内的化学键及基团受到了一定程度的破坏。对于在生物解离过程中具体被破坏、暴露或掩埋的抗原表位有待进一步研究。对进一步揭示不同处理方式对大豆及其制品致敏性的影响机理,开发低致敏性或无致敏性的大豆及其制品具有重要意义。

