Comamonas testosteroni 5-MGAM-4D来源的腈水合酶基因重组菌对腈类化合物的全细胞催化活性
刘胜先,杜文静,崔宝程,黄 姣,郭 祎,王 黎
(大连理工大学生命科学与药学学院,辽宁盘锦 124221)
酰胺类物质是重要的精细化工原料和医药中间体。腈水合酶(Nitrile Hydratase,NHase,EC 4.2.1.84)是一种能够催化腈类化合物水合成酰胺类化合物的金属酶,具有很高的工业应用价值[1-2]。NHase广泛存在于微生物群体中,如红球菌(Rhodococcussp.)、假单胞菌(Pseudomonassp.)、假诺卡氏菌(Pseudonocardiasp.)、农杆菌(Agrobacteriumsp.)、芽孢杆菌(Bacillussp.)、棒杆菌(Corynebacteriumsp.)及短杆菌(Brevibacteriumsp.)等微生物中[3-4]。与传统的化学合成法相比,采用腈水合酶生物催化法生产酰胺类化合物具有反应条件温和,专一性强,催化效率高的优势,同时反应在常温常压下进行,污染少,相对设备投资低,克服了很多化学生产的不足[5-6]。目前,在发达国家如美国、日本等,利用腈水合酶生产酰胺类物质这项生物技术正在逐步取代传统的化学法[7-8]。
目前,采用腈水合酶生物法生产酰胺化合物有一部分是采用野生菌细胞,但是用从自然界土壤取样分离筛选获得野生产酶菌株的方式获得高产酶菌株具有偶然性很大、成功率极低、酶活力差等局限性[9],且大多数野生腈水合酶产生菌也会产酰胺酶,酰胺酶会使腈水合酶催化的产物酰胺转化为相应的酸,从而在一定程度上降低酰胺的产量[10-11]。因此通过基因克隆手段获得高效表达腈水合酶的基因工程菌具有很多野生菌不可替代的优点,基因工程菌中腈水合酶基因可单独克隆,不会相互干扰,不会因产酸降低了发酵液的pH而抑制酶的活性,基因工程菌背景清晰,利于对基因表达调控机理进行深入研究,同时它的适应性强、发酵周期短、易于实现大规模培养和工业化生产,有着更广阔的应用前景[3,12]。
丙烯酰胺和己二酰二胺是重要的精细化工原料和医药中间体,在化工生产中是一种非常重要的原料,其需求量大且用途广[13-15]。用生物法生产丙烯酰胺和己二酰二胺符合绿色化工中经济环保理念,是一种必然的趋势,但野生型菌株普遍存在稳定性低活性低的问题,工业化应用仍十分有限[16-19]。在我国,腈水合酶生成酰胺的生物技术虽然起步较晚但发展很快,但随着市场的不断拓展,对酰胺的需求仍在不断增长,仍需要大量的进口。因此急需拓展高效产腈水合酶菌来弥补国内行业不足和空缺[20]。
睾丸酮丛毛单胞菌Comamonastestosteroni5-MGAM-4D被发现具有腈水合酶基因[21-22],但野生型菌株对腈类物质的催化活性远低于发达国家已工业化应用的R.rhodochrousJ1以及Pseudomonasputida来源的腈水合酶[23-24]。本研究以野生菌Comamonastestosteroni5-MGAM-4D来源的腈水合酶基因为研究对象,通过基因工程手段构建高效表达腈水合酶的基因重组菌CtNHase,探讨基因重组菌CtNHase对腈类化学物的生物转化活性,以期为工业化应用的发展提供理论依据。
1 材料与方法
1.1 材料与仪器
CtNHase基因序列 GenBank AY743666.1;PCR引物、载体pET-24a(+) 常州基宇生物技术有限公司合成;大肠杆菌 本实验室保藏;丙烯腈 色谱纯,上海生工生物工程有限公司;己二腈、丙烯酰胺、己二酰二胺、乙酰胺 分析纯,上海麦克林生化科技有限公司;甲醇 色谱纯,上海麦克林生化科技有限公司;胰蛋白胨、酵母提取物 美国Thermo Fisher Scientific公司;IPTG、卡那霉素 上海生工生物工程有限公司;琼脂糖凝胶DNA柱式回收试剂盒、质粒小提试剂盒 日本TaKaRa公司;电泳相关试剂 均为国产;LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L(固体培养基再加入琼脂粉20 g/L),高压灭菌后需加入终浓度为50 μg/mL的卡那霉素再使用。
PCR仪 日本TaKaRa公司;分析天平 德国Sartorius集团;恒温摇床 上海智城分析仪器制造有限公司;超净工作台 上海尚道仪器制造有限公司;电泳系统 北京六一仪器厂;低温冷冻离心机、超低温冰箱 美国Thermo Fisher Scientific公司;pH计 上海雷磁仪器厂;S6000高效液相色谱仪 华谱科仪科技有限公司;气相色谱仪 大连中汇达科学仪器有限公司。
1.2 实验方法
1.2.1 质粒CtNHase的构建
1.2.1.1 目的基因扩增PCR引物 Forward:TTGTTT AACTTTAAGAAGGAGATATACATATGGGGCAATCAC ACACGCATGACCACCATCG;引物Reverse:AGCCGG ATCTCAGTGGTGGTGGTGGTGGTGCTCGAGTCACAA GCCCCAGCGACGCCACCA(5′-3′);PCR反应过程为:在98 ℃预变性3 min后开始循环,98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸60 s,共30个循环;于72 ℃下终延伸10 min。最后采用琼脂糖凝胶电泳验证扩增结果并对产物进行回收。
1.2.1.2 链接载体 采用限制性内切酶 NdeI和XhoI使载体pET-24a线性化;利用无缝克隆技术将载体与扩增后目的基因片段链接。
1.2.1.3 转化大肠杆菌感受态细胞 通过低温和钙离子刺激制备E.coliTOP 10感受态细胞,取一支感受态细胞于冰上,待溶解后加入10 μL连接液,轻轻旋转以混匀内容物,在冰中放置30 min;将离心管放到预加温到42 ℃的恒温水浴锅中热激90 s,然后快速将离心管转移到冰浴中,使细胞冷却2~3 min;每管加900 μL LB培养液,将其转移到37 ℃摇床上,温育1 h使细菌复苏;取恰当量的转化菌液按不同浓度梯度涂布于固体LB平板上,倒置于恒温培养箱中37 ℃培养16 h。
1.2.1.4 菌落PCR鉴定转化子 挑取平板上长出的转化子重悬于10 μL LB液体培养基中,从中取1 μL做模板进行菌落PCR鉴定。引物Forward:TTGTTTAACTTTAAGAAGGAGATATACATATGGGGC AATCACACACGCATGACCACCATCG;引物Reverse:TGGTGGCGTCGCTGGGGCTTGTGACTCGAGCACCAC CACCACCACCACTGAGATCCGGCT(5′-3′)。PCR反应过程为:在94 ℃预变性5 min后开始循环,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共30个循环;于72 ℃下终延伸10 min。最后采用琼脂糖凝胶电泳验证扩增结果并对产物进行回收。
1.2.1.5 阳性克隆酶切验证 将阳性克隆扩增培养通过质粒小提试剂盒进行回收,采用限制性内切酶XhoI和MluI对重组质粒进行酶切,并采用琼脂糖凝胶电泳验证结果。
1.2.2 重组菌诱导培养及表达验证 选择常规表达菌种E.coliBL21(DE3)和低温诱导表达菌E.coli Arctic Expression(DE3)同时进行重组质粒的表达验证,具体步骤如下。
1.2.2.1 菌体培养 将质粒1 μL分别加入100 μL BL21(DE3)和Arctic Expression(DE3)感受态细菌中,置于冰上20 min;42 ℃热激90 s,迅速置于冰中,3 min后加入600 μL LB培养液;37 ℃,220 r/min振摇培养1 h,取200 μL菌液涂布于含50 μg/mL Kan的LB固体平板,37 ℃倒置培养过夜;次日挑取2个BL21(DE3)和1个Arctic Expression(DE3)的单克隆分别接种于含50 μg/mL Kan的4 mL LB液体培养基的摇菌管中,37 ℃ 220 r/min振摇培养8 h左右,后转移至含100 mL锥形瓶中扩增培养至OD值约0.6~0.8;分别加入Co2+使其终浓度0.05 g/L,BL21(DE3)一管不加IPTG做阴性对照,一管加IPTG至终浓度为1 mmol/L,37 ℃诱导3 h。Arctic Expression(DE3)的单管加IPTG至终浓度0.1 mmol/L,16 ℃诱导过夜;次日,4000×g,10 min离心去上清收集菌体。
1.2.2.2 菌体破碎 将离心后的菌体重悬于20 mmol/L PBS(pH7.4)缓冲液中,冰浴超声破碎。设置条件为300 W功率,破碎2 s,间隔5 s,共50个循环。完成后18000×g离心20 min分别收集上清液和沉淀。
1.2.2.3 SDS-PAGE分析 选用12%分离胶及5%浓缩胶,将样品与上样缓冲液混合后每孔上样15 μL,电泳条件为先80 V运行20 min后160 V运行100 min。电泳结束后取出胶,用考马斯亮蓝溶液进行染色1 h,后选用脱色液过夜脱色,分析实验结果。
1.2.3 催化性能探究
1.2.3.1 菌悬液制备 将一定量培养好的重组菌发酵液4000×g离心处理10 min,去上清后用磷酸缓冲液重复洗涤菌体2次,最终用原发酵液1/20体积的磷酸缓冲液将菌体重悬,得静息细胞悬液,测定菌体浓度后4 ℃保存备用。
1.2.3.2 催化丙烯腈 反应体系包含0.5 mL纯丙烯腈、0.2 g乙酰胺、菌液(终浓度3 mg(dcw)/mL)及去离子水共15 mL。30 ℃振荡反应,取样加入等体积HCl以终止反应,18000×g离心5 min,取上清液经0.22 μm滤膜过滤,送样进行气相色谱检测。
1.2.3.3 催化己二腈 反应体系包含50 μL 500 mmol/L己二腈、菌液(终浓度3 mg(dcw)/mL)及磷酸缓冲液共500 μL。振荡反应,控制反应温度和时间,加入等体积甲醇以终止反应,18000×g离心5 min,取上清液稀释适当倍数后经0.22 μm滤膜过滤,送样进行液相色谱检测。
1.2.3.4 影响因素 以己二腈为底物探究重组菌反应最适pH:反应体系中分别选用pH为5.0、5.5、6.0、6.5、7.0、7.4、8.0、8.5、9.0的磷酸缓冲液,30 ℃、220 r/min振荡反应3 min。pH稳定性:反应前将菌体分别重悬于pH为5.0、5.5、6.0、6.5、7.0、7.4、8.0、8.5、9.0的磷酸缓冲液孵育1 h,30 ℃、220 r/min振荡反应3 min。探究反应最适温度:反应时选用pH=7.4的磷酸缓冲液,分别在20、25、30、35、40、45、50 ℃条件下,220 r/min振荡反应3 min。热稳定性:反应前将菌体分别在20、25、30、35、40、45、50 ℃条件下孵育1 h,30 ℃、220 r/min 振荡反应3 min。通过产物己二酰二胺的生成量进行定量酶活计算,并设置每组最高酶活为参照(100%),以相对活性表示不同因素的影响情况。
1.2.4 重组腈水合酶(CtNHase)酶活测定 重组腈水合酶(CtNHase)进行催化时的一个酶活力单位(IU)定义为:在30 ℃,pH=7.4的条件下,每min生成1 μmol产物所需要的酶量。
丙烯腈及其催化产物检测采用气相色谱:FFAP GC柱(30 m×0.32 mm×0.5 μm);进样口260 ℃,FID检测器260 ℃,升温程序为柱温190 ℃,以10 ℃/min升至240 ℃,载气(He)流速1.0 mL/min,压力2.3 kPa,进样量0.2 μL;分流比10∶1。采用内标法,以乙酰胺为内标物,绘制产物丙烯酰胺和乙酰胺两者间质量比与气相峰面积间关系曲线,进行定量计算。
己二腈及其催化产物检测采用高效液相色谱:Ultimate LP-C18柱(5 μm,4.6×250 mm);流动相为25 mmol/L磷酸水溶液和甲醇(89∶11,V∶V),检测波长200 nm,柱温30 ℃,流速1 mL/min。采用外标法,绘制产物己二酰二胺浓度与液相峰面积间关系曲线,进行定量计算。
1.3 数据处理
气液相数据经原始数据记录软件导出后经Excel软件计算处理,标准曲线和反应影响因素探究图像由Origin软件绘制得到。标曲每点数据由6组平行实验去掉最大最小值后取平均值得到,其他数据均为3组平行实验得到。
2 结果与分析
2.1 重组质粒CtNHase构建与表达
来源于睾丸酮丛毛单胞菌(Comamonastestosteroni5-MGAM-4D)的腈水合酶的核苷酸序列含有1576个核苷酸,经PCR扩增基因片段,电泳验证如图1a所示,选择pET-24a(+)为表达载体,选择NdeI(CATATG)和XhoI(CTCGAG)作为酶切位点插入CtNHase基因片段,选用lacI启动子,加入卡那霉素KanR抗性基因片段,选用T7终止子,转化大肠杆菌TOP10,图1b所示为菌落PCR电泳验证结果,得到阳性克隆。
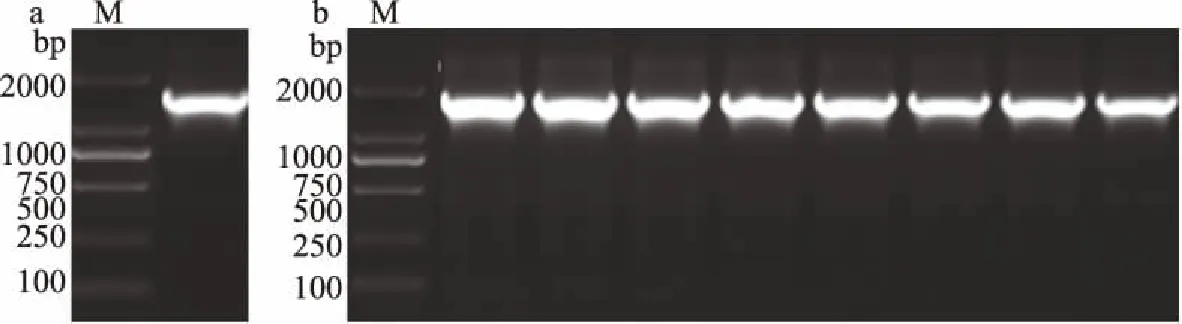
图1 PCR电泳图
根据质粒图谱(图2),重组质粒经XhoI/MluI双酶切,得到两条带分别约为2397、4404 bp,与图3a Lane 2相对应,证实质粒的成功构建。
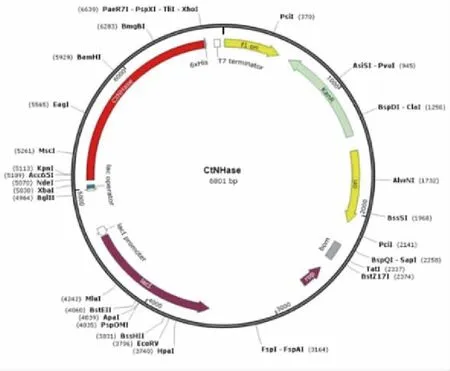
图2 质粒CtNHase谱图
将质粒转化入大肠杆菌感受态中,得到重组菌CtNHase,通过SDS-PAGE验证重组蛋白能否表达。由于工业用野生型菌均具有培养时间长,蛋白表达量低等问题,而大肠杆菌过表达系统具有明显的菌体生长速度快、蛋白表达量高等优势[12,25],如图3b所示,通过箭头可以看到,腈水合酶在两种菌的上清中均有大量表达,其中低温诱导的Arctic Expression(DE3)产生的蛋白包涵体更少,上清中腈水合酶表达更高,因此后续实验选用该重组菌进行催化活性探究。
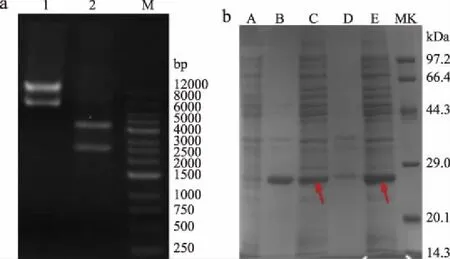
图3 质粒双酶切(a)与重组质粒(b)的蛋白表达电泳图
2.2 基因重组菌CtNHase的催化活性
2.2.1 催化丙烯腈 采用内标法对丙烯腈及丙烯酰胺进行气相色谱检测,选取乙酰胺作为内标物,称取不同质量比的标样及内标物,溶于15 mL水中模拟反应体系,在1.2.4所述检测方法下进样0.20 μL,重复6次,取得各样品的峰面积,分析结果见表1。
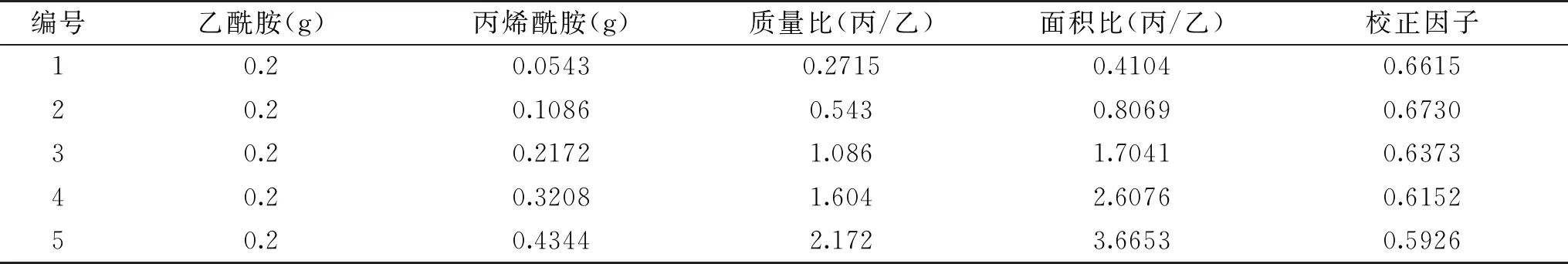
表1 线性范围测定表
图4a所示为反应4 h时的气相色谱图,可见丙烯腈出峰时间1.66 min,乙酰胺出峰时间2.47 min,丙烯酰胺出峰时间2.97 min。如图4b所示,以标样产物峰面积与内标峰面积比为纵坐标,标样产物质量与内标质量之比为横坐标作内标校正曲线图,将数据作线性回归处理,得到方程Y=1.6456x,R2=0.9964。通过此方法计算可以准确的对丙烯酰胺产量进行定量研究。采用静息细胞反应,重组菌CtNHase可在5 h内完全转化终浓度500 mmol/L的丙烯腈生成丙烯酰胺。
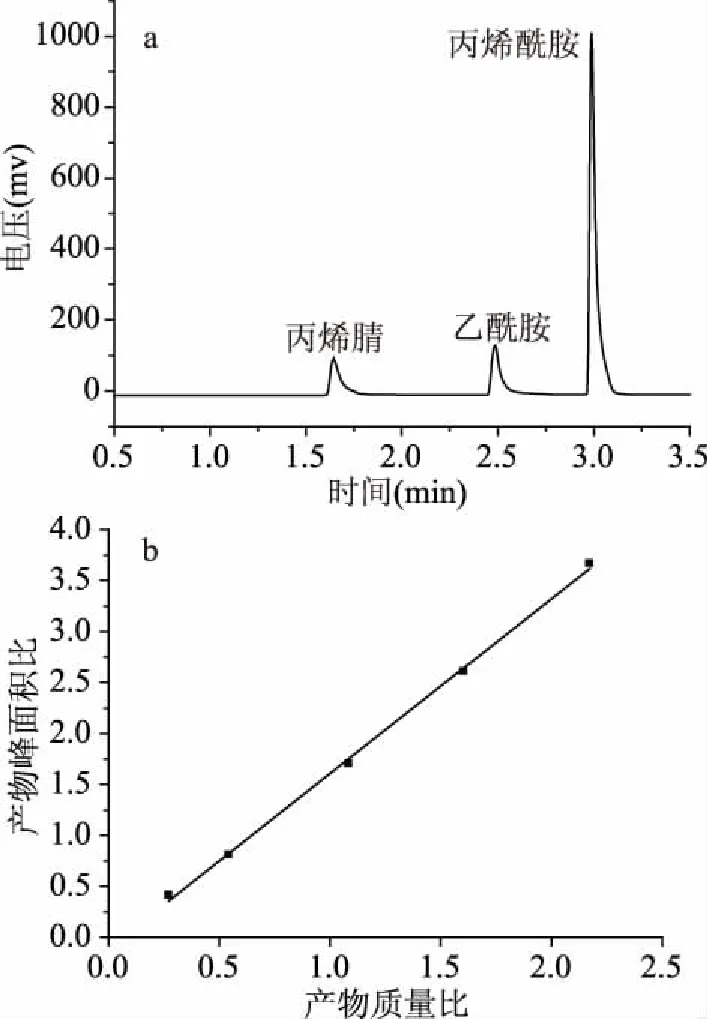
图4 催化丙烯腈反应4 h气相色谱图和内标校正曲线
2.2.2 催化己二腈 液相谱图如图5a所示,己二酰二胺出峰时间4.34 min,己二腈出峰时间15.5 min(由于浓度过低,己二腈峰面积极小,故图5无显示)。采用外标法对己二酰二胺含量进行高效液相色谱检测,如图5b所示,选取己二酰二胺浓度为2~12 mmol/L,重复进样6次,计算峰面积平均值,并进行线性回归,得到标曲方程Y=1268.1238x,R2=0.99967。采用静息细胞反应,重组菌CtNHase在5 min内即可将终浓度50 mmol/L的己二腈完全转化成己二酰二胺,酶活可达5567 U/g(dcw),高于目前文献报道[26]。
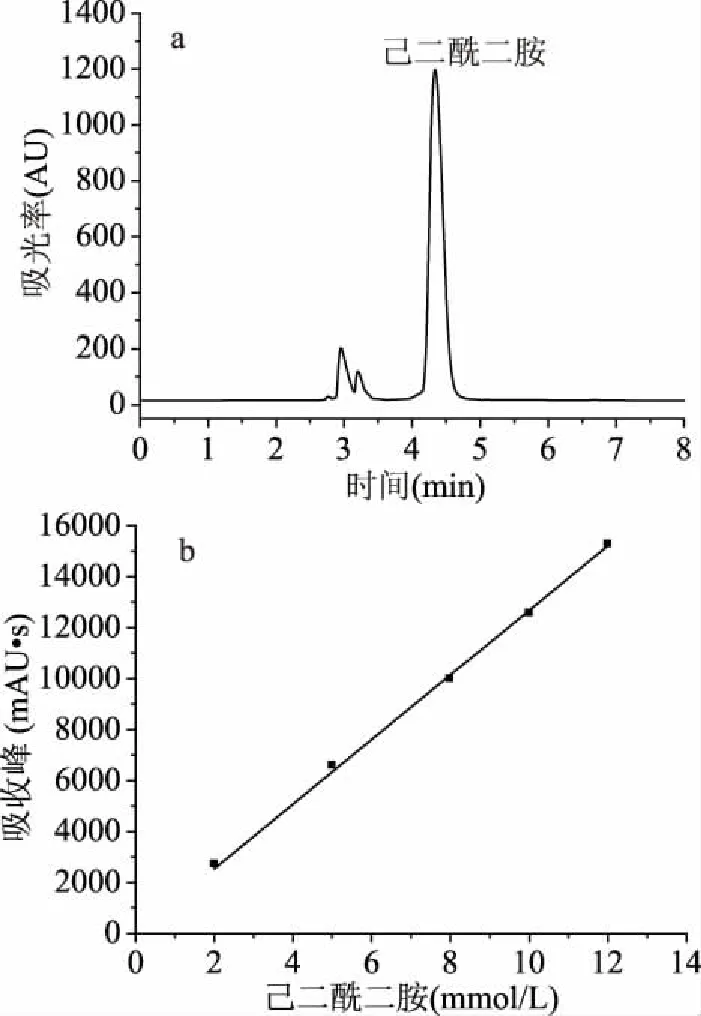
图5 催化己二腈反应5 min液相色谱图和产物标准曲线
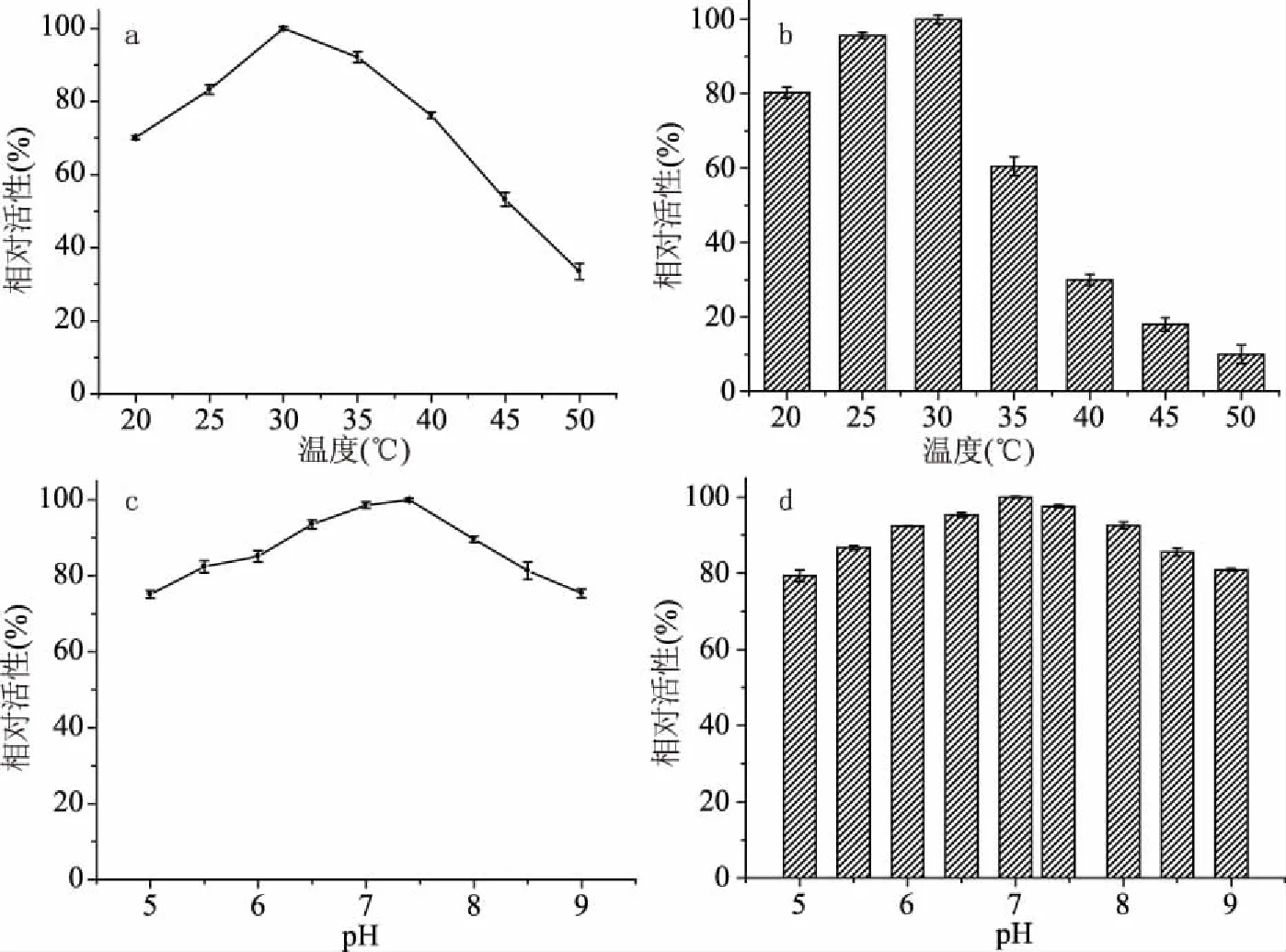
图6 不同因素对基因重组菌CtNHase催化活性影响
2.3 温度和pH对基因重组菌CtNHase催化活性的影响
如图6a所示以最高酶活为参照,反应的最适温度为30、35 ℃时仍有较高的相对活性,温度持续升高后酶活下降;如图6b所示为重组菌关于温度稳定性的曲线,可以看出低温时菌体的稳定性较好,30 ℃时菌种活性最高,温度高于35 ℃后酶活迅速下降,证明该重组菌非嗜热型菌种,高温下易失活。
如图6c所示为重组菌关于反应时缓冲液pH影响的曲线,在中性环境下pH=7.4时酶活最高,为最佳反应条件;以最高酶活做参照,如图6d所示得到重组菌关于pH稳定性的曲线,可以看出缓冲液pH对酶活影响不大,pH在5~9范围内酶活均在80%以上,说明该菌具有良好的pH稳定性。
以上结果表明基因重组菌CtNHase对己二腈的最佳催化反应条件为30 ℃,pH7.4。
3 结论
本研究成功构建了野生菌Comamonastestosteroni5-MGAM-4D来源的腈水合酶基因重组菌CtNHase,发现在pH=7.4,30 ℃的最佳反应条件下,基因重组菌CtNHase可在5 min和5 h内分别完全转化50 mmol/L己二腈和500 mmol/L丙烯腈生成己二酰二胺和丙烯腈。本实验结果说明基因重组菌CtNHase可高效转化腈类化合物为酰胺类化合物。鉴于酰胺类化合物具有极高的工业应用价值,因此本研究下一步会深入对酶的固定化操作进行探究,进一步提升催化效率,以期为真正的工业化生产提供理论依据,为绿色化学的发展添砖加瓦。

