高压干热处理对紫苏粉的灭菌作用和促成分溶出作用*
咩咩此里,阿 茸,李 月,殷 华,段金连,段为钢△
(1.云南中医药大学云南省中医药学分子生物学重点实验室,云南 昆明 650500;2.迪庆州藏医医院制剂室,云南 香格里拉 674400)
热处理是制药和食品工艺中常见操作,多用于灭菌和炮制[1-9]。物品消毒灭菌的方法很多,总体上分为物理法和化学法。制药工艺常采用物理法进行消毒灭菌。对于制剂成品,可靠的消毒灭菌方式是高压湿热灭菌和辐照灭菌[1]。辐照灭菌所需的硬件设施要求较高,一般建立在较发达城市,不方便较偏远的制药企业或医院使用。高压湿热灭菌对硬件设施要求较低,灭菌也很彻底,但灭菌过程涉及到水蒸气加热,可能会使灭菌物潮化,继而需要烘干等操作,不适用于不耐湿物料。干热灭菌可以避免灭菌物潮化的问题,但目前采用的都是常压干热处理[4,7],因温度高(135℃以上)、时间长(180~200℃要0.5~1 h,135~140℃要3~5 h),灭菌后物料失重明显,对物料的性状影响较大,在制药工艺鲜有应用。
本研究试图结合高压湿热灭菌和常压干热灭菌的优点,开发一种高压干热灭菌技术,在检验灭菌效果的同时也考察其对中药材(粉末)溶出的影响。
1 材料与方法
1.1 材料 中药紫苏 (Perilla frutescens(L.)Brltt.var.arguta Benth.Hand.-Mazz.)为野生,产自湖南,经云南中医药大学药用植物学教研室鉴定。全自动高压蒸汽灭菌器和干热灭菌器为日本天美产品,透紫外平底96孔板为Greiner产品,Tecan多功能酶标仪(Infinity 200pro)为奥地利产品。
1.2 药材加热处理 将紫苏梗干燥粉碎过40目筛。精密称取17份0.4 g紫苏粉分别装于容积为15 mL的带盖耐压塑料试管中。其中一管为对照,不进行加热处理(标记为加热0 min);其余以4管为一组,共4组。第1组开盖置于高压蒸汽灭菌器中(高压湿热),第2组盖紧后置于高压蒸汽灭菌器中(高压干热),第3组盖紧置于干热灭菌器中(常压密闭干热),第4组开盖置于干热灭菌器中(常压开放干热),分别于 110 ℃(0.143 MPa)加热 15、30、60、120 min。加热时间以达到温度开始计算,热处理完毕自然降温到60℃后拧紧试管盖取出恢复至室温。精密称量灭菌前后药粉的重量变化。
另取17份0.4 g紫苏粉如法在 121℃(0.204 MPa)进行加热。以上实验各重复3次。
1.3 药材无菌检查 在各试管内加入5 mL无菌蒸馏水,盖紧盖子平放于旋转摇床上100 r/min振摇6 h。于4℃静置2 h以上,取上清0.5 mL在无菌操作条件下涂布于灭菌LB琼脂平板(蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂10 g,121℃高压灭菌30 min后制得)上,于37℃培养过夜。观察LB固体培养基上的菌落生长情况,拍照记录。
1.4 药材溶出物检查 将试管于3 000 r/min离心10 min,取上清液200 μL加入到透紫外的96孔板中,用酶标仪扫描230~800 nm吸收曲线,2 nm步进。如果波长范围内最大吸收值超过2,加水稀释1倍再扫描,记录稀释倍数。在扣除同等体积无菌水背景后,将OD值乘以稀释倍数得到原液的原始吸收值。按照文献方法求出等吸光点[10],计算等吸光点前的吸收光谱曲线下面积以反映药材的溶出物。
2 结果
2.1 紫苏粉末高压干热前后的重量变化 高压湿热处理会导致中药粉末吸潮,重量增加;而高压干热和常压闭盖处理药粉的重量变化相对不明显;常压开盖处理则药粉的重量减轻最明显。与110℃处理(图1A)相比,121℃处理(图1B)会进一步加剧重量变化,见图1。

图1 紫苏粉110℃(0.143 MPa)热处理(A)和121℃(0.204 MPa)热处理(B)后的重量差异变化
2.2 高压干热处理对药材微生物的影响 热处理能抑制甚至杀灭微生物。未被热处理的紫苏粉浸出液上清(0 min)能培养出大量的细菌(图2A、图3A);110℃高压湿热处理15 min及以上不能培养出细菌菌落(图2A);高压干热处理15 min可培养出个别菌落(图2B),但处理30 min以上就不能培养出菌落;而常压热处理(图2C、图2D)灭菌效果较差。121℃热处理的灭菌效果进一步增强,但常压15 min处理(图3C、图3D)的样品仍有个别菌落被检出。以上结果说明,在相同温度下,高压处理(图3A、图3B)效果总体上优于常压处理(图3C、图3D),见图 2、图 3。
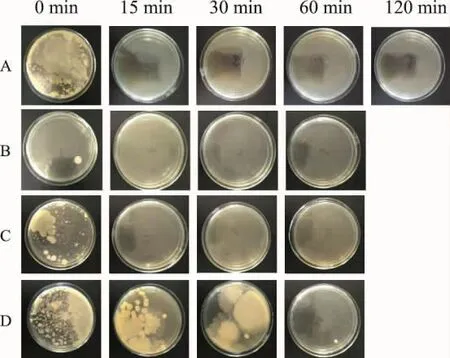
图2 110℃(0.143 MPa)不同方式热处理的灭菌效果
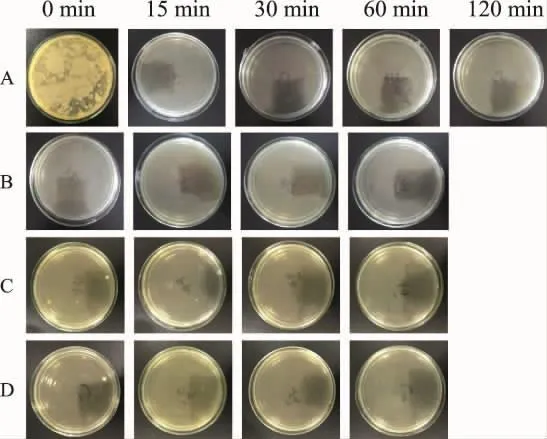
图3 121℃(0.204 MPa)不同方式热处理的灭菌效果
2.3 高压干热处理对药材成分溶出的影响 不同方式热处理后溶出物的吸收光谱参见图4、图5。紫苏粉溶出物在370 nm处存在等吸光点,等吸光点前的紫外区(230~370 nm)吸收值(图6)能在一定程度总体反映药物分子的溶出情况。
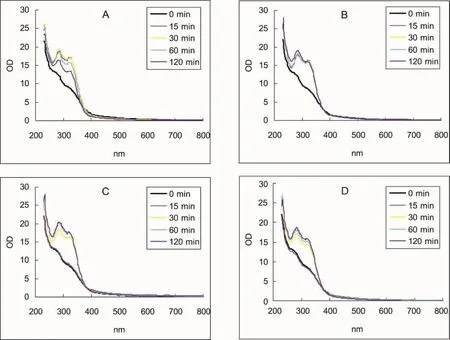
图4 110℃(0.143 MPa)对紫苏粉成分溶出的影响(吸收曲线)

图5 121℃(0.204 MPa)对紫苏粉成分溶出的影响(吸收曲线)
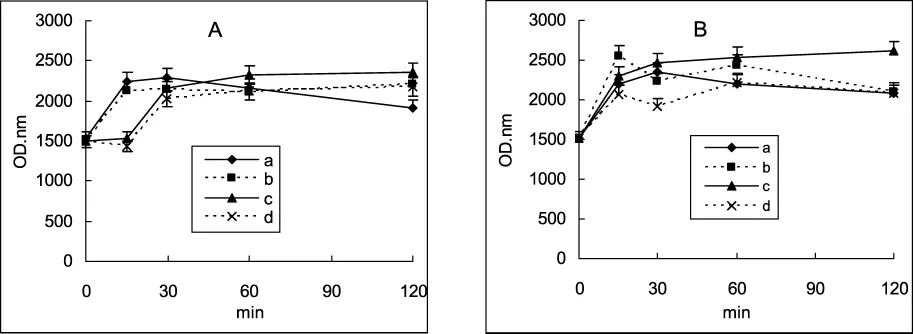
图6 110 ℃(0.143 MPa)(A)和 121 ℃(0.204 MPa)(B)不同方式对药材小分子成分溶出的影响(吸收曲线下面积230~370 nm)
高压110℃热处理(图4A、图4B)药材粉末15 min即可增加溶出物的紫外吸收,以高压干热方式(图4B、图6A)增加较明显。此温度下常压热处理15 min则几乎无效,延长热处理时间则可增加溶出物的紫外区吸收(图4C、图4D)。
当进行121℃热处理时,各种加热方式均能增加溶出物紫外区的吸收(图5),但常压加热(图5C、图5D)的紫外最大吸收值低于高压加热(图5A、图5B)的吸收值。特别地,高压干热处理(图5B)15 min增加吸收值的能力即处在最大水平(图6B)。
3 讨论
由于缺乏高压干热处理装置,本文将样品置于密闭的试管内进行湿热处理实现近似的高压干热处理操作。从以上结果看,在同等温度和同等加热时间,高压湿热处理的灭菌效果最好,其次即为高压干热处理,而常压热处理的灭菌效果较差。因此,考虑到处理后不需要干燥的优势,高压干热处理仍是值得推荐的。理论上,高压干热处理后的样品不应该存在重量差异,本研究也证实高压干热处理的样品重量变化最小。如果要进行灭菌操作,121℃ 15~30 min、110℃30~60 min的高压干热处理是值得推荐的。
紫苏含有挥发油成分和黄酮类等固体物成分[11],本研究还用该药材粉末模拟热处理对中药成分溶出的影响。根据前期中药注射剂的研究结果,发现大多中药的“活性成分”均具有较明显紫外吸收[10,12],甚至等吸光点前的吸收曲线下面积能综合反映活性成分的多少,因此本文采用该特性“综合”考察了热处理对中药成分的溶出影响。未被热处理的中药溶出物紫外吸收值较小,而热处理后的中药溶出物紫外吸收明显增加,甚至还依次在290 nm和330 nm出现了明显的吸收峰;这表明热处理有助于药材成分的溶出,这可能与热处理改变了植物细胞膜或细胞壁结构有关。考虑到高压干热处理对药材总体的重量影响较小,推测对药材的性状影响也较小。对于中药紫苏粉末而言,110℃15 min似乎就取得了较好的促药材成分溶出作用,同时大大地降低了药材的微生物载量,但对其他药材的影响如何,仍需进行试验。不管怎样,该法在某些物料的处理中值得试用。
从机理上看,高压热处理阻止了热量向外界扩散,有利于热量在加热体系内传递,从而有利于生物大分子物质发生变性、有利于杀菌、凝固药材细胞并有利于活性成分释放。高压干热处理的传热介质是空气,高压湿热处理的传热介质是水蒸气。由于水蒸气存在汽化热,在热传递方面更加充分,因此高压干热处理的灭菌效果会略低于高压湿热灭菌。相反,常压加热,气体会膨胀扩散到外界,热量散失多而不利于热量进入物体中,灭菌的效果会下降。
高压湿热和常压干热法在食品和药品灭菌工艺中有着较广泛的应用[1],也取得一定效果。但高压干热法却罕见报道,本研究为物料的灭菌和中药炮制提供了一种选择。将药材加热121℃30 min或110℃30 min可能在增加溶出的同时会导致药材成分变化。考虑到水是化学反应的重要介质,因此可以肯定的是,该方法所致的药物成分影响会弱于高压湿热灭菌。考虑到该条件在药物炮制过程中并不算剧烈,该方法也可以供中药炮制参考。然而,更为紧要的是要研制此类设备,以满足医院和制药企业的需求。

