傣百解对肠道黏膜屏障功能的保护作用及机制研究*
杨丽萍,陈 普,张光云,段小花
(云南中医药大学云南省傣医药与彝医药重点实验室,云南 昆明 650500)
肠道黏膜屏障不仅能帮助机体消化吸收各种营养物质,还能维持肠道内菌群稳定,防治各种有害物质和内毒素对肠道的侵害。肠道黏膜屏障由机械屏障、免疫屏障、化学屏障和生物屏障组成,其中机械屏障是最为重要的一道防线[1],它由完整的肠道上皮细胞及上皮细胞间紧密连接形成,可有效阻止肠道内细菌及毒素等进入体内[2]。肠上皮细胞由隐窝干细胞分化而来,当细胞增殖与调亡过程发生异常时,会引起黏膜屏障结构损伤和功能障碍,细菌或毒素进入机体导致全身炎症反应综合征或多器官功能障碍[3]。此外,肠上皮细胞在肠道黏膜屏障发生病理性损伤后可起到修复因子的作用,其可通过增殖分化来替换和弥补损伤的肠上皮细胞,以保证肠上皮的完整性进而维持肠道黏膜屏障的功能[4]。临床上,许多疾病均会导致肠道黏膜屏障功能发生障碍,对患者的生命健康和生活质量产生严重影响[5]。
傣百解为萝藦科牛奶菜属植物通光散Marsdenia.tenacissima(Roxb.)Moon植物,属于傣族传统用药,是傣族最具代表的“解药”之一[6]。在我国云南省西双版纳、德宏及缅甸、老挝等傣族地区广泛使用。傣百解以根入药,性凉,味苦;入风、火、土塔;具有清火解毒、消肿止痛的功效,常用于治疗咽喉肿痛、疗疡斑疹、口舌生疮、肺热咳嗽、胃脘痛、尿痛、解药食毒及清除因饮食不洁、用药不当而致的各种不良反应[7]。傣百解已被分离出多种化学成分,并认为其具有抗肿瘤、抗生育、平喘、调节免疫和降压等作用,能显著减轻因嗜酸性粒细胞介导的气道高反应性哮喘,对抗炎性介质[8-9]。傣族认为傣百解可解百毒,并在傣族地区常用于治疗胃肠道疾病,但关于傣百解对肠道黏膜的保护作用及作用机制的药理学研究未见报道。本实验基于临床用药经验,使用不同浓度的傣百解水提物对LPS诱导的IEC-6细胞模型和小鼠急性肠道屏障功能损伤模型进行观察,明确傣百解对肠道黏膜的保护作用及作用机制,以期为临床用药及后期的进一步研究提供药理学基础。
1 材料与方法
1.1 细胞与动物 大鼠小肠隐窝上皮细胞IEC-6细胞株(ATCC,美国);40只SPF级昆明种雄性小鼠,体质量18~22 g,由四川省医学科学院实验动物研究所提供,生产许可证号:SCXK(川)2015-030。
1.2 药物制备 傣百解由云南省傣医药与彝医药重点实验室提供,称取傣百解50 g,10倍水浸泡 1 h后煎煮30 min,纱布过滤收集药液;8倍水继续煎煮剩下的药渣30 min,纱布过滤收集药液;再以6倍水煎煮药渣30 min,纱布过滤药液;合并3次的药液,浓缩至所需浓度后-20℃保存备用。细胞实验使用时先用0.22 μm过滤后稀释到所需浓度。
1.3 试剂与仪器 脂多糖LPS(Escherichia coli 055:B5,纯度:99%)购自美国Sigma公司;二甲基亚砜(DMSO) 购自 Meresco公司;IL-6(H007)、TNF-α(H052)、IL-1β(H002)、D-乳酸(H263)、RNA(N066)试剂盒和MTT(G020-1-1)均购于南京建成生物工程研究所;胎牛血清购自德国PAN-Biotech公司;青霉素-链霉素(C0222)和 0.25%胰蛋白酶(P1005)购自碧云天生物技术有限公司;DMEM高糖培养基购自美国HyClone公司;cDNA反转录试剂盒购自日本TAKARA公司;qRT-PCR引物购自上海生工生物科技有限公司,苏木素-伊红染料(中国索莱宝)。
ME104E/02电子天平(梅特勒-拖利多仪器(上海)有限公司);双门立式超低温冰箱(美国赛欧飞世尔公司);酶标仪(美国 Molecular);微量移液器(eppendorf公司);低温高速冷冻离心机(Thermo公司);核酸电泳仪(北京六一仪器厂);PCR扩增仪2720型(美国ABI公司);荧光定量PCR仪7500fast(美国ABI公司);石蜡切片机(德国莱卡);石蜡包埋机(德国莱卡)。
1.4 实验方法
1.4.1 细胞实验 IEC-6细胞在37℃、5% CO2条件下,使用含10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基在25 cm2细胞培养瓶中培养,细胞融合至70%~80%进行传代,0.25%胰酶消化处于对数生长期的IEC-6细胞接种于96孔板中,分为空白对照组、LPS组、不同浓度的傣百解组、LPS+不同浓度的傣百解组;空白对照组只加培养液,LPS组加100 μg/mL的LPS溶液,傣百解组加入不同浓度的傣百解,LPS+不同浓度的傣百解组分别加不同浓度的傣百解1 h后再加100 μg/mL LPS,每个组设6个复孔,加完试剂和药物后,放回培养箱中培养。
1.4.2 动物实验 40只昆明种雄性小鼠随机分为正常对照组、LPS组、LPS+傣百解低、高剂量组,LPS+傣百解低、高剂量组分别给予1.17、3.51 g/kg的傣百解,连续灌胃给药1周后,除正常对照组外,其余各组均一次性腹腔注射 LPS(5 mg/kg)建立小鼠肠道屏障损伤模型。
1.5 观察指标
1.5.1 傣百解干预IEC-6细胞及LPS诱导后IEC-6细胞活力的检测 IEC-6细胞以1×105个/mL接种于96孔板,24 h后换无血清培养基,待24 h细胞周期同步化后,分为对照组、不同浓度的傣百解组和LPS+不同浓度的傣百解组,分别加入相应的药物及含血清培养基,使每孔终体积为200 μL,继续在培养箱中培养 24 h后,每孔加入5 mg/mL的MTT 20 μL,放回培养箱孵育4 h后轻轻吸走上清液,每孔加DMSO 150 μL,在微孔振荡器上振荡10 min后,用酶标仪测定490 nm处的吸光度值(OD),以检测细胞相对活力。
1.5.2 ELISA检测 IEC-6细胞上清液中 IL-1β、TNF-α和IL-6含量 IEC-6细胞按1×105个/mL接种于96孔板后,分为对照组、LPS组、LPS+60、120、240 μg/mL傣百解组,药物处理24 h后收集细胞上清液,3 000 r/min离心20 min,收集上清液,严格按照试剂盒说明书检测IL-1β、TNF-α、IL-6的水平。
1.5.3 检测小鼠血清中D-乳酸的含量 建立小鼠肠道屏障损伤模型2 h后,眼球取血,严格按照试剂盒说明书测定血清中D-乳酸的含量。
1.5.4 qRT-PCR检测肠道屏障损伤后小鼠结肠IL-6、IL-1β、TNF-α的mRNA表达水平 小鼠处死后,取结肠于液氮中保存备用。将冻存后的小鼠结肠研磨,然后按RNA提取试剂盒说明书提取组织总RNA,电泳和紫外检测RNA纯度和完整度,按逆转录试剂盒说明书进行逆转录,然后以生成的cDNA作为模板进行扩增反应,检测各组结肠表达TNF-α、IL-1β、IL-6 mRNA的水平,引物序列见表1。
1.5.5 结肠组织病理学观察 小鼠结肠用10%福尔马林固定,常规石蜡包埋,切片,脱蜡后进行苏木精-伊红(HE)染色,显微镜下观察结肠组织病理形态学变化。

表1 引物序列表
1.6 统计学分析 数据采用GraphPad prim 7软件处理,结果以均数±标准差(±s)表示,采用单因素方差分析,若方差齐用LSD检验,方差不齐用Tamhane’s T2检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 傣百解对IEC-6细胞活力的影响 与对照组比较,30~480 μg/mL浓度范围内的傣百解对IEC-6细胞活力无显著差异(P>0.05),提示傣百解在30~480 μg/mL浓度范围内对IEC-6细胞活力无影响,见表2。
表2 不同浓度的傣百解对IEC-6细胞活力的影响(±s,n=6,μg/mL)

表2 不同浓度的傣百解对IEC-6细胞活力的影响(±s,n=6,μg/mL)
组别 给药剂量 细胞活力对照组 - 0.70±0.07傣百解组 30 0.65±0.12傣百解组 60 0.65±0.08傣百解组 120 0.62±0.09傣百解组 240 0.62±0.12傣百解组 480 0.66±0.11
2.2 傣百解对LPS诱导的IEC-6细胞活力的影响 与对照组比较,LPS组显著降低了IEC-6细胞的活力;与LPS组比较,30~480 μg/mL浓度范围内的傣百解可提高IEC-6细胞的活力,并且在浓度为120~480 μg/mL 时差异具有统计学意义(P<0.01),提示傣百解能对抗LPS对IEC-6细胞活力的抑制作用,见表3。
表3 不同浓度的傣百解对LPS诱导的IEC-6细胞活力的影响(±s,n=6,μg/mL)
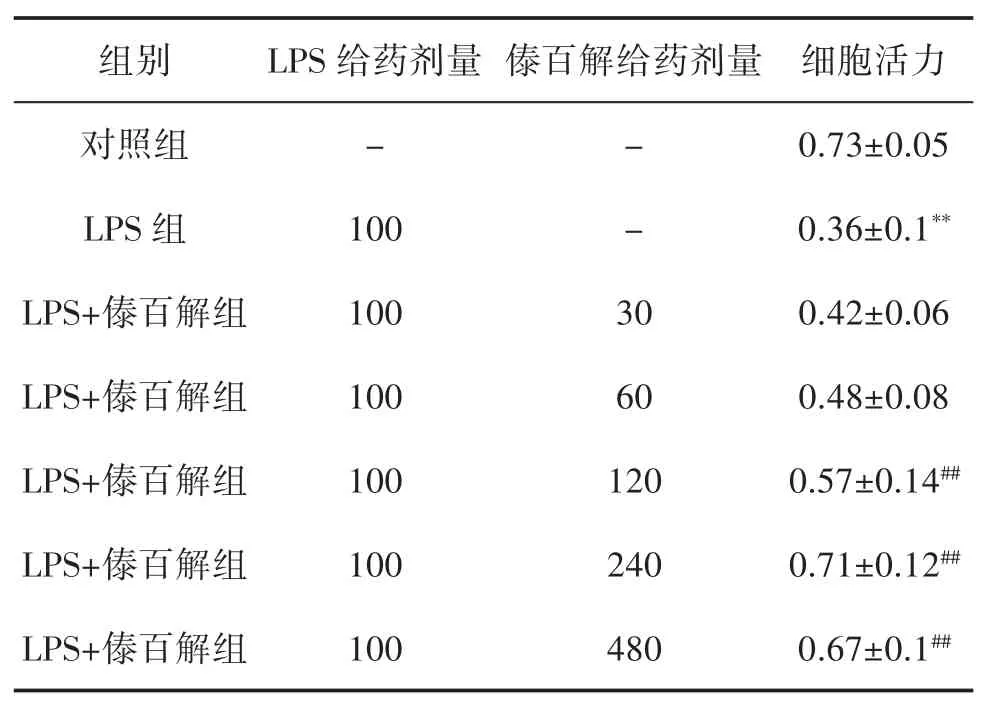
表3 不同浓度的傣百解对LPS诱导的IEC-6细胞活力的影响(±s,n=6,μg/mL)
注:与对照组比较,**P<0.01;与LPS组比较,##P<0.01。
组别 LPS给药剂量对照组 -LPS组 100傣百解给药剂量- -LPS+傣百解组 100 LPS+傣百解组 100 30 60 LPS+傣百解组 100 LPS+傣百解组 100 LPS+傣百解组 100 120 240 480细胞活力0.73±0.05 0.36±0.1**0.42±0.06 0.48±0.08 0.57±0.14##0.71±0.12##0.67±0.1##
2.3 傣百解对LPS诱导的IEC-6细胞形态的影响 结果显示,对照组细胞形态规则、呈铺石路状贴壁生长(图 1A);100 μg/mL的 LPS刺激 24 h后,IEC-6细胞大量变圆、皱缩、细胞排列杂乱、死细胞增多(图1B);而不同浓度的傣百解处理后,240 μg/mL浓度下可明显改善细胞形态,皱缩和变圆细胞减少(图1C)。
2.4 傣百解对LPS诱导的IEC-6细胞炎症因子的影响 与对照组比较,LPS组中IL-1β、TNF-α和IL-6的水平显著升高(P<0.01);与LPS组比较,不同浓度的傣百解组均能一定程度上减少IL-1β、TNF-α、IL-6 的水平,在 120 μg/mL 和 240 μg/mL 浓度时对TNF-α的降低最显著(P<0.05),提示傣百解能减轻LPS对IEC-6细胞的炎症反应,见表4。

图1 傣百解对LPS诱导的IEC-6细胞形态的影响
表4 傣百解对LPS诱导的IEC-6细胞炎症因子的影响(±s,n=6)
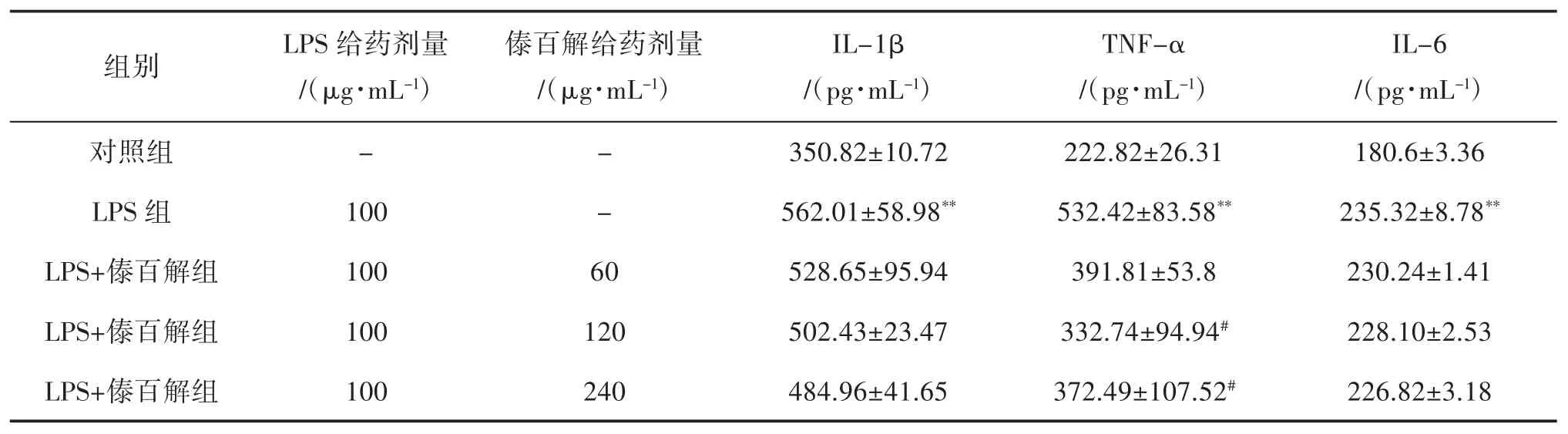
表4 傣百解对LPS诱导的IEC-6细胞炎症因子的影响(±s,n=6)
注:与对照组比较,**P<0.01;与LPS组比较,#P<0.05。
IL-6/(pg·mL-1)对照组 - - 350.82±10.72 222.82±26.31 180.6±3.36 LPS 组 100 - 562.01±58.98** 532.42±83.58** 235.32±8.78**LPS+傣百解组 100 60 528.65±95.94 391.81±53.8 230.24±1.41 LPS+傣百解组 100 120 502.43±23.47 332.74±94.94# 228.10±2.53 LPS+傣百解组 100 240 484.96±41.65 372.49±107.52# 226.82±3.18组别 LPS给药剂量/(μg·mL-1)傣百解给药剂量/(μg·mL-1)IL-1β/(pg·mL-1)TNF-α/(pg·mL-1)
2.5 傣百解对LPS诱导小鼠肠道屏障损伤模型中D-乳酸的影响 与对照组比较,LPS组D-乳酸水平显著升高(P<0.01);与LPS组比较,傣百解低、高剂量组均降低了D-乳酸的水平(P<0.05),提示傣百解能改善肠黏膜的通透性和损伤程度,见表5。
2.6 傣百解对LPS诱导的小鼠肠道屏障损伤模型IL-6、IL-1β、TNF-α mRNA的影响 与对照组比较,LPS组 IL-6、IL-1β、TNF-α mRNA 的水平显著升高(P<0.01);与LPS组比较,傣百解低、高剂量组均具有降低 IL-6、IL-1β、TNF-α mRNA 水平的作用,其中以TNF-α mRNA的水平降低最为显著(P<0.01),提示傣百解能减轻LPS诱导小鼠肠道损伤模型的炎症反应,见表5。
表5 傣百解对LPS诱导的小鼠肠道屏障损伤模型中D-乳酸的影响(±s,n=10)
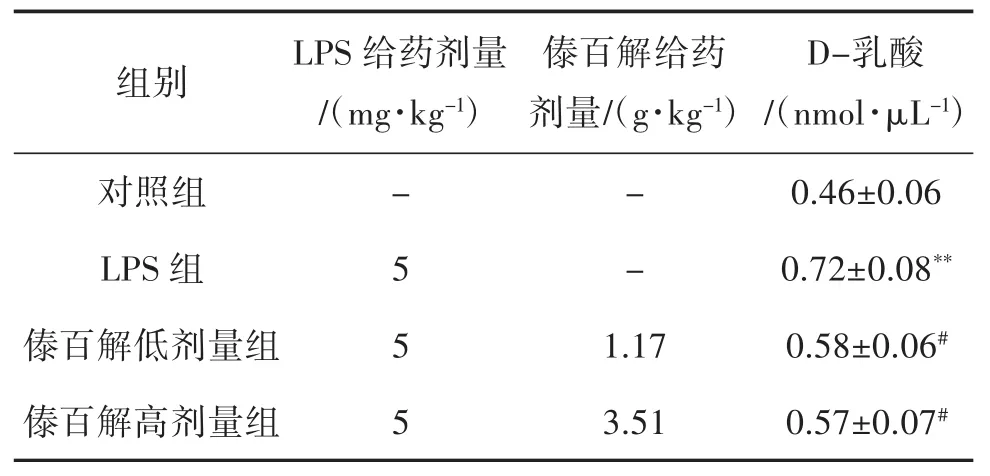
表5 傣百解对LPS诱导的小鼠肠道屏障损伤模型中D-乳酸的影响(±s,n=10)
注:与对照组比较,**P<0.01;与LPS组比较,#P<0.05。
组别 LPS给药剂量/(mg·kg-1)对照组 -LPS组 5傣百解给药剂量/(g·kg-1)- -傣百解低剂量组 51.17傣百解高剂量组 53.51 D-乳酸/(nmol·μL-1)0.46±0.06 0.72±0.08**0.58±0.06#0.57±0.07#
2.7 傣百解对LPS诱导的肠炎小鼠结肠病理学的影响 显微镜下显示,正常组小鼠结肠组织结构完好,绒毛排列整齐,肠腺轮廓清晰完整,上皮完好。LPS组肠绒毛肿胀、断裂,局部上皮细胞坏死。治疗组小鼠小肠组织病理变化较模型组均有改善,黏膜组织层次分明,黏膜绒毛及腺体排列紊乱程度减轻,见图2。
表5 傣百解对LPS诱导的小鼠肠道屏障损伤模型IL-6、IL-1β、TNF-α mRNA的影响(±s,n=10)

表5 傣百解对LPS诱导的小鼠肠道屏障损伤模型IL-6、IL-1β、TNF-α mRNA的影响(±s,n=10)
注:与对照组比较,**P<0.01;与LPS组比较,##P<0.01。
组别 LPS给药剂量/(mg·kg-1)傣百解给药剂量/(g·kg-1)IL-6IL-1βTNF-α对照组 - - 1.35±0.11 1.42±0.06 1.18±0.07 LPS 组 5 - 23.36±2.91** 12.02±3.45** 5.03±0.84**傣百解低剂量组 5 1.17 15.83±5.12 10.79±0.45 2.80±0.67##傣百解高剂量组 5 3.51 15.54±4.91 8.06±2.52 2.49±0.67##

图2 傣百解对LPS诱导的肠炎小鼠结肠病理学的影响(×100)
3 讨论
肠上皮细胞损伤在危重病发展过程中起着非常重要的作用,而小肠上皮细胞的增殖是肠道黏膜病理性损伤后修复,重建上皮完整性和维护黏膜屏障的关键,积极防护肠上皮细胞的损害对维持肠道黏膜屏障功能具有重要意义[10]。LPS在人肠腔内大量存在,是革兰氏阴性菌细胞壁的主要成分,也是引发炎症的重要因子[11]。机体处于正常状态时,肠腔内细菌及内毒素不能通过肠屏障进入机体,当肠黏膜屏障损伤时,肠道内致病菌及毒素进入,引起内毒素血症并刺激机体产生炎症因子,导致局部或系统性炎症反应,炎症反应又可进一步损害肠道屏障功能[12]。研究发现细菌或内毒素侵染肠黏膜上皮细胞后,能够诱导紧密连接蛋白的磷酸化和去磷酸化,损伤细胞间紧密连接,导致肠黏膜通透性增加,从而影响黏膜屏障的保护功能[13]。本研究结果表明,LPS刺激IEC-6细胞24h后细胞变圆甚至死亡,细胞活力显著下降,小鼠一次性腹腔注射5 mg/kg的LPS可引起明显的精神萎靡、腹泻等肠炎症状。因此,在后续实验中选用了在相应剂量下的IEC-6细胞体外模型和小鼠肠道屏障损伤模型来研究傣百解对肠道屏障的保护作用。
肠黏膜损伤后,细菌和内毒素进入机体,导致机体产生免疫应答和炎症反应,释放出大量的IL-6、IL-1β、TNF-α 等炎症细胞因子[14]。IL-6、IL-1β、TNF-α作为主要的促炎因子,在炎症进展和急性炎症瀑布式爆发中起着非常重要的作用[15-16]。TNF-α可激活鞘磷脂酶介导细胞凋亡途径,诱导上皮细胞和固有层细胞中基质金属蛋白酶(MMPs)1和3活化,导致组织损伤[17]。TNF-α的升高还可导致紧密连接蛋白表达降低,从而增加肠道细胞通透性,临床已证明抗TNF-α治疗对肠道炎症疾病的疗效[18]。IL-6作为重要的炎症介质,具有聚集炎症因子,在肠炎疾病的发病中起着主要作用,参与肠道紧密连接的调节,应用IL-6抗体治疗能够改善小鼠肠道通透性[19-20]。研究显示,肠道黏膜组织中的IL-1β在炎性条件下显著升高,升高程度与肠道炎症严重程度正相关,并能增加肠道通透性[21]。本实验结果发现,不同浓度的傣百解水提物对IEC-6细胞活力没有显著影响,LPS诱导IEC-6细胞后,通过傣百解水提物的干预能提高IEC-6细胞的活力。傣百解可降低LPS诱导的 IEC-6细胞中IL-1β、TNF-α和IL-6的水平及小鼠肠组织中IL-6、IL-1β、TNF-α mRNA的水平,具有抗炎作用。
D-乳酸属于细菌的一种代谢产物,当肠黏膜屏障完整时,D-乳酸不能释放入血;当肠黏膜受损后,细菌易位,则血液中可检测出D-乳酸,因此,D-乳酸的水平可反映肠黏膜通透性和损伤程度[22-23]。实验结果显示,傣百解可降低LPS诱导后小鼠血清中D-乳酸含量,病理观察显示傣百解能够降低结肠组织的损伤情况,提示傣百解能改善肠黏膜的通透性和损伤程度。
综上所述,傣百解能提高LPS诱导后的IEC-6细胞活力,并能减轻由LPS诱导后产生的炎症因子水平及其mRNA的表达,降低小鼠血清中D-乳酸含量,减轻小鼠结肠损伤,提示傣百解对肠道黏膜屏障功能具有保护作用,其作用机制可能与减轻炎症反应有关。

