GhMYB43 负调控木质素的生物合成和茉莉酸信号
沈吉丽,肖胜华,惠慧,努日曼古丽·艾尼,胡琴,张晓君,杨兆光,聂新辉*,朱龙付*
(1.石河子大学农学院,新疆 石河子832000;2.华中农业大学/ 作物遗传改良国家重点实验室,武汉430070)
棉花(Gossypium hirsutum)是重要的经济作物之一,已在世界范围内种植,而病害是其产量和品质的主要限制因素[1]。 黄萎病在中国是棉花生产中危害最严重的病害之一[2]。 木质素是维管束植物次级细胞壁(Secondary cell wall,SCW)的重要成分[3]。 木质素的生物合成受发育信号和环境刺激的控制,例如紫外线照射、伤口和病原侵染[4-5]。 在拟南芥中,SG2 型R2R3-MYB 转录因子(V-myb avian myeloblastosis viral oncogene homolog)MYB15 是防御诱导的木质化和先天免疫的调节因子[6]。 GhLac15 通过增强防御诱导的木质化来提高对黄萎病的抗性[7]。 尽管已经报道了涉及木质素生物合成的许多基因,但是目前在棉花中报道的调控木质素生物合成的MYB 转录因子还很少。
茉莉酸(Jasmonic acid,JA)是1 种脂源性植物激素, 可调节植物免疫和发育的各个方面[8-9]。曾报道GbWRKY1 在JA 介导的防卫基因诱导转录中具有明显的负调控作用,这表明GbWRKY1可能是通过负调控JA 信号通路(转导途径)在植物抗病性反应中起作用。 GhHB12 参与对大丽轮枝菌(Verticlillium dahliae)和JA 信号的响应,并且GhHB12 仅抑制某些JA 响应基因(GhJAZ2和GhPR3)表达,但不抑制棉花的整个JA 信号通路[10-11]。 如何激活棉花与大丽轮枝菌互作过程中JA 的合成和信号通路尚待探索。
植物转录因子MYB 是最大的转录因子家族之一,与植物生长发育、生理代谢、细胞的形态和模式建成等生理过程有关[12]。 已通过遗传分析和分子分析对MYB 类转录因子在许多植物物种中的功能进行了研究, 例如拟南芥(Arabidopsis thaliana)、玉米(Zea mays)、水稻(Oryza sativa)、矮牵牛 (Petunia hybrida)、 金鱼草(Antirrhinum majus)、 葡萄 (Vitis vinifera L.)、 杨树(Populus tremuloides) 和苹果 (Malus domestica)[13]。 At-MYB125 是控制雄性生殖细胞分裂和分化的花粉特异性因子[14];AtMYB33 和AtMYB65 促进了花药和花粉的发育[15];MYB189 在拟南芥和毛果杨(P.trichocarpa)中的过表达导致木质素、纤维素和半纤维素的含量显著降低,并且使茎中的维管发育受到明显抑制,导致木质部纤维的次生细胞壁厚度显著降低[16]。 SlMYB21 对JA 生物合成具有正向调节作用,而对生长素和赤霉素则具有负向调节作用。 结果表明,SlMYB21 至少部分介导JA 的作用,并可能控制花到果的过渡[17]。然而,关于MYB 在棉花防御反应中调控JA 信号通路的作用的报道很少。
近年来,棉花黄萎病的发生给棉花产业的可持续发展造成了严重的影响,并且陆地棉中缺乏有效的抗源。 抗病基因鉴定及其抗病机制研究对于棉花多抗种质资源创新具有重要意义。 因此,本研究筛选到1 个GhLac1 上游的R2R3-MYB类调节因子基因,通过超表达和病毒诱导的基因沉默(Virus-induced gene silencing, VIGS)技术,对其功能进行初步鉴定,进一步探讨棉花对黄萎病的反应机制,为棉花抗病育种提供理论依据和基因资源。
1 材料与方法
1.1 植物材料
供试植物材料: 黄萎病感病品种陆地棉Jin668(G.hirsutum L.cv.Jin668),耐病品种海岛棉7124(G.barbadense L.cv.7124,简称“海7124”)及陆地棉YZ1 (Gossypium hirsutum cv.YZ1),均由华中农业大学棉花课题组保存。
烟草材料为本氏烟(Nicotiana benthamiana),种植于华中农业大学棉花楼附楼光照培养室。
1.2 酵母单杂交(Yeast one hybrid, Y1H)
将目的基因启动子(Bait) 重组在载体质粒pHISi-1 上, 将重组好的质粒进行聚合酶链反应(Polymerase chain reaction,PCR)阳性检测,并测序比对,保证目的序列无突变。 将重组质粒转化的Y1H 菌株涂布于含有0、15、30 mmol·L-13-氨基-1,2,4- 三唑(3-AT)的SD/-Trp/-His 营养缺陷型培养基上,进行酵母互作分析,将培养基置于30 ℃恒温培养箱培养4~6 d, 观察菌斑的生长情况[18]。
1.3 GhMYB43 基因的序列分析和植物转化
GhMYB43 基因的全长序列可从网站https://cottonfgd.org/ 获得。 分别使用ClustalX(http://www.clustal.org/)和MEGA5(http://www.megasoftware.net/)比对氨基酸序列和构建系统发育树。
从Jin668 克隆全长GhMYB43, 并通过attB与attP 位点(BP)重组和attL 与atRR 位点重组(Invitrogen)插入Gateway 载体pK2GW7.0(Ghent University)中,以生成过表达载体。根据先前的研究方法[19],通过根癌农杆菌(菌株GV3101)介导法用GhMYB43 过表达载体转化Jin668。
1.4 供试菌株、载体
所用的菌株是大肠杆菌TOP10 和根癌农杆菌GV3101 菌株, 它们均由本研究小组储存在20%(质量分数)的甘油中,并储存在-80 ℃的超低温冰箱中。
所用的载体:中间载体pDONER221、pDONERZ60、pGBKT7、pGADTT7 等,亚细胞定位载体pMDC43, 均 保 存 在-80 ℃;VIGS 中 间 载 体pTRV1、pIRV2、pTRVCLA,由荷兰瓦赫宁根大学Bart P. H. J. Thomma 教授提供, 保存在本课题组; 超表达载体pGWB409 和干涉载体pHellsgate4 保存于本课题组。
1.5 棉花DNA 及RNA 的提取
棉花DNA 提取主要参照天根植物DNA 提取试剂盒(Tiangen Biotech,DP305),具体操作步骤参见产品说明。 采用天根生化科技有限公司RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(DP441)提取棉花不同组织的RNA。
1.6 RNA 逆转录(RT)及实时定量PCR 分析
从-80 ℃冰箱中取出提取备用的RNA,通过0.1%(质量分数) 琼脂糖凝胶电泳检测RNA的完整性, 用NanoDrop 2000 分光光度计(Thermo)测定核酸浓度。 RNA 逆转录具体操作步骤:①基因组DNA 的除去反应。 加入2.0 μL 的5×gDNA Eraser Buffer,1.0 μL 的 gDNA Eraser,RNA 总量≤1.0 μg, 用RNA Free ddH2O 补充体系到10.0 μL。 于42 ℃温浴2 min 或者室温放置30 min,放于4 ℃冰箱或置于冰上备用。 ②RNA逆 转 录 反 应。 5×PrimeScriptBuffer 2(Real Time)4.0 μL,1.0 μL PrimeScriptRT Enzyme Mix Ⅰ,1.0 μL RT Primer Mix,10.0 μL 的步骤①反应液,4.0 μL RNase Free ddH2O。逆转录反应在37 ℃的水浴中进行15 min (或用PCR 仪完成此步),然后酶灭活反应在85 ℃的高温水浴中进行5 s,将合成的cDNA 置于-20 ℃冰箱保存。
RT-qPCR 具体操作步骤: 将逆转录得到的cDNA 取出,加水稀释100 倍后作为反应模板。先加入SYBR Green mix(Bio-Rad),7.5 μL;再加入正反向引物各0.25 μL;最后,加入稀释好的cDNA模板。 使用ABI Prism 7500 Sequence Detection System 仪器和软件(Applied Biosystems,USA)检测, 程序为95 ℃1 min,95 ℃15 s,60 ℃35 s,40个循环。 每个反应3 次生物学重复。 本研究所用RT-qPCR 引物序列见表1。
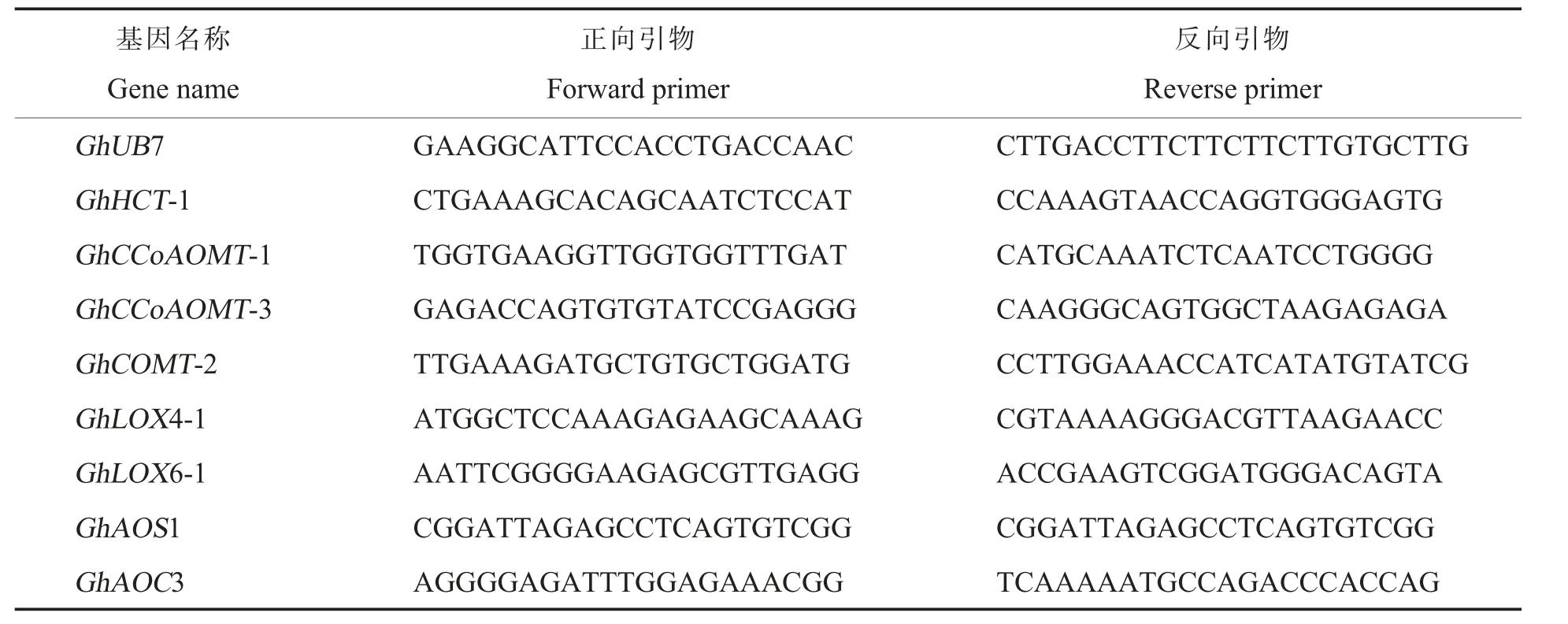
表1 RT-qPCR 引物序列Table 1 RT-qPCR primers used in this study
1.7 亚细胞定位分析
采用农杆菌转化法, 用构建好的35S∷Gh-MYB43-GFP 融合表达载体、空载体(35S-GFP)转化农杆菌菌株GV3101。按照烟草瞬时转化法,选取培养3 周的烟草,将准备好的农杆菌菌液注射到完整且平展的烟草叶片中。 注射后对侵染的烟草叶片避光处理,48 h 后在荧光共聚焦显微镜下观察并拍照。
1.8 VIGS 分析
使用BamHⅠ和KpnⅠ将GhMYB43 的cDNA 序列克隆到基于烟草脆裂病毒(Tobaceo rattle virus, TRV) 的质粒中, 以构建TRV∷Gh-MYB43 VIGS 载体,然后如前所述通过电转化法转化到根癌农杆菌GV3101 中[19]。如前所述[20],使用无针注射器将携带TRV∷00(对照)和TRV∷GhMYB43 载体的农杆菌注射到已生长10 d 的海7124 幼苗的子叶中。侵染约10 d 后,从棉花根中提取RNA 以测定GhMYB43 的表达水平。 保持在25~28 ℃的恒定温度下,光周期(暗/ 光)为8 h/16 h,相对湿度为60%。
1.9 超表达载体的构建
根据获得的全长GhMYB43 cDNA 设计引物。 将SacⅠ和XbaⅠ的酶切位点和保护碱基分别添加到引物的两端。然后,以GhMYB43 基因的cDNA 为模板进行PCR 扩增。 PCR 产物用SacⅠ和XbaⅠ酶切, 并用DNA Recovery Kit(Qiagen DNA 回收试剂盒)回收。pGEB409 和pHellsgate4也用SacⅠ和XbaⅠ双酶切, 大片段用DNA Recovery Kit 回收。 将回收的PCR 片段与大载体片段在4 ℃下连接,并通过PCR 验证连接产物。 将构建的过表达和干涉载体转化到农杆菌中。
1.10 Southern 杂交(地高辛标记法)
为确定转GhMYB43 基因株系的DNA 序列拷贝数,采用植物基因组DNA 试剂盒DP305(天根生化科技有限公司)提取基因组DNA。用HindⅢ(新英格兰生物实验室) 酶切20 mg 基因组DNA 60 h, 根据制造商的说明, 使用DIG-High Prime DNA 标记和检测起始试剂盒Ⅱ(Roche)进行Southern 杂交。 用nptⅡ基因片段作为探针检测拷贝数。
1.11 黄萎病菌接种和病情分析
用大丽轮枝菌菌株V991 接种Jin668(野生型,WT) 和转基因系的幼苗。 保持培养在25~28 ℃的恒定温度下,光周期(暗/ 光)为8 h/16 h,相对湿度为60%。持续观察病情。每处理使用至少25 株的病情指数和发病率进行统计,并重复至少3 次。 根据Xu 等[21]公式计算病情指数和发病率。
1.12 组织化学染色和总木质素含量的测定
在接种后第13 天, 从接种的棉花和经水处理的棉株根部手工切出横截面。 使用Wiesner 试剂检查木质素的组织化学。 将根部横截面在体积分数4%的间苯三酚溶液 (其中乙醇体积分数95%)或95%(体积分数)乙醇(染色对照)中孵育10 min, 然后用9%(质量分数)HCl 处理5 min,然 后 直 接 用 立 体 显 微 镜(MZFLIII,Leica,Wetzlar,德国)观察。
根据以前的研究[22],使用木质素- 巯基乙酸反应确定无蛋白的细胞壁馏分中根和幼叶的木质素含量(质量分数,以干物质计),至少3 个生物学重复。
2 结果与分析
2.1 GhMYB43 基因的克隆及序列特征分析
在以前的研究中,证明超量表达棉花漆酶基因GhLac1 能增强棉花对各种病虫害的广谱抗性[23]。通过Y1H 技术从棉花转录因子酵母文库中筛选到与GhLac1 启动子结合的转录因子Gh_D12G0544。 生物信息学初步分析结果显示,其编码基因位于陆地棉Dt 亚组第12 号染色体上,开放阅读框为1 131 bp,包含2 个内含子和3个外显子,编码1 个含376 个氨基酸残基的蛋白质 (图1)。 根据NCBI 的Protein 数据库和Nucleotide 数据库中已提交的Gh_D12G0544 在不同物种中的同源序列,并考虑物种间亲缘关系的远近,选取甜橙(Citrus sinensis)、榴莲(Durio zibethinus)、雷蒙德氏棉(Gossypium raimondii)、哥伦比亚锦葵(Herrania umbratica)、胡杨(Populus euphratica)、可可树(Theobroma cacao)、金丝小枣(Ziziphus jujuba)、拟南芥等物种的Gh_D12G0544同源蛋白序列构建系统进化树,发现该蛋白与拟南芥中AtMYB43 和雷蒙德氏棉中GrODORANT1 同源性最高,因此命名为GhMYB43。氨基酸序列比对分析发现,GhMYB43 含有2 个MYB 结构域,属于典型的R2R3 类MYB 转录因子(图2)。

图1 GhMYB43 的基因克隆和结构分析Fig. 1 Gene cloning and structure analysis of GhMYB43
2.2 GhMYB43 基因的转录模式分析
在GhMYB43 的3' 非编码区(3'-untranslated region,3'UTR)设计特异引物,通过组织转录模式分析发现,GhMYB43 在茎中优势转录,在其他组织中略有转录(图3a)。 诱导转录模式分析表明,GhMYB43 受水杨酸(Salicylic acid, SA)和H2O2诱导转录水平上升(图3b、c), 而受茉莉酸甲酯(Methyl jasmonate, Me-JA) 诱导转录水平下降(图3d)。由此猜测GhMYB43 可能参与了这些激素信号通路的调控。 而在接菌诱导转录模式分析中,发现GhMYB43 在接菌后6 h、12 h、24 h 时受诱导显著上调转录,而在48 h 后又受诱导下调转录(图3e),推测GhMYB43 可能参与棉花抗黄萎病调控。
2.3 GhMYB43 亚细胞定位分析
通过激光共聚焦显微镜观察发现,在转化空载体(35S-GFP)的烟草幼嫩叶片细胞膜、细胞质以及细胞核中均能观察到绿色荧光, 而35S∷GhMYB43-GFP 与核标记基因AtHY5-RFP 共定位于细胞核(图4)。因此,认为GhMYB43 是1 个核定位蛋白,符合一般转录因子特征。
2.4 GhMYB43 自激活活性分析
在棉花原生质体中利用双荧光素酶检测系统对GhMYB43 的转录活性进行验证, 结果显示,在正常培养条件(25 ℃培养16 h)下,与空载体(Control)对比,融合GAL4DB 的GhMYB43蛋白对荧光素酶有2.4 倍的转录激活活性 (图5)。初步证实,GhMYB43 是1 个具有转录激活活性的转录因子。
2.5 GhMYB43 负调控棉花对黄萎病菌的抗性
通过对以棉花Jin668 为受体材料遗传转化获得的转基因材料进行拷贝数分析(Southern blotting)以及转录水平测定,筛选了转录水平符合预期的、 低拷贝的3 个超表达株系OE-77、OE-81 和OE-8 进行后续研究 (图6a、b)。 对超表达Gh-MYB43 转基因株系进行了黄萎病菌V991 接种鉴定,结果表明:与野生型(WT)相比,超表达Gh-MYB43 转基因系对黄萎病菌V991 抗性减弱,出现典型的黄萎病症状,如叶片黄化、萎蔫脱落等(图6c), 相应的病情指数和发病率也支持该结果(图6d)。此外,剖秆鉴定和真菌恢复培养的结果与表型结果相符(图6e、f)。 以上结果表明, 超表达Gh-MYB43 转基因株系对黄萎病菌的敏感性增强。

图2 GhMYB43 同源蛋白序列系统进化树和同源蛋白质多重序列比对Fig. 2 Phylogenetic tree and multiple sequence alignment homologous proteins of GhMYB43

图3 GhMYB43 组织诱导转录和诱导转录模式分析Fig. 3 Tissue expression patterns and induced expression patterns of GhMYB43 analyzed by RT-qPCR
为了进一步鉴定GhMYB43 在棉花响应黄萎病菌侵染中的功能, 构建了GhMYB43 的VIGS 载体, 通过特异干涉棉花中GhMYB43 基因的表达考察棉花植株对病原菌抗性的变化。 棉花CLA 基因参与叶绿素的形成,VIGS 抑制CLA的表达后会造成棉花植株叶片白化(图7a),因此可作为阳性对照。通过RT-qPCR 分析,与TRV∷00对照相比,TRV∷GhMYB43 植株的GhMYB43转录水平明显降低(图7b),黄萎病症状较轻(图7c)。 从发病率和病情指数可以看出,TRV∷Gh-MYB43 植株发病率明显低于TRV∷00 植株(图7d);剖秆鉴定和真菌恢复培养结果也与表型结果相符(图7e、f)。以上结果表明,抑制GhMYB43 转录会增强棉花植株对黄萎病菌的抗性。

图4 GhMYB43 亚细胞定位Fig. 4 Subcellular localization of GhMYB43
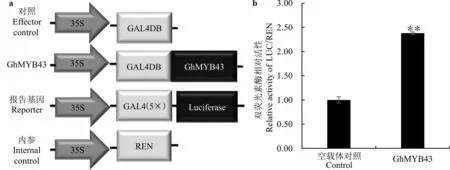
图5 GhMYB43 棉花原生质体中的转录激活活性的分析Fig. 5 Transcriptional activity assay of GhMYB43 in cotton protoplasts
2.6 GhMYB43 是木质素合成中的负调节因子
在前期研究中,发现木质素代谢在棉花抵御黄萎病菌入侵的过程中发挥重要作用[21]。 而多有文献报道, 木质素代谢主要由NAC、MYB 等其他转录因子调控。 据此笔者猜测GhMYB43 可能也参与调节木质素合成通路[24-26]。 因此,首先对超表达GhMYB43 转基因材料和对照材料(WT)中的木质素进行了组织化学染色和含量测定。从结果可以看出,无论水处理或V991 接种处理,转Gh MYB43 基因材料的染色程度均低于野生型材料(图8a), 表明转GhMYB43 基因材料的木质素积累低于对照材料。且木质素含量测定结果与染色结果相符,超表达GhMYB43 转基因材料的木质素含量明显低于对照材料(图8b)。
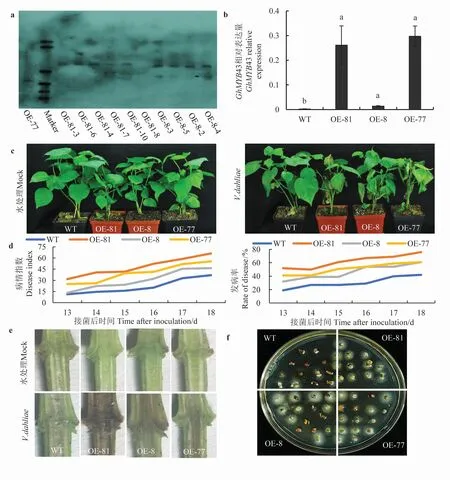
图6 超表达GhMYB43 抑制了转基因材料对黄萎病菌的抗性Fig. 6 Overexpressing of GhMYB43 impair cotton resistance to Verticillium dahliae

图7 VIGS 抑制棉花GhMYB43 的表达情况及其对黄萎病菌的抗性鉴定结果Fig. 7 VIGS inhibition of the expression of GhMYB43 in cotton and its resistance to Verticillium dahliae
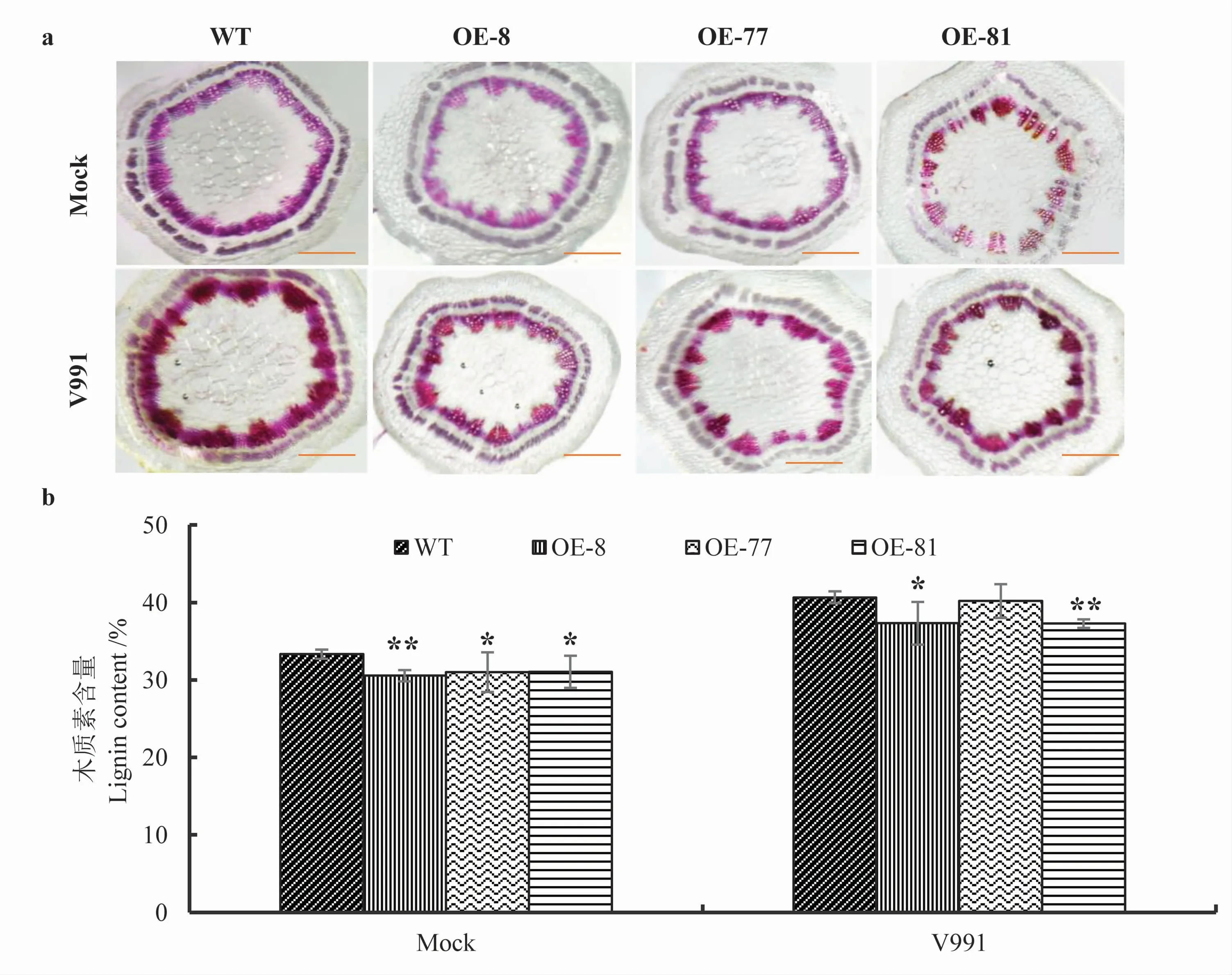
图8 超表达GhMYB43 棉花的木质素含量情况Fig. 8 Lignin content of cotton overexpressing GhMYB43
为了探索GhMYB43 在木质素代谢中的功能,分析了木质素合成相关基因的转录水平。 在水处理条件下, 与WT 植株相比, 超表达Gh-MYB43 株系中的GhHCT-1、GhCCoAOMT-3 基因的转录水平降低(图9a)。 同时,在V991 处理下,超表达GhMYB43 株系中的GhHCT-1、GhCCoAOMT-3 基因的转录水平也比WT 植株的低(图9b)。 还检测了TRV∷GhMYB43 和TRV∷00幼苗中这类基因的转录水平,发现无论是水处理还是接种V991 处理, 与TRV∷00 幼苗相比,TRV ∷GhMYB43 幼 苗 中 GhHCT-1、GhCCoAOMT-1 和GhCOMT-2 的转录水平均较高(图9c、d)。 这些结果表明,GhMYB43 在木质素合成中充当负调节因子。
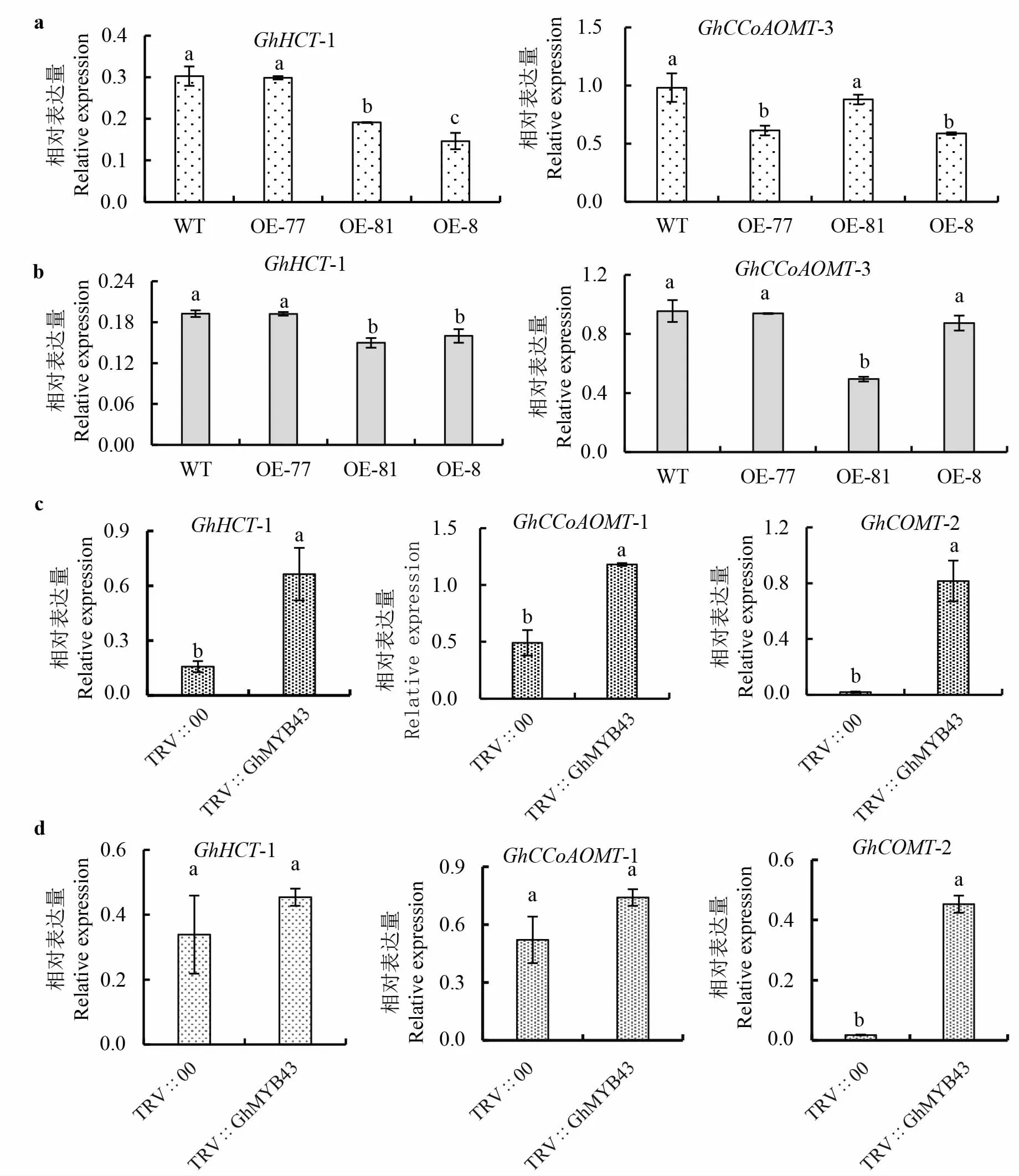
图9 GhMYB43 负调控木质素合成相关基因的表达Fig. 9 GhMYB43 negatively regulates the expression level of genes involved in lignin synthesis
2.7 GhMYB43 负调控JA 信号通路
JA 在棉花对大丽轮枝菌的抗性中起重要作用。 基于病原从根部侵染棉花的考虑,分析了接种后根部JA 信号通路基因的转录水平,结果表明,在水处理(Mock)和V991 处理下,超表达GhMYB43 显著降低了JA 代谢和信号通路基因 的 转 录 水 平, 例 如GhLOX4-1、GhLOX6-1、GhAOS1 和GhAOC3(图10a)。 相反,VIGS 抑制GhMYB43 的表达后,JA 代谢和信号转导途径基因的表达水平在接种V991 和Mock 处理中都 上 调, 并 且 在 接 菌 后,GhLOX4-1、GhAOS1、GhAOC3 的表达显著上调(图10b)。 这些结果表明,GhMYB43 是JA 信号通路中重要的负调节因子。
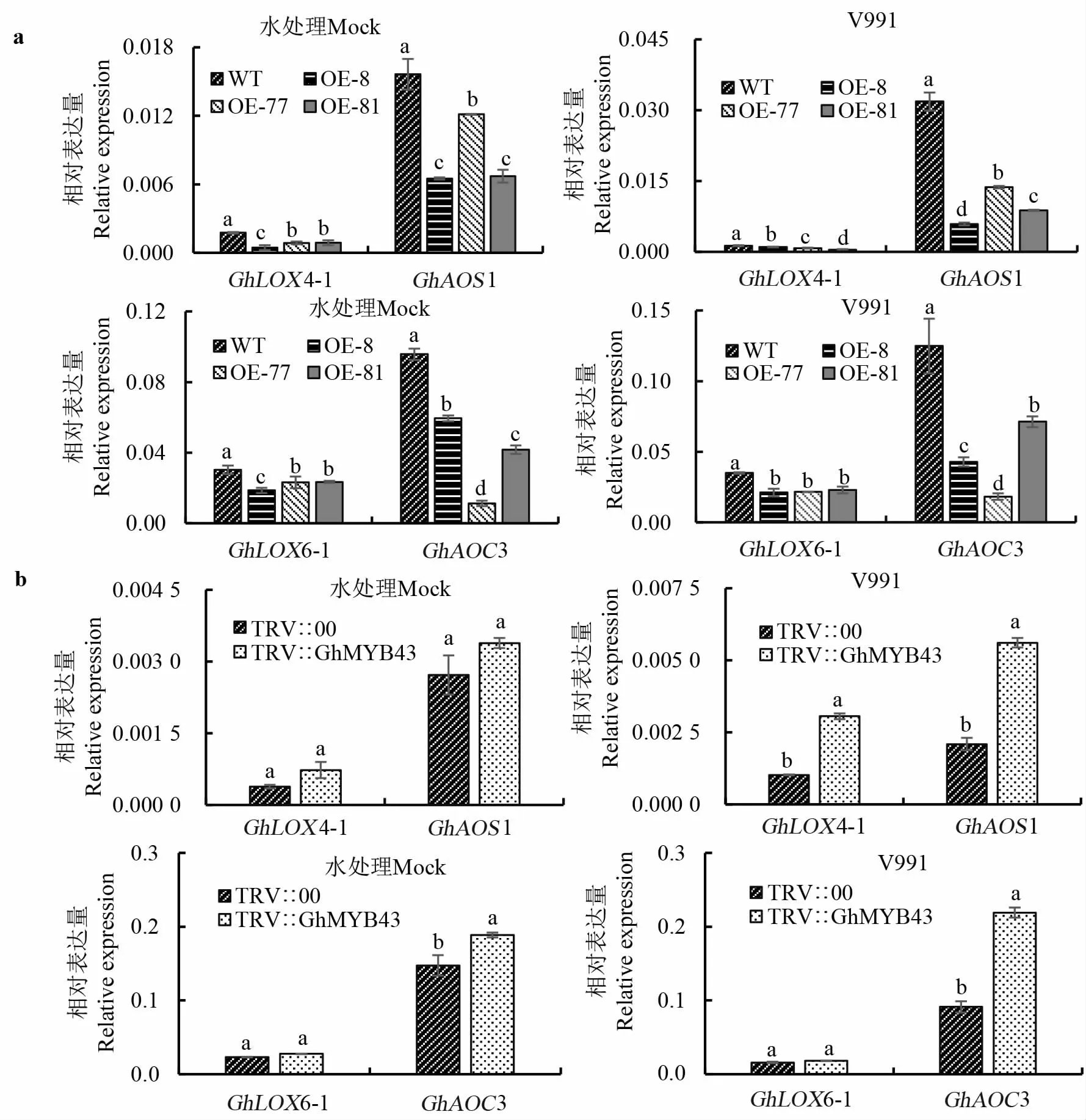
图10 GhMYB43 负调控JA 激素合成相关基因的表达Fig. 10 GhMYB43 negatively regulates the expression level of genes involved in JA synthesis
3 讨论
植物细胞壁由纤维素、半纤维素、木质素和果胶多糖以及少量结构蛋白组成, 是1 种动态结构, 通常决定植物与病原体之间相互作用的结果[27-28]。 木质素代谢在植物病害和棉花对大丽轮枝菌抗性中发挥积极作用。 细胞壁中木质素含量越高,植物抗病性越强[22,28]。 GhLAC15 的过表达显著提高了拟南芥的木质素含量,从而提高了拟南芥对黄萎病的抗性[7]。 GhLac1 的过度表达导致木质化程度增加,与增强对真菌V. dahliae的耐受性相关[23]。 本研究发现, 棉花接种V.dahliae 后木质素合成相关基因和木质素含量显著增加。 研究还发现,在抑制木质素代谢之后,棉花黄萎病发生加重。 然而,最近的研究表明,降低次生细胞壁的木质素含量会产生损伤相关分子模式(Damage-associatedmolecularpattern,DAMP),并可能诱导免疫激活[29]。因此,木质素代谢与免疫激活的关系还比较复杂。 以往的研究发现,调节木质素合成的转录因子有多种, 如AtMYB15、PtoMYB156、OsSND2、GhUMC1、MYB20、MYB42、MYB43、MYB85、LTF1、GhFSN5、CmMYB8、GbERF1-like[6,9,24-26,30-32]。 本 研 究 发 现GhMYB43也是1 种木质素代谢调节因子。 对木质素含量及相关基因表达的分析表明,GhMYB43 是木质素代谢的负调节因子,但GhMYB43 与其他调节因子的相互作用及具体作用方式尚不清楚。
JA 合成及其信号转导途径在植物抗黄萎病中起着重要作用[33]。 已经鉴定了调节JA 合成或信号转导途径的几个关键基因。CPK33 通过促进茉莉酸合成酶基因OPR3 的降解来减少JA 的积累,从而削弱抗病性[34]。 GbWRKY1 通过激活JAZ1 表达来减弱JA 信号,因此起负调节因子的作用[10]。 本研究发现GhMYB43 可以调节JA 合成相关基因的转录水平。 参与JA 合成调控的基因在超表达GhMYB43 株系中下调表达。 同时,当GhMYB43 转录被抑制时, 棉花中JA 合成或信号转导途径相关基因的转录上调, 表明Gh-MYB43 对JA 合成有负调控作用。但其具体机制仍需进一步研究。 此外,JA 的合成和代谢可能与木质素合成代谢有关。 JA 合成和信号转导途径基因表达的变化可以引起木质素代谢的变化,同时木质素代谢的变化也可以引起JA 合成或代谢的变化[35-36]。这表明JA 合成与木质素合成之间的相互作用有多种调控途径。 本研究发现,Gh-MYB43 可以同时调节JA 的合成和木质素的合成, 但GhMYB43 是否能调节JA 引起的木质素合成尚需进一步研究。
4 结论
在本实验室已有的研究基础上, 从陆地棉Jin668 中克隆了1 个R2R3 类MYB 转录因子基因。 氨基酸序列分析显示,该基因编码的蛋白含有2 个MYB 结构域, 且与拟南芥的AtMYB43具有较高的相似性; 因此, 将其命名为Gh-MYB43。 GhMYB43 位于陆地棉Dt 亚组第12 号染色体上, 编码1 个含376 个氨基酸的蛋白质,具有2 个外显子和3 个内含子。RT-qPCR 分析发现GhMYB43 在茎中优势转录,受SA 和H2O2诱导上调表达,而受Me-JA 诱导下调表达,且转录水平会受V.dahliae 诱导。亚细胞定位结果显示,GhMYB43 蛋白定位于细胞核且具有转录激活活性。 抗病性鉴定发现,抑制GhMYB43 转录会增强棉花植株对黄萎病菌的抗性, 超表达Gh-MYB43 增强了棉花对黄萎病菌的敏感性。RT-qPCR 结果、木质素组织化学染色和含量测定结果表明,GhMYB43 负调控木质素合成和JA 信号通路相关基因的转录。

